血清FGL1、LncSChLAP1对晚期非小细胞肺癌免疫治疗效果及预后评估的价值
2024-04-16夏宁周泽军方申存王尊乔潘宴青
夏宁,周泽军,方申存,王尊乔,潘宴青
肺癌是全球癌症相关死亡的主要原因,非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%[1]。NSCLC起病隐匿,许多患者确诊时已为晚期。晚期NSCLC的治疗包括化疗、分子靶向治疗及免疫治疗等,特别是免疫治疗是近年来晚期NSCLC的重要治疗进展[2-3]。纤维蛋白样因子1(fibrinogen like protein 1,FGL1) 是纤维蛋白原家族成员,具有促进细胞增殖和代谢的生物学作用[4]。研究证实,FGL1是淋巴细胞活化基因3的一种新出现的检查点配体,以FGL1为靶点的免疫治疗是下一代免疫检查点抑制剂研发的方向[5]。长链非编码RNA SChLAP1(long non-coding RNA SChLAP1, LncSChLAP1)编码基因位于2q31.3。研究报道,LncSChLAP1在前列腺癌、膀胱癌等恶性肿瘤中表达升高,介导肿瘤细胞的恶性增殖、转移及耐药性形成[6-7]。为此,本研究通过检测接受免疫治疗的晚期NSCLC患者血清FGL1、LncSChLAP1水平,分析两者对治疗疗效及预后的评估价值,报道如下。
1 资料与方法
1.1 临床资料 选取2019年4月—2022年12月南京市胸科医院呼吸内科诊治晚期NSCLC患者98例为NSCLC组,男62例,女36例,年龄34~81(65.24±7.29)岁,有吸烟史35例;病理类型:肺腺癌60例,肺鳞癌38例;TNM分期:Ⅲb期58例,Ⅳ期40例;肿瘤分化程度:高分化30例,中分化44例,低分化24例;免疫治疗线数:一线52例,二线30例,三线及以上16例。选取医院同期健康体检者50例作为健康对照组,男30例,女20例,年龄32~79(64.97±8.06)岁;有吸烟史15例。2组入选者性别、年龄及吸烟史比较,差异无统计学意义(P均>0.05),具有可比性。本研究已经获得医院伦理委员会批准(2023-KL003-01),受试者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①年龄大于18岁;②经病理组织学确诊为晚期NSCLC患者,TNM分期为Ⅲb~Ⅳ期;③美国东部肿瘤协作组体能状态评分介于0~2分;④临床资料完整;⑤有CT或MR可测量的病灶。(2)排除标准:①合并其他恶性肿瘤;②不能耐受免疫治疗;③合并严重肝肾疾病或自身免疫性疾病;④合并驱动基因突变者,包括表皮生长因子受体基因、间变性淋巴瘤激酶基因及C-ROS原癌基因1等。
1.3 治疗方法 晚期NSCLC患者均接受化疗联合程序性死亡因子1(programmed death-1,PD-1)单抗治疗。化疗:采用顺铂或卡铂联合白蛋白紫杉醇或培美曲塞二钠化疗。(1)培美曲塞二钠+铂类:每个治疗周期第1 d,给予顺铂或卡铂75 mg/m2,培美曲塞二钠500 mg/m2,21 d为1个治疗周期;(2)白蛋白紫杉醇+铂类:每个治疗周期第1 d,给予白蛋白紫杉醇175 mg/m2,顺铂或卡铂75 mg/m2, 21 d为1个周期。共化疗4个周期后评估疗效。PD-1单抗选用纳武单抗3 mg/kg,14 d为1个周期;派姆单抗2 mg/kg,21 d为1个周期,至少接受2个周期PD-1单抗治疗。
1.4 检测指标与方法
1.4.1 血清FGL1、LncSChLAP1检测:患者于入院后次日清晨、健康对照组体检日采取空腹肘静脉血5 ml,室温静置1 h后,离心留取上层血清,将血清分为2份,一份采用酶联免疫吸附实验检测血清FGL1水平,另一份采用实时荧光定量PCR检测血清LncSChLAP1水平。酶联免疫吸附实验步骤按照人FGL1 ELISA试剂盒说明书(购自上海江莱生物科技公司,货号JL47875-96T)进行,终止反应后酶标仪(购自美国伯乐公司,型号imark168130)检测450 nm处的吸光度值,根据标准曲线计算样品的FGL1浓度值;采用TRIzol 法提取血清总RNA,将血清总RNA逆转录为cDNA后,进行后续实时荧光定量PCR反应(ABI 7500实时荧光定量检测系统购自美国ABI公司),SYBR GREEN MIX试剂购自北京素来宝神五谷科技公司,货号SR1110。引物由上海生工生物公司设计合成。引物序列:LncSChLAP1上游:3’-CATATAACCCCGTCAACGCAG-5’,下游:3’- GCAGCCGCCACAAACATAC- 5’,GAPDH上游:3’-CCCGAGAGGTCTTTTTCCGAG- 5’, 下游:3’-CCAGCCCATGATGGTTCTGAT- 5’。反应体系:cDNA 1 μl,上下游引物各1 μl,SYBR GREEN MIX 10 μl,DEPC水7 μl。反应程序:预变性94℃5 min、94℃ 30 s,60 ℃退火 30 s,70℃延伸10 s,共40个循环。以2-△△CT法表示LncSChLAP1的相对表达量。以NSCLC组患者血清FGL1、LncSChLAP1的平均值48.68 μg/L、2.47为临界值,分为FGL1高表达亚组(≥48.68 μg/L,n=48)和低表达亚组(<48.68 μg/L,n=50),LncSChLAP1高表达亚组(≥2.47,n=47)和低表达亚组(<2.47,n=51)。
1.4.2 随访:晚期NSCLC患者治疗结束后采用电话和门诊结合的方式定期回访,每月随访1次,连续随访1年。随访内容包括有无肿瘤复发转移,死亡及死亡原因等。随访终止时间为2023年1月。随访终点为随访时间结束或患者发生肿瘤相关死亡。
1.5 疗效评价 治疗前及治疗结束后行胸CT检查,参考实体瘤疗效评价标准1.1评估疗效[8]:完全缓解(CR):所有靶病灶消失;部分缓解(PR):所有靶病灶直径的总和与基线相比至少减少30%;疾病进展(PD):与基线靶病灶直径和最小值相比,所有靶病灶直径的总和至少增加20%或出现新病灶;疾病稳定(SD):与靶病灶直径和最小值相比,既达不到部分缓解标准、也达不到疾病进展标准。将CR+PR+SD者分为有效亚组(n=74),PD者分为无效亚组(n=24)。
1.6 统计学方法 利用SPSS 24.0软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,2组间比较采用独立样本t检验;计数资料以频数/率(%)表示,组间比较采用卡方检验;多因素Logistic回归模型分析影响晚期NSCLC患者免疫治疗疗效的因素;受试者工作特征曲线(receiver operating characteristic curve, ROC)分析血清FGL1、LncSChLAP1水平对免疫治疗疗效的评估价值;Kaplan-Meier曲线(Log-Rank检验)比较不同FGL1、LncSChLAP1水平对晚期NSCLC患者预后的影响。P<0.05为差异具有统计学意义。
2 结 果
2.1 2组血清FGL1、LncSChLAP1比较 NSCLC组血清FGL1、LncSChLAP1水平分别为(48.68±6.65)μg/L、(2.47±0.36),高于健康对照组的(9.15±2.01)μg/L、(0.94±0.17),差异具有统计学意义(t=57.365、28.443,P均<0.001)。
2.2 2亚组患者临床资料比较 晚期NSCLC患者免疫治疗后,CR者0例,PR者34例,SD者40例,PD者24例。无效亚组TNM分期Ⅳ期比例、血清FGL1、LncSChLAP1水平高于有效亚组,差异具有统计学意义(P均<0.01)。2亚组患者的性别、年龄、吸烟史、病理类型、肿瘤分化程度、免疫治疗线数比较,差异均无统计学意义(P>0.05),见表1。

表1 无效亚组、有效亚组患者在临床/病理特征中的差异比较
2.3 多因素Logistic回归分析影响晚期NSCLC患者免疫治疗疗效的因素 以晚期NSCLC患者的免疫治疗疗效为因变量(1=无效,0=有效),以血清FGL1(原值录入)、LncSChLAP1(原值录入)水平为自变量,以TNM分期(1=Ⅳ期,0=Ⅲb期)为协变量,多因素Logistic回归分析结果显示,血清FGL1、LncSChLAP1升高是影响晚期NSCLC患者免疫治疗疗效的独立危险因素(P<0.01),见表2。
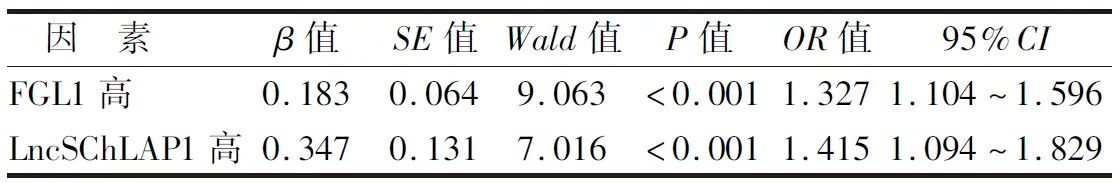
表2 影响晚期NSCLC患者免疫治疗疗效因素的多因素Logistic回归分析
2.4 血清FGL1、LncSChLAP1及两项联合预测晚期NSCLC患者免疫治疗疗效的价值 绘制血清FGL1、LncSChLAP1及两项联合预测晚期NSCLC患者免疫治疗疗效的ROC曲线,并计算曲线下面积(AUC),结果显示:血清FGL1、LncSChLAP1及两项联合的AUC分别为0.856、0.792、0.905,两者联合优于各自单独预测效能,差异具有统计学意义(Z/P=4.258/0.007、5.119/<0.001),见表3、图1。
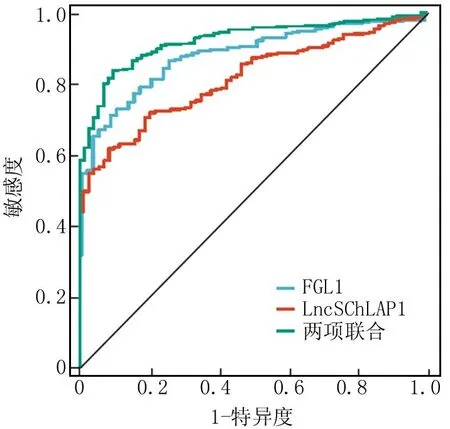
图1 血清FGL1、LncSChLAP1预测晚期NSCLC患者免疫治疗疗效的价值ROC曲线Fig.1 Serum FGL1, LncSChLAP1 value ROC curves for predicting immunotherapy efficacy in patients with advanced NSCLC

表3 血清FGL1、LncSChLAP1及两项联合对晚期NSCLC患者免疫治疗疗效的预测价值
2.5 血清FGL1、LncSChLAP1对晚期NSCLC患者生存预后的影响 98例晚期NSCLC患者随访中死亡57例,无失访,1年总体生存率为41.84%(41/98)。FGL1高、低表达组1年总体生存率分别为22.92%(11/48)、60.00%(30/50)。LncSChLAP1高、低表达组1年总体生存率分别为27.66%(13/47)、54.90%(28/51)。FGL1高表达组、LncSChLAP1高表达组晚期NSCLC患者1年累积生存率分别低于FGL1低表达组、LncSChLAP1低表达组,差异均有统计学意义(χ2/P=14.180/<0.001、17.553/<0.001),见图2。
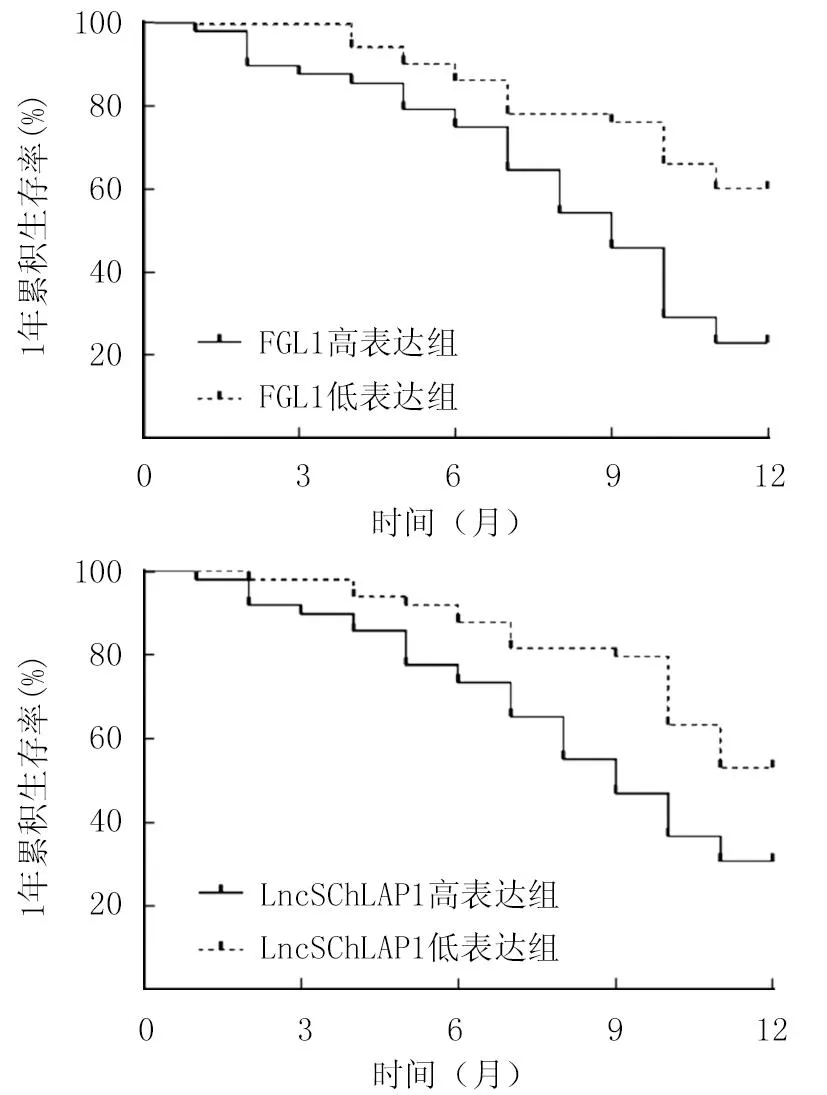
图2 血清FGL1、LncSChLAP1对晚期NSCLC患者生存预后的影响Fig.2 Effect of serum FGL1, LncSChLAP1 on survival prognosis of patients with advanced NSCLC
3 讨 论
晚期NSCLC的治疗方式包括放化疗、靶向治疗及免疫治疗等。酪氨酸激酶抑制剂等分子靶向治疗延长了驱动基因突变的晚期NSCLC患者的生存期,但对于多数驱动基因突变阴性或携带少见突变的晚期NSCLC患者靶向治疗获益有限[9]。近年来以免疫检查点抑制剂为代表的免疫治疗为驱动基因阴性的晚期NSCLC患者带来了机遇和挑战。肿瘤组织中PD-1或PD-L1的表达可作为免疫治疗疗效的评估指标,但受癌细胞异质性、动态进化性及组织取样等的限制,其并不能准确预测免疫治疗的疗效[10]。因此,寻找能够预测免疫治疗疗效的标志物,对于锁定免疫治疗获益最佳的人群,降低免疫相关不良反应的发生,具有重要临床意义。
FGL1编码基因位于人染色体8p22区域,属于纤维蛋白原家族成员,在肝脏损伤后分泌增多,参与促进肝细胞有丝分裂再生及新陈代谢等过程。近年来发现,FGL1在肾癌、胃癌等恶性肿瘤中表达升高[11-12],能促进肿瘤细胞增殖、转移及免疫逃逸,导致肿瘤的进展。本研究中,晚期NSCLC患者血清FGL1升高,提示FGL1与NSCLC的肿瘤发生有关。NSCLC中FGL1的表达升高与转录调控异常有关。研究表明,肺腺癌中转录因子YY1能够结合FGL1启动子区域,促进FGL1的表达,进而导致肿瘤细胞的过度增殖[13]。另外,FGL1还能诱导肺肿瘤细胞上皮间质转化及肿瘤血管生成,增强肿瘤细胞的侵袭和转移能力[14]。本研究表明,无效亚组血清FGL1水平较高,提示血清FGL1水平有助于评估免疫治疗的疗效。分析其原因,PD-1单抗治疗的机制是通过阻断PD-1/PD-L1通路,恢复CD8+T淋巴细胞的正常免疫功能,但CD8+T淋巴细胞表面尚存在如FGL1、TIGIT等其他共抑制分子的配体。研究表明,对于FGL1表达升高的晚期NSCLC患者,FGL1能够结合CD8+T淋巴细胞表面的LAG3配体,抑制CD8+T淋巴细胞的肿瘤杀伤效应,导致肿瘤免疫逃逸[4]。因此,血清FGL1水平升高的晚期NSCLC患者对以PD-1为靶点的免疫抑制剂治疗疗效较差,对于指导临床医生治疗方案具有重要意义。有学者研究发现,以PD-L1和FGL1为双靶向免疫治疗能够增加肿瘤微环境中CD4+和CD8+T淋巴细胞的浸润,增强机体抗肿瘤的免疫功能[15]。本研究中,血清FGL1高表达的晚期NSCLC患者生存预后较差,提示血清FGL1是新的评估晚期NSCLC患者预后的肿瘤标志物。分析原因,一方面是FGL1的表达上调增强肺肿瘤细胞的增殖及侵袭能力,肿瘤恶性程度高,疾病进展快,导致患者不良预后。另一方面,FGL1还能促进肿瘤细胞上皮间质转化形成,抑制肿瘤细胞凋亡,促进肿瘤细胞对吉非替尼等靶向药物治疗的耐药性形成,导致患者不良预后[16]。
LncSChLAP1是一种长链非编码RNA,参与染色质重塑和核小体修饰、mRNA的选择性剪接及转录激活等多种生物学过程[17]。研究表明,前列腺癌中LncSChLAP1通过与果蝇zeste基因增强子同源物2相互作用,促进组蛋白H2K27甲基化修饰,促进前列腺癌细胞的增殖、迁移[18]。本研究中,晚期NSCLC患者血清LncSChLAP1升高,提示LncSChLAP1可能参与NSCLC的肿瘤进展。研究表明,SChLAP1能与异质性胞核核糖核蛋白L结合,抑制肌动蛋白α4蛋白的蛋白酶体降解,激活核因子κB,促进肿瘤恶性增殖及转移[19]。本研究中,免疫治疗无效亚组血清SChLAP1水平较高,提示血清SChLAP1水平有助于评估晚期NSCLC患者免疫治疗的疗效。分析其机制,SChLAP1能够直接与AU碱基富集元件RNA结合因子1相互作用,拮抗其与PD-L1 mRNA 3’非编码区结合,增加PD-L1 mRNA的稳定性和表达,抑制CD8+T细胞的肿瘤杀伤功能,导致肿瘤免疫逃逸,另外,PD-L1的异常表达升高能够诱导肿瘤特异性CD8+T淋巴细胞的凋亡及耗竭,免疫效应分子如干扰素γ、肿瘤坏死因子α等分泌水平下降,降低PD-1单抗治疗的疗效[20-22]。另外,SChLAP1的表达升高还能够增加肿瘤基因组的不稳定性,增加肿瘤组织的异质性,进而降低化疗及免疫治疗的疗效[23]。本研究中,血清SChLAP1高表达的晚期NSCLC患者生存预后较差,表明SChLAP1是新的评估晚期NSCLC患者预后的血清标志物。笔者分析,SChLAP1高表达的NSCLC肿瘤增殖及转移能力强,对免疫治疗、化疗等治疗敏感性较差,这些因素均会导致患者不良生存预后。
本研究中,血清FGL1、LncSChLAP1联合判断晚期NSCLC患者免疫治疗疗效的敏感度和特异度为0.913、0.750,提示FGL1、LncSChLAP1是新的评估NSCLC患者免疫治疗疗效的血清标志物。临床医生可根据血清FGL1、LncSChLAP1水平,筛选出对免疫治疗敏感的晚期NSCLC患者进行治疗,减少免疫治疗的毒副作用,降低医疗成本,改善患者临床预后。另外,本研究中无效亚组TNM分期Ⅳ期比例较高。笔者分析,较高的TNM分期提示晚期NSCLC患者肿瘤负荷大、肿瘤异质性较高,潜在的驱动基因比例增加,进而导致肿瘤对化疗耐药性形成,导致化疗疗效降低。
综上所述, 晚期NSCLC患者血清FGL1、LncSChLAP1升高,是影响晚期NSCLC患者免疫治疗疗效的独立危险因素,两者联合对晚期NSCLC患者免疫治疗疗效具有较高的预测价值。血清FGL1、LncSChLAP1高表达晚期NSCLC患者生存预后较差,有助于晚期NSCLC患者生存预后的评估。本研究的不足在于未能对不同免疫治疗疗效的晚期NSCLC患者肿瘤微环境的差异进行基础研究,以FGL1、LncSChLAP1为靶点的临床治疗能否成为改善免疫治疗疗效的新的治疗方案,值得今后深入研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
夏宁:设计研究方案,实施研究过程,论文撰写;周泽军:进行统计学分析,分析试验数据,论文撰写;方申存:课题设计,论文修改;王尊乔:实施研究过程,分析试验数据,资料搜集整理;潘宴青:提出研究思路,论文审核
