柱前衍生化法分析木槿花多糖中单糖组成
2024-04-13王静孙盼盼曹际云
王静,孙盼盼,曹际云
德州学院生命科学学院(德州 253023)
木槿(Hibiscus syriacusL.),是一种锦葵科木槿属落叶植物,是一种很常见的庭园灌木花,通常生长于道路两旁、公园、庭院等处[1]。木槿花(FlosHibiscus),属于锦葵科木槿花,其花开时节,花朵会接力而开,又叫无穷花,也叫日及、朝开暮落花等。其大多颜色娇艳,花瓣有纯白、淡粉、淡紫、紫红等颜色,有单瓣、复瓣、重瓣等形态,以花朵大而完整、色纯无杂质为佳。木槿花含有蛋白质、脂肪、纤维及还原糖等,营养价值很高,既有食用价值,可做成木槿花饼、木槿花粥、木槿花茶、木槿花鲫鱼、木槿花豆腐汤等,具有一定的药用价值,木槿花入药具有杀菌消炎、抗氧化、清热利湿、凉血解毒的功效[2-4],也可用于治疗肠风泻血、肺热咳嗽烫伤等病症。
多糖在植物花朵中广泛存在,是一类至少由10个含有醛基或者羰基的单糖通过糖苷键连接而成的聚合糖高分子化合物,具有抑菌、抗氧化、抑制肿瘤,降血糖、降血脂、免疫调节等作用[5-7],对多糖的生物功能进行研究具有重要意义。
金友权等[8]初步测定木槿花的多糖组成,但对相关试验方法还未进行深入研究。在此基础上,选取江苏省的白色重瓣木槿花为试验对象,通过对木槿花的一系列处理,利用柱前衍生化-HPLC法[9-11]对木槿花多糖的单糖组成进行分析并对试验方法进行优化设计,为木槿花多糖后续发展提供基础。
1 仪器、试剂与材料
UltiMate3000高效液相色谱仪(赛默飞世尔科技中国有限公司);Thermo ScientificTMAcclaimTMC18色谱柱(4.6 mm×250 mm,5 μm,赛默飞世尔科技中国有限公司);恒温水浴锅(常州金坛良友仪器公司);TGL-16R型高速冷冻离心机(山东百欧医疗科技公司);HH-S型数显恒温油浴锅(江苏科析仪器公司);FA1004电子天平(上海舜宇恒平科学仪器有限公司)。
对照品:无水葡萄糖、半乳糖、阿拉伯糖、木糖、葡萄糖醛酸(无水葡萄糖纯度≥99%,其他4种单糖纯度≥98%,合肥博美生物科技公司)。1-苯基-3-甲基-5-吡唑啉酮(PMP,含量≥99%,天津科密欧化学试剂公司);甲醇、乙腈(均为色谱纯,含量≥99.9%,天津大茂化学试剂厂);乙酸铵(色谱纯,含量≥98%,天津市科密欧化学试剂公司);盐酸、三氯甲烷、氢氧化钠等(均为分析纯);试验用水为超纯水。
白色重瓣木槿花(市售)。
2 方法与结果
2.1 液相色谱条件优化
2.1.1 混合单糖对照品衍生化供试液处理
取葡萄糖醛酸、木糖、半乳糖、无水葡萄糖、阿拉伯糖各20 mg,溶于20 mL超纯水中,制成1 mg/mL的单糖标准溶液。
分别取200 μL各单糖标准溶液,混合,加入1.0 mL 0.5 mol/L的PMP甲醇溶液和0.5 mL 0.5 moL/L的NaOH溶液,并进行涡旋振荡5 min混匀,在70 ℃下水浴加热60 min,取出静置,冷却至室温,加入盐酸调溶液pH为中性或弱酸性,加入三氯甲烷进行萃取,共萃取3次,每次加入1 mL,振荡2~3 min,按5 000 r/min离心5 min,每次均取上清液,第3次上清液用0.22 μm微孔滤膜过滤,上样前进行超声去除溶液中的气泡。
2.1.2 柱温考察
设定柱温25,30和35 ℃,将2.1.1中处理好的混合单糖溶液进行上样测定。根据所得试验结果,可得到柱温对单糖的出峰时间影响很小,因此柱温设定为30 ℃。
2.1.3 流动相考察
分别采用0.02,0.06和0.10 mol/L的乙酸铵溶液作为流动相,将2.1.1处理的混合单糖溶液进行上样测定。由试验测定结果可知,乙酸铵浓度越高,峰形对称性越好,因此选用0.1 mol/L的乙酸铵溶液作为流动相。
2.1.4 流动相比例考察
设定流动相为乙酸铵-乙腈为84+16,82+18和80+20(V/V)这3种不同比例,用2.1.1中处理所得溶液进行上样。试验结果表明,乙酸铵溶液占比越低,样品分离越好,因此选用的流动相为乙酸铵-乙腈体积比80+20(V/V)。
2.2 多糖水解条件优化
2.2.1 木槿花多糖溶液制备
称取0.105 7 g木槿花粗多糖粉末,加入10 mL超纯水溶解,得到10.57 mg/mL的多糖溶液,可放置在4 ℃温度下保存,用于后续试验操作。
2.2.2 多糖水解用酸浓度考察
取3份2.2.1小节的多糖溶液,每份1 mL。分别向3份多糖溶液中加入1 mol/L盐酸溶液、3 mol/L盐酸溶液、5 mol/L盐酸溶液各1 mL,并进行涡旋振荡5 min,混匀,在110 ℃温度下水解60 min,取出静置冷却至室温,加入NaOH溶液调pH为中性,得到木槿花多糖水解液。取上述3份多糖水解液各200 μL,按照2.1.1小节的方法处理,测定结果见表1。根据测定结果可知,不同浓度盐酸水解后木槿花多糖含有的单糖的峰面积增减趋势并不一致。综合考虑,水解用盐酸浓度为1 mol/L。
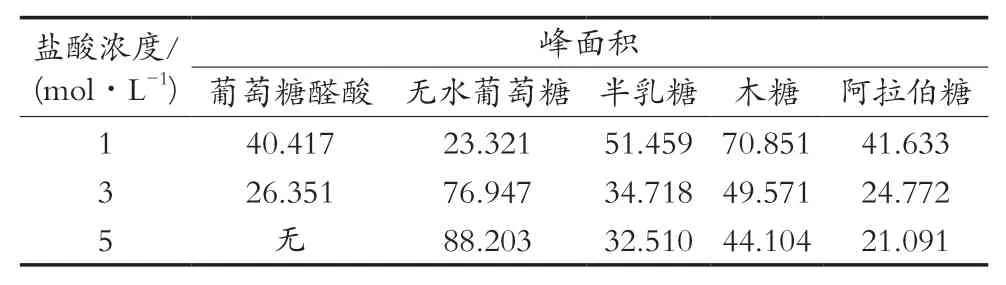
表1 单糖衍生物在不同浓度盐酸水解后的峰面积
2.2.3 多糖水解温度考察
取3份2.1.1小节的多糖溶液,每份1 mL。分别向3份多糖溶液中加入1 mL的1 mol/L盐酸溶液,并进行涡旋振荡5 min,混匀,分别在90,110和130 ℃下水解1 h,冷却至室温,加入NaOH中和,得到木槿花多糖水解液。取上述3份多糖水解液各200 μL,按照2.1.1小节的方法处理,测定结果见表2。综合试验测定结果,水解温度确定为110 ℃。

表2 单糖衍生物在不同温度水解后的峰面积
2.2.4 多糖水解时间考察
取3份2.1.1小节的多糖溶液,每份1 mL。分别加入1 mL 1 mol/L盐酸溶液,并进行涡旋振荡5 min,混匀,在110 ℃下分别水解30,60和90 min,冷却至室温,加入NaOH中和,得到木槿花多糖水解液。取3份多糖水解液各200 μL,按照2.1.1小节的方法处理,测定结果见表3。综合考虑,确定水解时间为60 min。
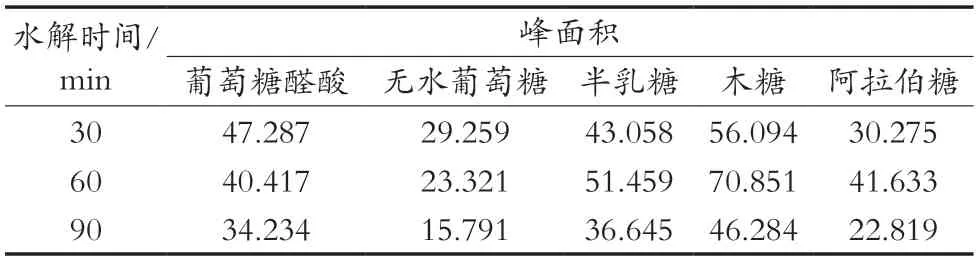
表3 单糖衍生物在不同时间下水解的峰面积
2.3 衍生化条件考察
2.3.1 衍生化温度考察
取3份木槿花多糖水解液,每份200 μL,均加入300 μL 0.5 mol/L PMP甲醇溶液和200 μL 0.5 mol/L NaOH溶液,并进行涡旋振荡5 min,混匀,分别在50,70和90 ℃水浴1 h,后续按照2.1.1小节的方法处理,测定结果见表4。综合试验测定结果,选用70 ℃的衍生化温度。
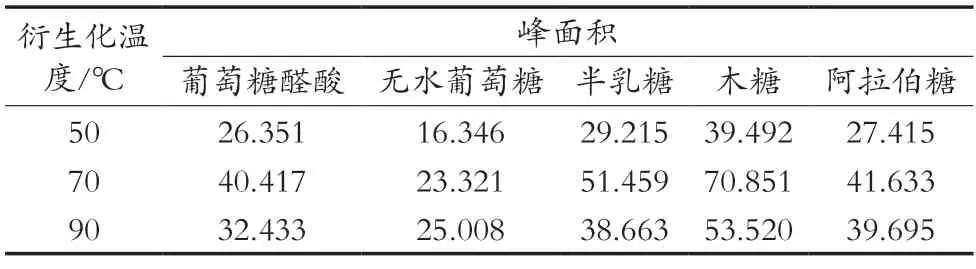
表4 不同衍生化温度处理各单糖衍生物峰面积
2.3.2 衍生化时间考察
取3份木槿花多糖水解液,每份200 μL,均加入300 μL 0.5 mol/L PMP甲醇溶液和200 μL 0.5 mol/L NaOH溶液,并进行涡旋振荡5 min,混匀,分别在70℃水浴30,60和90 min,后续按照2.1.1小节的方法处理,测定结果见表5。综合试验测定结果,衍生化时间选用90 min。
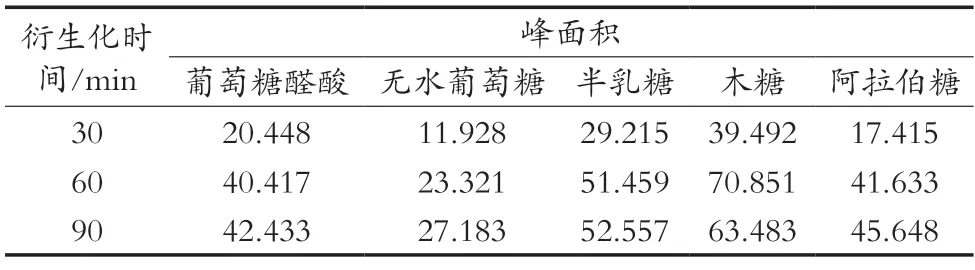
表5 不同衍生化时间下各单糖衍生物峰面积
2.4 木槿花中多糖水解产物单糖的含量测定
2.4.1 高效液相色谱条件
C18型色谱柱(4.6 mm×250 mm,5 μm);流动相为1 mol/L乙酸铵溶液-乙腈(80+20,V/V);柱温30 ℃;检测波长250 nm;流速1 mL/min;进样体积10 μL。
2.4.2 供试品溶液制备、水解及衍生
制备:取白色重瓣木槿干花将其研磨成粉末,过筛,通过索氏提取器用石油醚进行脱脂处理,脱脂后烘干备用。取脱脂粉溶于蒸馏水中(m脱脂粉∶m蒸馏水=1∶30),在80 ℃下水浴2 h,取出冷却至室温,在4 000 r/min转速下离心15 min,将离心后得到的上清液进行醇沉24 h(上清液-无水乙醇体积比1∶4),再进行离心,将沉淀溶于水,并进行旋蒸操作去除残留的无水乙醇;第1次离心后的沉淀再次进行水提、离心、醇沉、旋蒸等操作。将2次旋蒸后的溶液进行合并,用Sevage法(氯仿与正丁醇体积比4∶1)将多糖溶液中的蛋白质去除,得到木槿花粗多糖溶液。将粗多糖溶液进行冷冻干燥得到木槿花粗多糖粉末。取0.021 0 g粗多糖粉末溶于2 mL超纯水中,制成10.50 mg/mL的多糖溶液。
水解、衍生:取1 mL木槿花多糖溶液,加入1 mL 1 mol/L盐酸溶液,混匀,涡旋振荡5 min,于110 ℃水解60 min,冷却至室温,用NaOH溶液调pH为中性。取200 μL多糖水解液,加入300 μL的0.5 mol/L PMP甲醇溶液和200 μL的0.5 mol/L NaOH溶液,涡旋振荡5 min,混匀,在70 ℃温度下水浴加热90 min,冷却至室温,用盐酸调pH至中性或弱酸性。加入三氯甲烷萃取,共萃取3次,每次加入1 mL,并振荡2~3 min使萃取更充分,在5 000 r/min下离心5 min,每次均取上清液,第3次上清液用0.22 μm微孔滤膜过滤,上样前进行超声去除溶液中的气泡。
2.4.3 系统适用性试验
将PMP空白对照溶液、混合单糖溶液、木槿花多糖溶液分别进行上样,得到3个色谱图,见图1。从图1可观察到,木槿花多糖溶液与混合单糖溶液中葡萄糖、木糖、半乳糖、阿拉伯糖、葡萄糖醛酸及PMP空白对照溶液的保留时间大体一致,且多糖溶液中各单糖的分离程度比较好。

图1 3种溶液高效液相色谱图
2.4.4 线性关系
取5种单糖的不同浓度梯度溶液各1 mL,按照2.4.2小节中相关操作进行衍生化处理,后进行上样。质量浓度x(mg/mL)和峰面积y分别为横纵坐标,计算得到5种单糖的标准曲线方程,见表6。

表6 5种单糖的标准曲线
2.4.5 精密度
取多糖溶液,按照2.4.2小节中相关操作进行处理,后连续上样测定6次,记录峰面积,计算得到SRSD分别为0.829%,0.735%,1.331%,1.610%,0.553%和0.592%,均小于2%,表明仪器具有良好的精密性。
2.4.6 重复性
取木槿花多糖溶液份,按照2.4.2小节中相关操作进行处理,后进行上样测得峰面积,计算得到其SRSD分别为0.579%,0.962%,1.138%,1.446%,1.491%和1.557%,均小于2%,表明试验得到的分析方法重复性较好。
2.4.7 稳定性
取木槿花多糖溶液,按照2.4.2小节中相关操作进行处理,分别在处理后0,2,4,8,12,18和24 h进行上样测定,记录峰面积,计算得到其SRSD分别为0.847%,0.925%,0.977%,1.146%,1.471%,1.339%和1.611%,表明由试验得到的分析方法处理后的多糖溶液稳定性较好。
3 结论
试验利用柱前衍生化-HPLC法对木槿花多糖中单糖组成进行分析,对液相色谱条件、多糖水解条件和衍生化条件进行考察优化,主要通过对柱温、流动相浓度、流动相比例的考察确定液相色谱条件,即30 ℃柱温,流动相条件为乙腈-0.1 mol/L乙酸铵溶液(20+80,V/V)。对水解用盐酸浓度、水解时间、水解温度进行考察,确定水解条件,即1 mol/L盐酸溶液、110 ℃水解温度、60 min水解时间。对衍生化条件进行考察,确定衍生化条件,即70 ℃衍生温度、90 min衍生时间。试验以白色重瓣木槿花为原材料,经过粉碎、脱脂、醇沉、除蛋白等操作得到木槿花粗多糖,经过水解、衍生化处理进行上样测定,得到多糖的单糖组成,木槿花多糖中含有葡萄糖、半乳糖、阿拉伯糖、木糖和葡萄糖醛酸,各单糖的含量不同有一定差异。试验表明该方法精密度和准确度较高,结果稳定可靠,可以用来分析木槿花多糖中的单糖组成,可为木槿花后续研究提供一定基础,对木槿花多糖的质量控制提供一定价值和意义。
