基因递送中阳离子脂质体结构对转染效率及细胞毒性的影响研究进展
2024-04-13邢浩宇孙洁芳董慧胜高千龙潘琪霏马茜李迎
邢浩宇,孙洁芳,董慧胜,高千龙,潘琪霏,马茜,李迎
(1.云南中医药大学中药学院,云南昆明 650500;2.北京茵诺医药科技有限公司,北京 100915)
脂质是人体细胞不可缺少的重要组成部分[1]。自1960 年被Bangham 和Horne[2]发现以来,脂质体一直作为极具潜力的药物递送系统被广泛研究,其增强药效的同时兼具靶向能力,能够减少药物其体内蓄积,降低药物不良反应[3]。
基因药物载体主要分为病毒和非病毒载体。病毒载体虽然极大推动了基因治疗的发展,但因其免疫原性强、细胞毒性较大等因素制约了其应用。脂质体是非病毒载体中应用最为广泛的策略之一。相较于中性脂质体,阳离子脂质体对基因的负载能力及转染效率较高,且因易制备、可重复及生物降解性好被作为非病毒载体中的优选[4]。
载药阳离子脂质体进入体内后通常以3种不同的形式存在:完整的脂质体、释放出来的游离药物和脂质体结构中的聚合物材料[4]。有研究表明,阳离子脂质体的结构对其转染效率至关重要[5]。脂质体的组成材料也并非惰性、无毒,也可能影响基因药物的体内药动学过程,导致转染效率、靶向能力及不良反应的改变。
本文主要综述阳离子脂质体结构对于转染效率及细胞毒性的影响,为阳离子脂质体载基因药物的设计和研究提供一定的理论支持。
1 阳离子脂质体的结构
阳离子脂质体与脂质体类似,通常是直径在20~1000 nm 之间的球形脂质囊泡,具有一层或多层由磷脂构成的双层膜结构[3,6](图1A)。
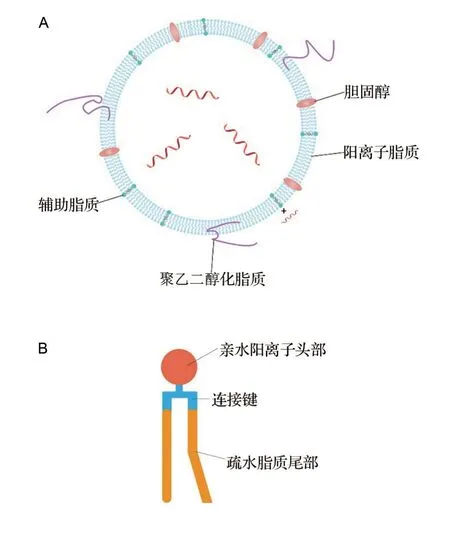
图1 阳离子脂质体结构(A)及阳离子脂质单元组成(B).
阳离子脂质体主体由阳离子脂质单元和辅助脂质组成。阳离子脂质单元从结构上分为亲水阳离子头部、疏水脂质尾部和连接键3 部分(图1B),均可对脂质体行为造成一定影响,也是影响体内过程的主要因素[6-7]。
1.1 亲水阳离子头部
阳离子脂质的亲水头部通常带有正电荷,在包载核酸类带有负电荷物质时起至关重要的作用。绝大多数用于基因递送的阳离子是通过氮原子引入的,常见类别有季铵盐、胺类(伯、仲、叔胺)、氨基酸或肽类、胍类、杂环类以及复合型头部[8]。阳离子脂质体性质与环境pH及其pKa均有一定关系,pKa越大,pH越低,则碱性相对越强,利于与核酸结合。
阳离子头部通过静电力吸引带负电荷物质,用作基因递送载体时可较大程度增加基因包封率。阳离子头部还能与内体膜阴离子相吸引,降低内体膜稳定性,促进膜融合,从而达到逃逸效果[9]。
1.2 疏水脂质尾部
阳离子脂质尾部通常是由不同结构的脂肪烃链组成的,也存在以固醇类结构为尾部的脂质。脂肪烃链根据其结构特征可分为不饱和链、多尾链、多分支链和聚合链等。其中,脂肪链的不饱和度、链长、支链数量以及不对称性均可对脂质体的体内过程产生影响。随着链长的减少,脂质体在体内的转染效率越高[10]。有研究表明,脂肪链的不饱和度越高、支链数量越多、不对称性越高时,脂质体表现出的转染效率越高[11],这可能是由于结构的变化改变了其相变温度,赋予了双层膜更好的流动性,有利于跨膜转运[12]。
1.3 连接键
脂质的亲脂端和亲水端之间往往通过不同的连接键连接,连接键决定了磷脂和脂质体的稳定性和毒性,同时影响基因递送的转染效率。一些学者利用连接键的这个特点设计了生物可降解的阳离子脂质体,以避免体内蓄积带来的毒性[13]。阳离子脂质体中采用的连接键主要包括醚键、酯键、酰胺键、氨基甲酸酯、二硫键、酰腙、尿素和磷酸,还包括肉毒碱、缩酮、天冬氨酸和谷氨酸及二羟基苯等一些特殊的连接键[14]。
常见的连接键中,醚键可提供较高的体内转染效率,但其生物降解性差,通常会带来较大的细胞毒性;相反,酯键化学性质不稳定,但在体内具有良好可降解性,毒性较低;酰胺键降低相转变温度,可使脂质体的双层膜结构更加稳定,与酯键相比,其可能与相领脂质的羰基形成氢键,而使脂质体表现出更佳的稳定性[14];此外,一些pH 敏感型脂质体和生物可降解脂质体都使用了一些易受环境影响的连接键,如氨基甲酸酯和腙[9,11,15]。
1.4 辅助脂质
尽管单一的阳离子脂质体能够完成基因递送,但通常还是会加入一些辅助物质,如胆固醇等,以增加膜稳定性,提高递送效率[16]。
基因递送的限速步骤在于携带DNA/RNA 跨膜转运,单用一种阳离子脂质时,跨膜时的瞬时稳定性差,若加入辅助脂质如1,2-二油酰基甘油-3 磷脂酰乙醇胺(1,2-dioleoyl-sn-glycero-3-phosphatidylethanolamine,DOPE)则能增强其稳定性。膜融合时,由于DOPE 头部小、尾部大,可形成较为稳定的锥形结构,最终形成倒六边形的空间结构,增加膜的融合性。因此,DOPE 这类辅助脂质也被称为融合脂质[17]。胆固醇的加入通常用来提高膜稳定性,胆固醇嵌入在脂质间的空隙中,大大增加脂质层密度,同时减少相邻脂质间的作用,进而增加药物的包封率。其中,胆固醇的加入量也对脂质体的稳定性及药物的释放有一定影响。研究表明,脂质∶胆固醇为70%∶30%时可使脂质体达到最稳定的状态[18-19]。
聚乙二醇(polyethylene glycol,PEG)作为一种具有长循环作用的修饰物,与脂质结合后通过其较大的体积对脂质体进行保护,防止脂质体被肾清除,被酶降解以及被免疫系统识别,达到免疫逃逸及体内长循环作用,同时改善脂质体的基因递送效率[20-21]。
2 阳离子脂质体结构对转染效率和毒性的影响
阳离子脂质体的各个组成部分对其体内的递送过程均有一定的影响,表1 整理了目前常见的阳离子脂质体及其组成部分的特征[22],其化学结构见图2。非病毒载体有较低的免疫原性,且易制备、成本低,但转染效率相对较低,细胞毒性高,靶向性较差[35]。阳离子脂质体作为非病毒载体中的代表之一,转染效率和细胞毒性也成为体内过程的主要考察指标。

表1 阳离子脂质的结构特征
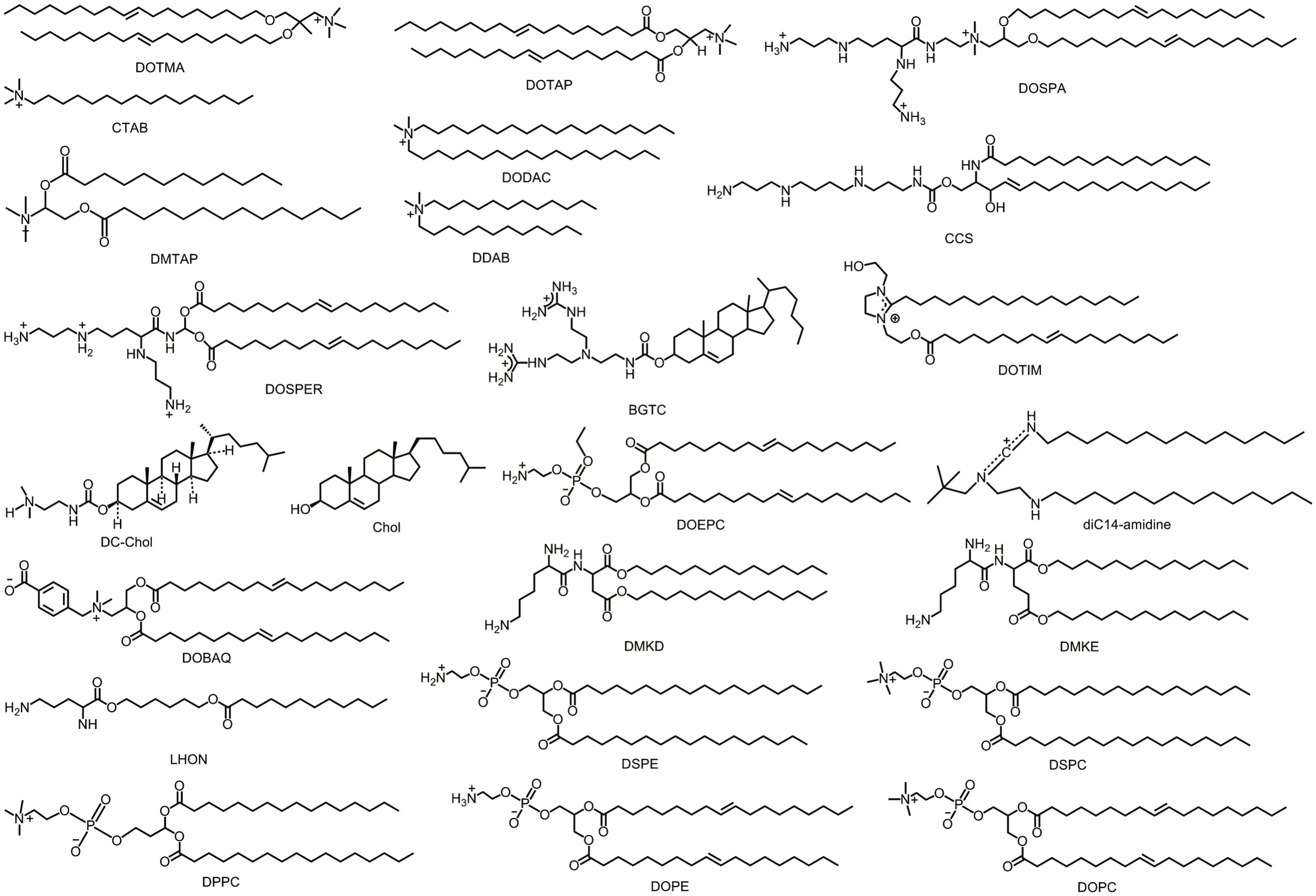
图2 不同阳离子脂质化学结构.
2.1 阳离子头部
在DNA 递送时阳离子脂质体的形成过程相对复杂,预形成脂质体时,根据阳离子脂质结构组成的不同,表现出不同的形成机制和构象,这主要与阳离子脂质中排列参数(P)有关:式中,v表示烃基尾部的分子体积;a表示亲水头部的横截面积;l表示亲脂链的长度。
P与DNA 和脂质的比例有密切关系,通常用来衡量阳离子脂质的空间结构平衡性。P<1/3 时,脂质呈球形胶束;1/3<P<1/2 时,阳离子头部较大,脂质尾部较小,脂质在空间上呈类似甜筒状,整体以六边形结构排列(HⅠC型);P<1 时,脂质通常排列成双分子层,因为头与尾部横截面仍有差距,因此通常是具有曲度和流动性的双层膜;当P=1 时,即两端完全平衡,此时脂质分子呈圆柱形,宏观为平行的双层膜结构(LαC型);相反,当P>1 时,脂质尾部占据较大的空间,此时形成的脂质通常呈反转胶束状态,同样以六边形形式排列(HⅡC型)(图3)。此外,脂质尾部越大,脂质体越不稳定,易形成一种倒置的六边形结构,该结构亲脂性较强,能促进脂质融合,因此脂质体和内体膜之间会更易结合,能一定程度上改善递送和转染效率[7,36-38]。
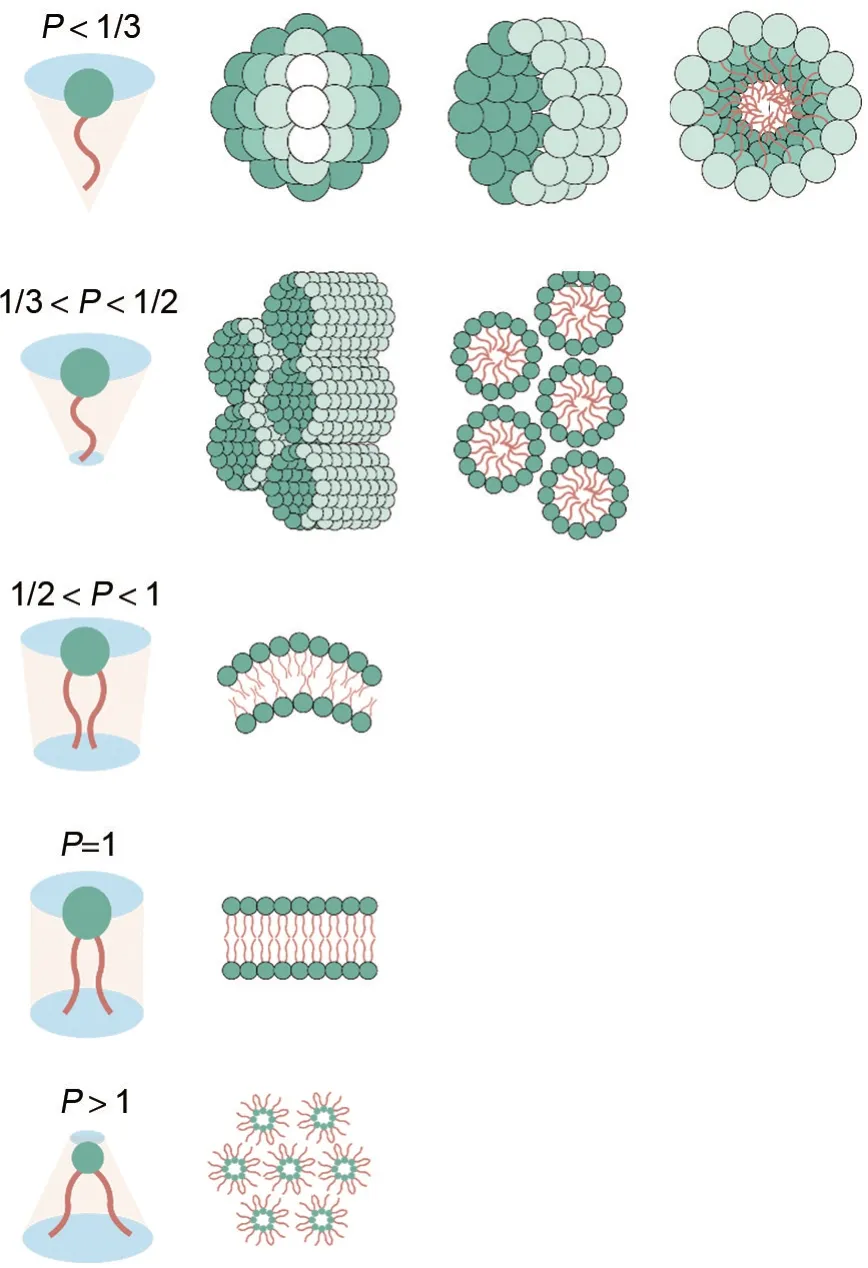
图3 不同排列参数(P)下的脂质结构.
因自身携带的正电荷,阳离子脂质体具有不容忽视的细胞毒性,其阳离子头部是影响细胞毒性的主要因素,表面电荷增加,细胞毒性也随之增强[40]。阳离子头部大多是由胺类结构引入的带正电荷结构,也有以碱性氨基酸和肽类作为头部的脂质。崔韶晖等[41]研究了一种季铵头部的阳离子脂质CDA14 和一种三肽头部的阳离子脂质CDO14 对细胞毒性的影响,结果表明季铵头部脂质的细胞毒性要高得多。因此,大多常用的阳离子脂质都可能具有较高的细胞毒性,这也是现在可电离脂质研究越来越多的原因。可电离脂质在体循环的生理pH 条件下不带电荷,所以处于内体的酸性条件时,质子化表现出阳离子性质,相较于阳离子脂质体细胞毒性降低[7,36]。
2.2 脂质尾部
亲脂的尾部区域决定了双层膜的相变温度和流动性,同时也影响脂质体的稳定性、内体逃逸以及核酸释放。其在体内的过程不同,毒性的强弱也不尽相同[42]。疏水的脂质尾通常是脂肪烃链,但据其链长、支链的有无以及链中含有的官能团不同,脂质尾部的性能也有所区别[43]。
多数脂质以甘油为骨架结构,连接3 个较长的脂肪酸链形成。天然磷脂多是不饱和脂肪酸链,而合成脂质则可是饱和的脂肪链[3];饱和链与不饱和链相比,转染效率明显较低。脂肪链多以双尾结构呈现,但也有类似于十六烷基三甲基铵的单尾脂肪链,尽管其在核酸递送中效果较好,但其毒性大,这也表明单尾脂质可能显示出更高的毒性[24]。支链较多的脂质占据较大的空间,相邻的2 条或多条链间有较大位阻,易形成较大横截面,形成锥形空间结构,可增加载脂质体的转染效率[36]。此外,甘油骨架结构在空间上相对比较对称,但尾部2 条链结构如极其不对称,也易形成锥形结构,向HⅡC的排列方式发展,故转染效率较高。
2.3 连接键
目前很多学者认为阳离子头部与疏水的脂质尾部之间的连接是一个区域,因此连接部分应基于连接键与骨架来讨论[44]。但除甘油骨架脂质外,其余脂质并无固定骨架,因此目前以研究连接键的作用居多。
2,3-二油氧基丙基三甲基氯化铵(2,3-dioleoyloxy-3-trimethylammoniumpropane,DOTAP)是常用的阳离子脂质,其连接键是酯键。Lou 等[34]研究发现,与连接键为碳碳键的二甲基双十八烷基胺相比,DOTAP 在基因递送时的清除率较高,但浓度时间曲线下面积较低,表明酯键连接的阳离子脂质在体内拥有较好的消除能力,毒性相对较小,但同时意味着其在体内停留时间较短,生物利用度和转染效率不如醚键连接的脂质体。含醚键的1,2-双十八烯氧基-3-甲基铵丙烷与含酯键的DOTAP 相比,体外释放过程略显缓慢,醚键提供了体内高转染率,随之而来的是生物降解性差,与酯键相反,易产生高毒作用[45]。除最常见醚键和酯键外,其他连接键对脂质体的体内过程也有较大影响,如酰胺键能提供稳定的递送环境,氨基酸类和多肽类阳离子脂质中也常以酰胺键作为连接域中的一部分。氨基甲酸酯作为生物可降解型脂质的典型代表,易受环境因素如pH 的影响,其在体内循环过程较为稳定,一旦分布到细胞内,受内体较低pH 的影响会加速代谢,因此由这类连接键形成的脂质通常毒性低,备受研究者的青睐。
2.4 辅助脂质
胆固醇无论作为阳离子脂质的尾部结构,还是作为辅助脂质,都是脂质体制备中十分重要的部分,胆固醇类及其衍生物能增强脂质体转染效率;另外,PEG 化修饰的脂质具有明显的体内长循环作用,能明显改善脂质体的药动学参数。除延长循环半衰期外,PEG 化脂质的血浆浓度峰值较低,波动较小,这为脂质体的体内分布过程提供了较为稳定的环境,即使在体内循环时间较长,也不会导致细胞毒性的提高。脂质体表面修饰的PEG 链能保护脂质体免受酶和免疫系统的识别,含有支链的PEG 在空间上占据较大面积,能对脂质体提供更好的保护[20]。
3 可电离阳离子脂质结构特点及已上市产品
由于阳离子脂质的正电荷在体内长时间存在会引入不容小觑的细胞毒性,可电离脂质的出现与应用显示了极大的优越性。可电离阳离子脂质是RNA 递送系统的重要组成部分,直接决定RNA 转染和疗效,其在不同pH 环境下可改变电荷密度,能解决传统阳离子脂质引入的毒性问题[46]。
3.1 常见可电离阳离子脂质结构
目前具有代表性的可电离脂质特征见表2,化学结构见图4。

表2 可电离阳离子脂质的结构特征
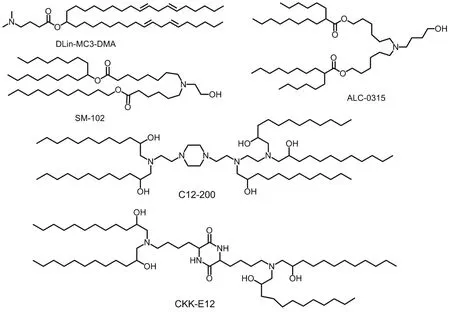
图4 典型可电离脂质结构.
3.1.1 含胺头基
可电离脂质与普通阳离子脂质骨架结构类似,但可电离脂质多以叔胺作为头基,在循环中不表现出正电荷特征,因此不会带来明显细胞毒性。在较低pH 环境下,阳离子头部的胺发生质子化,从而发挥阳离子脂质体作用[36]。此外,可电离脂质在与基因结合稳定时呈电荷平衡,在内环境中表现出较低的表面电势,从而起到降低细胞毒性作用[44]。目前针对新型冠状病毒感染研制的mRNA 疫苗采用的SM-102 和ALC-0315 等[47],基于合成理念设计的DLin-MC3-DMA 和DLin-KC2-DMA,以及高通量筛选得到的C12-200 和cKK-E12 均是具有代表性的可电离脂质[50]。此外,各类新一代可电离脂质也在不断涌现,具备可降解性质的可电离脂质也逐步成为目前设计的趋势。
诸多研究表明,基因递送效率与内涵体逃逸有直接联系。可电离脂质具备根据不同pH 调节电荷的能力,且用其制备的脂质纳米粒在酸性pH 下能形成非双层膜结构,对内体逃逸及RNA递送效率有举足轻重的影响[51-52]。有研究表明,可电离脂质在递送RNA 时促进内体逃逸,改变了其空间分布,同时对RNA在组织的蓄积和药效均有一定影响;但小干扰RNA 在组织累积过多也会影响细胞活力和内体转运平衡,进而带来一定毒性[53]。
3.1.2 其他部分
可电离脂质和普通阳离子脂质最主要的区别在于其头基的不同,连接键和尾部的种类和影响与阳离子脂质类似。但由于可电离脂质的特殊性质,另有诸多因素也影响可电离脂质递送,如氮磷比、pKa 值甚至立体构型[54-55],其中脂质pKa 值是可电离脂质的重要参数,对体内基因的沉默效率有决定性作用。叔胺基数量及衍生化基团的连接影响可电离脂质pKa 值及表面电荷,pKa 值影响基因沉默的效率[54]。有学者认为pKa 在6.2~6.5 范围内能发挥最佳优势[50,56]。由可电离脂质制备而成的脂质纳米粒的粒径及PEG 化脂质的含量也可在一定程度上改变脂质纳米粒对不同细胞的靶向性[57]。立体构型方面,目前认为纯立体异构的可电离脂质相较于外消旋体具有更高的RNA递送效率,这很可能是脂质依赖型的,即不同脂质有不同表现,如DOTAP 的R构型相较于S构型和外消旋体具有更高的转染效率,而Dlin-KC2-DMA 的不同对映异构体却有相同的转染能力[55]。
3.2 已上市的典型可电离阳离子脂质产品
目前已经有技术较为成熟的可电离阳离子脂质上市,主要涉及小干扰RNA和mRNA疫苗2个领域(表3)[47,58-60]。
尽管3 种产品选用的可电离脂质不同,但在结构上却有着相通之处,即体内代谢清除过程中均可发生降解,使毒性降低;不同的是与Dlin-MC3-DMA相比,ALC-0315 和SM-102 在尾部具有多个酯键,在体内生物过程中代谢速率更快;其次,三者都采用了磷脂DSPC 和胆固醇作为辅助脂质以提高结构稳定性,且使用PEG 化脂质改善载体的递送能力。
4 结语
基因治疗作为热门的研究领域之一,在全球疫情大形势下更加成为研究焦点。阳离子脂质体作为一种高效的非病毒载体更需要不断筛选与创新,其结构和组成也需进行更深入地研究和探索。阳离子脂质体种类繁多,尽管近年来对其结构的研究日益增多,但大多限于局部探索。因此,需要从整体、系统性角度出发,在宏观上把控阳离子脂质体的选择。
阳离子头部对基因转染效率的影响主要体现在其空间结构的表现形式,HⅡC型脂质转染效率较高。此外,连接键和脂质尾部的选择也会影响转染效率。由于阳离子的存在,细胞毒性是阳离子脂质不可避免的不足,但通过辅助脂质的加入以及连接键的选择能在一定程度上减少阳离子带来的细胞毒性风险。
可电离阳离子脂质的出现为稳定的基因递送提供了新选择,阳离子脂质的设计和开发必须考虑递送效率和细胞毒性之间的平衡,可电离脂质极大程度减少了脂质头基阳离子带来的细胞毒性,提高了其基因治疗优势。除阳离子脂质结构影响外,可电离阳离子脂质表面电荷和pKa 等对基因递送均有不同程度影响。由于可电离阳离子脂质的良好表现,现已逐步替代了普通阳离子脂质的递送策略。但影响可电离脂质递送的因素较多,应着重考虑诸多因素间的平衡。
目前阳离子脂质体结构相关的研究仅停留在局部单一因素的影响,但实际上诸多因素都能影响到后续产品质量,因此整体考虑产品设计和改善是迫切需求。此外,阳离子脂质体制备模式相对简单,如一昧追求设计和性能完美则会导致合成的困难,设计还需考虑其实际合成的难易程度。
