基于MR-T2WI 的深度学习与影像组学联合临床特征预测宫颈癌淋巴脉管间隙浸润
2024-04-12林宝金龙先凤吴朝霞梁莉莉卢子红甘武田朱超华
林宝金,龙先凤,吴朝霞,梁莉莉,卢子红,甘武田,朱超华*
0 引言
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,且在中低收入国家中更常见,死亡率居第三位[1],严重威胁女性的生命健康。我国女性宫颈癌人数逐年上涨[2],早发现、早诊断和早治疗能够有效降低宫颈癌的死亡率[3]。患者确诊宫颈癌时,淋巴脉管间隙浸润(lymph vascular invasion, LVSI)是影响其治疗选择和预后的重要因素[4-5]。根据美国国立癌症综合网络(National Comprehensive Cancer Network)发布的2023 年子宫颈癌临床实践指南[6],LVSI 被认为是宫颈癌的中危因素之一,同时LVSI 已经被研究证实是宫颈癌发生淋巴结转移的独立危险因素[7-8],可以在一定程度上更早地反映淋巴结发生转移的潜在风险。目前,术后组织病理分析是检验LVSI 的“金标准”,但是活检和手术切除是一种有创的方法,其标本的阴性预测值较低,病理分析的适用性有限;由于宫颈活检组织少,容易漏诊微小病灶,在检测LVSI的临床应用有限[9]。总之,确定其生物标记物是一项具有挑战性的任务[10]。
MRI 是早期宫颈癌检查最常用的手段[11-13],在临床中具有较高的应用价值。传统的MRI图像只能对肿瘤表观特征进行主观判断,无法进行定量评价容易忽略肿瘤内部异质性[14],在诊断和治疗中受到一定限制。影像组学是利用医学图像数据进行定量分析和挖掘的方法,以非侵入性方式获得肿瘤的内部异质性[15],已在宫颈癌诊断鉴别[16]、淋巴结转移预测[17]、疗效评估[18]和生存期预测[19]等方面表现出巨大优势[20]。近年来,深度学习在医学图像处理领域取得长足进步,它主要通过卷积神经网络使用滤波矩阵对图像进行特征提取,这就需要大量的标注数据集来理解数据之间的潜在关系[21]。深度迁移学习(deep transfer learning, DTL)是一个使用预先训练的深度学习网络[22],并对其进行微调以学习新任务的过程,以便将深度学习影像组学应用于小型数据集上,这一策略成为近年来的研究热点[23-25]。将深度学习算法与影像组学结合起来,对于实现个体化精准医疗具有重要的价值。现有的国内外研究中,通常利用获取的影像组学特征通过机器学习建模来预测LVSI,但国内尚未有研究讨论深度学习特征在诊断宫颈癌LVSI 中的潜在价值。本研究假设通过DTL方法提取病灶中的DTL 特征,以更全面地反映生物学信息。同时,将获取的DTL 特征与影像组学特征和临床特征结合构建联合预测模型,旨在进一步评估LVSI状态,提高临床诊断效能。
1 材料与方法
1.1 一般资料
本研究遵守《赫尔辛基宣言》,经广西壮族自治区人民医院伦理委员会批准(批准文号:KY-ZC-2023-053),免除受试者知情同意。回顾性分析2019 年1 月至2022 年12 月广西壮族自治区人民医院经术后病理确诊的宫颈癌患者病例。纳入标准:(1)宫颈癌根治术后病理学检查确诊为宫颈癌;(2)患者在MRI 检查前未接受新辅助治疗或其他治疗;(3)术前1个月内接受3.0 T MRI检查;(4)肿瘤为单个病灶。排除标准:(1)临床资料不全;(2)图像质量不佳或者缺失;(3)存在远处转移;(4)术前接受过治疗;(5)合并其他肿瘤。
1.2 仪器与方法
采用Siemens Magnetom Trio 3.0 T 磁共振仪,体部8 通道相控阵线圈,采集盆部MRI。常规扫描参数:快速自旋回波T1WI,FOV 400 mm×400 mm,TR/TE 550/13 ms,层厚/间距4 mm/1 mm,矩阵202×384,激励次数2;快速自旋回波T2WI,FOV 400 mm×400 mm,TR/TE 550/3 ms,层厚/间距4 mm/1 mm,矩阵202×384,激励次数2。
1.3 影像组学分析
1.3.1 分割图像
由一名放射科主治医师(具有5 年盆腔影像经验)使用3D Slicer 4.10.2 软件,在矢状位T2WI 图像上沿病灶边缘逐层手动勾画感兴趣(region of interest, ROI),获得肿瘤三维容积感兴趣区(volume of interest, VOI),见图1。对图像进行N4偏置校正[26]和标准化,将所有图像进行重采样[27]至体素1 mm×1 mm×1 mm,基于Python平台的开源软件包Pyradiomics(http://pypi.org/project/Pyradiomics/)提取影像组学特征。随机选取训练集中的30 例患者病例,由另一名放射科副主任医师(具有10 年盆腔影像经验),重新绘制ROI 并提取影像组学特征。以组内相关系数(intra-class correlation coefficient, ICC)评估两位观察者之间在提取影像组学特征方面的一致性,保留一致性较好的特征(ICC>0.80)。
1.3.2 DTL特征提取
在提取DTL 特征之前,选择矢状面中面积最大的ROI 进行裁剪。使用线性差将输入图像重新采样为64×64大小,并将像素强度的平均值和标准偏差归一化为0 和1。在基于Python 3.7 平台的深度学习库PyTorch 中[28],选择ResNet 50 深度卷积网络架构[29-30]作为迁移学习的基本模型,设置学习率执行迁移,提取DTL特征。
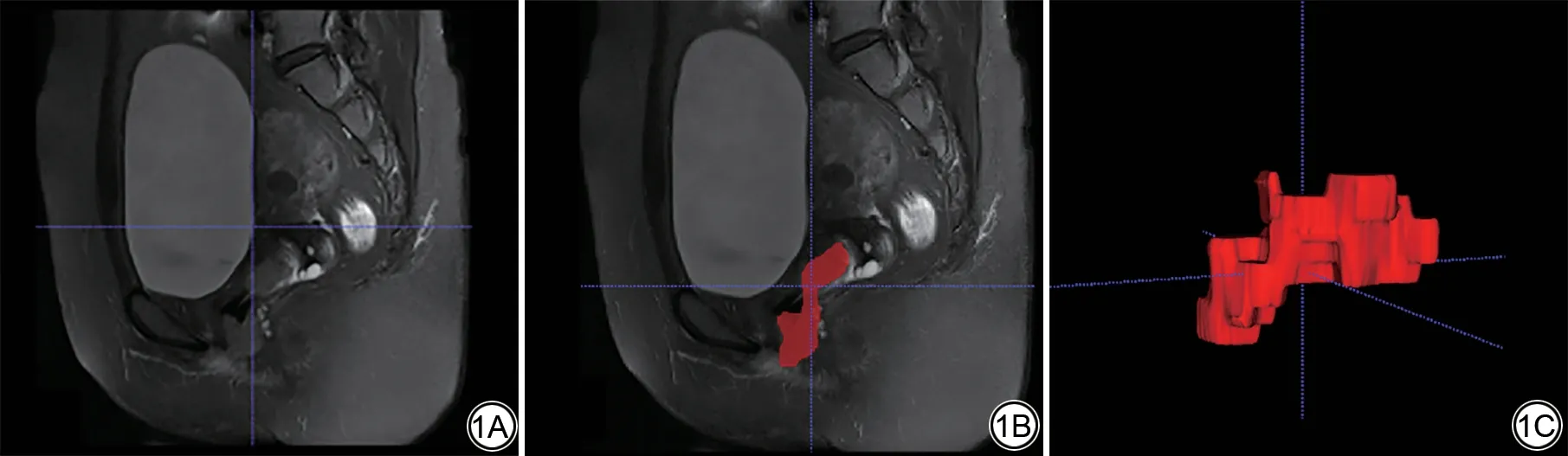
图1 基于T2WI 图像沿病灶边缘逐层勾画三维容积感兴趣区(volume of interest, VOI)示意图。1A:T2WI 图像;1B:肿瘤感兴趣区(红色);1C:肿瘤VOI。
Fig.1 Sequentially delineate the volume of interest (VOI) along the lesion margin based on T2WI images.1A: T2WI image; 1B: Tumor region of interest (highlighted in red); 1C:Tumor VOI.
1.3.3 特征筛选及特征融合
首先,对ROI 提取的影像特征进行独立样本t检验,将P>0.05的特征去除。其次,对于具有高重复性的特征,计算Pearson 相关系数以表达特征之间的关系,并且保留相关系数大于0.9 的任何一对特征中的一个。最后,使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法,通过构造惩罚函数λ来收缩一些回归系数以迫使一些特征变为0,从而将稳定的特征并入LASSO 分析。基于最小值标准,进行十倍交叉验证以确定最佳λ 值。根据最佳λ 值对应的模型,筛选非零系数的特征,从而得到独立且稳定的特征。使用Z-score 方法对所有筛选特征进行标准化,并计算每列特征的均值和方差。通过减去平均值并除以方差,将每列特征转换为标准正态分布。然后,根据LASSO 算法筛选出的特征及其对应的系数,绘制特征系数SHAP value图,以评估各特征重要性程度。
由于DTL 特征的维数较大,为保证特征间的平衡,在融合影像组学特征前,使用主成分分析对DTL特征进行降维,以提高模型泛化能力,降低过拟合风险。在融合选定的影像组学特征和DTL 特征后,使用Z-score 方法对所有特征融合进行标准化,并计算每列特征的平均值和方差。通过减去平均值并除以方差,将每列特征转换为标准正态分布。在特征融合阶段,对影像组学特征和DTL 特征进行早期融合,形成完整的特征集。使用LASSO 筛选出系数为非零的特征,选择特征融合并降维以找到具有最佳特征融合的子集。最后得到了一个21 维的特征融合子集。
1.3.4 模型构建与验证
经过特征融合和筛选,我们使用scikitslearn机器学习库构建了一个机器学习分类模型。机器学习分类模型包括支持逻辑回归(logistic regression, LR)、支持向量机(support vector machine, SVM)、K 近邻(K-nearest neighbor, KNN)、多变量逻辑回归(multivariate logistic regression, MLP)、随 机 森 林(random forest, RF)、极端随机树(extremely randomized trees, ExtraTrees)、极端梯度提升(eXtreme Gradient Boosting, XGBoost)和轻量级梯度提升机(light gradient boosting machine, LightGBM)。所有模型均在训练队列中使用网格搜索算法进行训练。每个模型中常用的参数都被认为是经过调整的。比较了不同分类模型的性能,为了防止过拟合,进行了5 次交叉验证,以在训练序列中为分类模型选择最佳参数。最后计算影像组学评分(Radscore),筛选最佳影像组学模型。
1.4 统计学分析
所有统计测试均使用SPSS 25.0软件、Python 3.7和4.0.2 版R 软件进行。数据经Kolmogorov-Smirnov 检验,符合正态分布的计量资料以(xˉ±s)表示,不符合正态分布的计量资料以中位数±四分位数间距表示。以ICC 检验评价两名医师之间提取影像组学特征的一致性,ICC>0.75 为一致性良好。使用DeLong 检验比较各种预测模型的AUC,使用决策曲线分析(decision curve analysis, DCA)评估模型的临床价值。以多因素logistic 回归构建基于DTL 特征、影像组学特征和临床特征的联合预测模型,并以列线图将其可视化。列线图和DCA 主要通过使用R 软件“rmc”和“rmda”包来计算。P<0.05为差异有统计学意义。
2 结果
2.1 训练集和测试集患者临床基线特征比较
研究共纳入178 例宫颈癌患者,年龄27~82(51.91±10.39)岁,其中70 例LVSI(+)、108 例LVSI(-);按照8∶2 比例划分为训练集[142 例,54 例LVSI(+)、88 例LVSI(-)]和测试集[36 例,16 例LVSI(+)、20 例LVSI(-)]。记录患者的临床资料,包括年龄、血红蛋白、淋巴结转移、中性粒细胞数等18个项目。临床特征样本数据分布统计结果见表1。选用单因素逻辑回归分析,最终选择粒细胞比率和淋巴结转移(P<0.05)两项作为独立预测因子,用以构建联合预测模型。

表1 训练集和测试集宫颈癌患者临床基线资料Tab.1 Clinical baseline data of cervical cancer patients in the training and test sets
2.2 构建影像组学模型
基于T2WI 影像分别提取影像组学特征和DTL特征,经ICC 检验结果,分别保留了1 197 个影像组学特征和2 048个DTL 特征,构建影像组学特征数据集、DTL 特征数据集和影像组学特征与DTL 的融合特征数据集,各数据集依次经过t检验、Pearson 相关性和LASSO 后最终筛选出3、7 和21 个最佳组学特征(图2),分别构建影像组学(radiomics, Rad)模型、DTL 模型和二者特征融合模型(Rad+DTL 模型)。Rad+DTL 模型预测训练集和测试集宫颈癌LVSI(+)的AUC(0.966、0.759)高于Rad 模型(0.802、0.741)和DTL 模型(0.886、0.519);以Rad+DTL 模型为最佳影像组学预测模型,详见表2。

图2 基于影像组学特征、深度迁移学习(DTL)特征及二者融合特征筛选的最佳影像组学特征及相应SHAP值。Fig.2 The optimal radiomics features based on radiomic features, deep transfer learning features (DTL), and the combined features of both, along with their corresponding SHAP values.
2.3 构建联合预测模型
Rad+DTL 模型的Radscore 最高,将Rad+DTL 模型与淋巴结转移、粒细胞比率两项临床特征构建联合模型,图3为其列线图。联合模型在训练集预测LVSI(+)的AUC 高于Rad+DTL 模型(0.984 vs.0.966,Z=7.84,P<0.01),在测试集中与Rad+DTL 模型的AUC差异无统计学意义(0.912 vs.0.759,Z=1.89,P=0.05),见图4 和表2。校准曲线显示,联合模型相比于Rad模型、DTL 模型、Rad+DTL 模型具有较高的校准度(图5)。DCA 显示,阈值取0~0.98 时,联合模型临床效益更好,见图6。

图3 联合模型列线图。不同指标对应分数的总和越高,淋巴脉管间隙浸润(LVSI)阳性的概率越大。Rad 为影像组学;DL 为深度学习;Metastasis为淋巴结转移(0=阴性,1=阳性)。Fig.3 A nomogram of the union model.The higher the total score based on different indicators, the greater the probability of lymphovascular space invasion being positive.Rad: radiomics; DL: deep learning; metastasis:lymph node metastasis (0=negative, 1=positive).

图4 Rad 模型、DTL 模型、Rad+DTL 模型及联合模型预测宫颈癌LVSI(+)的ROC 曲线。4A:训练集;4B:测试集。AUC:曲线下面积;Rad:影像组学;DTL:深度迁移学习;Rad+DTL:影像组学特征与深度迁移学习特征的融合;Nomogram:列线图(联合模型);LVSI:淋巴脉管间隙浸润;ROC:受试者工作特征。Fig.4 ROC curves of the Rad model, DTL model, Rad+DTL model, and union model for predicting LVSI (+) in cervical cancer.4A: Training set; 4B:Test set.AUC: area under the curve; Rad: radiomics; DTL: deep transfer learning; Rad+DTL: fusion of radiomic features and deep transfer learning features; Nomogram: nomogram model (combined model); LVSI: lymph vascular space invasion; ROC: receiver operating characteristic.

图5 Rad 模型、DTL 模型、Rad+ DTL 模型及联合模型的校准曲线。5A:训练集;5B:测试集。Rad:影像组学;DTL:深度迁移学习:Rad+DTL:影像组学特征与深度迁移学习特征的融合;Nomogram:列线图(联合模型)。Fig.5 Calibration curves of the Rad model, DTL model, Rad+DTL model,and the union model.5A: Training set; 5B: Test set.Rad: radiomics; DTL:deep transfer learning; Rad+DTL: fusion of radiomic features and deep transfer learning features; Nomogram: nomogram model (combined model).

图6 Rad模型、DTL模型、Rad+DTL模型及联合模型的DCA图。y轴表示净收益,x 轴表示阈值概率。Rad:影像组学模型;DTL:深度迁移学习模型:Rad+DTL:影像组学特征与深度迁移学习特征的融合模型;Nomogram:列线图(联合模型);DCA:决策曲线分析。Fig.6 DCA plots of the Rad model, DTL model, Rad+DTL model, and the union model.The y-axis represents the net benefit, while the x-axis represents the threshold probability.Rad: radiomics; DTL: deep transfer learning; Rad+DTL: fusion of radiomic features and deep transfer learning features;Nomogram: nomogram model (combined model); DCA: decision curve analysis.
3 讨论
本研究开发并验证了利用机器学习算法基于DTL 特征、影像组学特征和临床特征构建联合(列线图)模型,探究其在术前预测宫颈癌LVSI 的潜在价值。结果显示,联合模型在训练集中的AUC 为0.984(95%CI:0.966~1.000),在测试集中的AUC 值为0.912(95%CI:0.824~1.000),该模型具有较高的诊断效能,可辅助临床制订个体化治疗方案。更为重要的是,本研究揭示了DTL 特征能够为影像组学预测宫颈癌LVSI 状态提供额外的潜在价值,有望成为宫颈癌诊疗决策中的生物标记物。
3.1 宫颈癌LVSI的影像组学研究
近年来人工智能技术的快速发展,影像组学成为临床研究的热点,通过大数据算法和统计分析工具,高通量提取并分析成像特征,将传统影像转化为可挖掘分析的数据信息,获得另一种洞悉肿瘤特征的生物学信息[31],为临床决策提供支持。传统的影像学方法容易忽略肿瘤自身异质性,无法准确预测宫颈癌LVSI状态。已有部分学者利用影像组学技术针对宫颈癌LVSI 状态做了相关研究,最早的研究是LI等[32]基于T1 对比增强(contrast-enhanced, CE)MRI的影像特征构建预测宫颈癌LVSI 状态的影像组学模型,虽然该研究预测准确性只有60%,临床应用有限,但是结果表明MRI 图像的影像组学特征可以用于预测宫颈癌LVSI。WU 等[33]利用多个MRI 序列的影像特征预测宫颈癌LVSI状态的价值,模型的AUC值在0.659 至0.814 之间,其中单个T2WI 序列构建的影像组学模型效果与本研究中的Rad模型结果相似,一方面是T2WI序列图像对于肿瘤组织较为敏感,能够识别微小的组织结构改变;另一方面,T2WI 图像提取的影像组学特征能够较好地描述肿瘤异质性和边缘特性等生物学信息。喻泓清等[34]基于T2WI+CE-T1WI 影像组学及淋巴结转移状态、宫颈浸润深度构建的临床影像组学模型在训练集及验证集的AUC 值分别为0.88 和0.83,其中淋巴结转移状态指标与本研究纳入的临床指标一致,表明淋巴结转移与LVSI具有较强相关性[5-6]。将深度学习算法和影像组学结合用于宫颈癌LVSI 研究中,目前国内外鲜有相关研究报道,HUA等[35]通过VGG-19的卷积神经网络架构提取深度学习特征并将其与影像组学特征结合起来,构建的联合模型在训练集和测试集中预测LVSI 的AUC 值分别为0.842 和0.775,本研究则通过ResNet50的卷积神经网络架构提取DTL特征与影像组学特征结合,构建的Rad+DTL 模型在训练集和测试集中的AUC 为0.966 和0.759,两者在训练集AUC存在一定差异。一方面可能由于两者训练样本数量的差异,HUA 等训练集使用了111 例宫颈癌患者数据,本研究训练集使用了142 例宫颈癌患者数据,但并不排除结果存在一定的过拟合;另一方面,两者使用不同的卷积神经网络架构,各自发挥出的优势不同。两项研究在测试集中的结果类似,表明深度学习特征在判断宫颈癌LVSI 状态方面具有一定的价值。
3.2 宫颈癌LVSI预测模型的应用价值与效能分析
MRI各序列图像中,宫颈肿瘤在T2WI图像上呈明显高信号,能够清楚地展示子宫颈的解剖位置,可将宫颈肿瘤与周围正常组织有效区分开来,有利于确定宫颈病灶的位置、形态和浸润范围[36]。本研究基于T2WI序列图像进行影像组学分析,经筛选最终获得21 个特征,其中16 个影像组学特征(1 个形态学特征,15 个纹理特征),5 个DTL 特征。形态学特征和纹理特征中的灰度共生矩阵、灰度大小区域矩阵和灰度游程矩阵在SHAP 图中均显示有利于预测宫颈癌LVSI 状态,表明肿瘤异质性体现在图像的灰度变化上;形态学特征反映的是肿瘤轮廓基本信息;灰度共生矩阵反映的是图像灰度在步长、方向等变化的综合信息;灰度大小区域矩阵描述图像中区域或区块的灰度级别和大小;灰度游程矩阵用于描述图像的灰度连续性或平滑性。虽然本研究获取的DTL 特征暂时无法解释说明,但是根据SHAP值中的特征重要性表现,可知DTL 特征对于预测模型构建具有一定的贡献。
与既往的宫颈癌LVSI 影像组学研究不同,本研究构建的预测模型创新性地纳入DTL 特征,通过ResNet50深度卷积网络架构提取的DTL特征在构建预测模型方面显示出了一定的潜力,对预测模型的效能提升起到了促进作用,与JIANG 等[37]发现基于深度学习的影像组学可区分血管是否浸润的结果类似。深度学习作为当下热门的发展学科,其算法能够自动学习具有强大表征能力的特征,无需人为干预,将深度学习与影像组学结合起来,有利于个性化医疗的实现[38]。尽管当前深度学习特征的可解释性有待进一步研究,但这并不排除在卷积运算中对病变本身的特征进行映射,从而可以进一步用于预测模型的构建;另外,使用DTL 方法能够有效解决当前数据样本不足的困境。本研究以Rad+DTL模型联合粒细胞比率、淋巴结转移两项临床因素构建的联合模型融合了肿瘤的异质性、形态学及临床特征,能够为宫颈癌LVSI 状态诊断提供更加稳定可靠的依据。联合模型在训练集和测试集中AUC 值分别为0.984 和0.912,在训练集和测试集均高于Rad+DTL模型,提示其模型临床应用价值高。本研究构建联合模型的诊断效能优于既往研究的效果,可能由于本研究基于三维纹理分析,同时加入了DTL 特征,获得肿瘤更多的空间信息,提高了整个模型鉴别组织特征的能力。通过列线图将其可视化,方便临床使用。总之,将深度学习算法与影像组学结合起来,能够帮助我们更好地理解医学图像中的复杂模式,从而提高影像组学的分析和预测能力。
3.3 本研究的局限性
本研究的主要局限性:首先,本研究为单中心回顾性观察,可能存在数据选择偏倚,缺乏多中心参与验证,计划在后续的研究中加入多中心样本进一步验证模型可靠性;其次,虽然本研究纳入的深度学习特征显示出了一定的预测潜力,但是样本量相对较少,而且提取的深度学习特征可解释性有限,后续研究还需纳入更多的样本量,进一步提高模型的拟合度,优化模型效能;最后,本研究勾画的ROI 仅基于矢状位T2WI,后续研究将纳入更多其他序列加以完善。
4 结论
综上,基于影像组学特征和深度学习特征联合临床特征构建的联合模型具有良好的诊断效能,可以作为术前评估宫颈癌LVSI状态的个体化决策支持工具,更好地为临床决策提供帮助。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:朱超华设计本研究方案,对稿件重要内容进行了修改,获得了广西医疗卫生适宜技术开发与推广应用项目资助;林宝金起草和撰写稿件,获取、分析及解释本研究的数据,获得了广西壮族自治区卫生健康委科研课题资助;龙先凤、吴朝霞、梁莉莉、卢子红、甘武田获取、分析或解释本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
