基于LI-RADS v2018及MRI特征对肝细胞癌CK19表达的风险预测及预后评估
2024-04-12鲁梦恬瞿琦徐磊张继云刘茂童姜吉锋张涛张学琴
鲁梦恬,瞿琦,徐磊,张继云,刘茂童,姜吉锋,张涛,张学琴*
0 引言
肝癌发病率位居全球恶性肿瘤第六位,死亡率高居第二位[1]。尽管肝细胞癌(hepatocellular carcinoma,HCC)的治疗方案已经取得了很大的进步,但其预后仍然较差[2]。细胞角蛋白19(cytokeratin 19, CK19)阳性表达的HCC 具有多种与增殖、侵袭性相关的基因特征(转化生长因子-β 途径和上皮-间充质转化的相关因子上调等),常表现出浸润样外观、低分化、微血管浸润等病理特征,临床上常与较高的血清甲胎蛋白(alpha-fetoprotein, AFP)水平、慢性乙型肝炎、淋巴结转移相关[3-5]。CK19 阳性HCC 肝切除术及射频消融术后的预后较差,对经动脉化疗栓塞术、全身化疗也具有治疗耐药性[5-7]。由于其不同分子特征和侵袭性表现,治疗方案也需进行调整:CK19 阳性HCC 患者行根治性切除术需扩大切除范围,且患者术后联合索拉非尼疗效更佳[5];TGFbR1 抑制剂、PDGFRα 抑制剂等被视为其特异性靶向药物[8-9],目前CK19 的表达状态仅能通过活检或术后病理标本确定,对于不可切除性HCC,通过术前影像学检查预测其表达可弥补病理穿刺标本的局限性,为临床治疗决策提供重要参考。
钆塞酸二钠是一种常用的肝细胞特异性对比剂,与传统的MRI对比剂相比,其增强MRI肝胆期图像呈现出独特的信号表现,能更准确地检测HCC 病灶和评估病灶特征[10]。而2018 版肝脏影像报告和数据系统(Liver Imaging Reporting and Data System,LI-RADS)是规范HCC 影像诊断的综合评估系统,对影像征象提供标准定义,可根据征象判断肿瘤的良恶性及HCC的可能性[11]。
CHOI 等[12]最早发现不光滑肿瘤边缘、动脉期环状强化、肿瘤-肝脏表观扩散系数比值较低、肿瘤-肝脏肝胆期信号比值较低可以预测HCC 的CK19 表达。HU 等[13]、高知玲等[14]研究认为靶环样表现(动脉期环状强化、DWI 靶征)和AFP 水平升高与CK19 阳性表达HCC 密切相关;陈玉莹等[15]的研究则表明DWI 靶征是HCC CK19 表达的独立预测因素。目前已有的研究结论不尽相同,均缺乏验证步骤;纳入的影像征象均较少且征象大多缺乏统一标准定义;此外,鲜有研究同时评估患者预后情况。本研究采用LI-RADS v2018 的MRI 特征及其他有潜在价值的MRI 征象,对HCC 的CK19 表达进行术前风险预测并探讨其预后意义,旨在协助临床治疗决策的优化以及改善患者预后。
1 材料与方法
1.1 研究对象
回顾性分析2015 年5 月至2021 年6 月在本院行根治性肝切除术的HCC患者资料。纳入标准:(1)手术病理确认为HCC;(2)具有完整的临床、病理资料;(3)术前2周内行钆塞酸二钠增强MRI检查;(4)病灶直径≤10 cm。排除标准:(1)术前接受过介入治疗、靶向或免疫治疗等其他抗肿瘤治疗;(2)有肝外原发恶性肿瘤病史;(3)有大血管癌栓或远处转移;(4)图像不完整或质量不佳;(5)复发状态不明确;(6)随访时间<1年且无复发。患者临床病理资料包括:性别、年龄、乙肝病史、AFP 水平、总胆红素、国际标准化比值(international normalized ratio, INR)、Edmondson-Steiner分级及微血管侵犯( microvascular invasion, MVI)。所有患者肝切除术后每3~6 个月复查一次,包括超声、CT 或MRI 增强检查以及AFP 水平检查,随访时间范围为1~78 个月。无复发生存期(recurrence-free survival, RFS)指从手术日期到首次复发或末次随访(若未观察到复发)的间隔时间。早期复发定义为患者术后1 年内复发,晚期复发定义为患者术后1 年后复发[16]。220 例患者中共103 例复发,其中51 例为早期复发,52例为晚期复发。
本研究遵守《赫尔辛基宣言》,经过南通市第三人民医院医学伦理委员会审查批准,并免除受试者知情同意,批准文号:EK2021017。
1.2 病理学标准
所有患者的HCC切片由2名均具有15年病理诊断经验的病理科副主任医师评估,使用单克隆抗体对标本行CK19 免疫组化染色,在400 倍光镜下观察5 个独立视野,CK19 阳性定义为瘤内≥5%的区域有中等-明显程度的细胞染色[17]。
1.3 检查方法
使用3.0 T MRI 扫描仪(Achieva 3.0 T,飞利浦医疗公司)、16 通道腹部相控阵线圈进行扫描。平扫序列包括:轴位T1WI 同相位和反相位序列、轴位和冠状位T2WI 脂肪抑制序列、b 值为0、800 s/mm2的轴位扩散加权成像序列(diffusion-weighted imaging,DWI)。以0.025 mmol/kg 的剂量、1.0 mL/s 的速率静脉注射对比剂钆塞酸二钠。采用T1高分辨力各向同性容积激发序列在注射对比剂前及注射后第20~25 s、60 s、3 min、20 min 采集轴位平扫、动脉期(arterial phase, AP)、门静脉期(portal phase, PP)、移行期(transitional phase, TP)、轴位及冠状位肝胆期(hepatobiliary phase, HBP)图像。各序列扫描参数如下:(1)T1WI序列,TR 100 ms,TE 2.3 ms,层厚5 mm,翻转角10°,矩阵240×140,FOV 380 mm×330 mm;(2)T2WI 抑脂序列,TR 2 000 ms,TE 70 ms,层厚7 mm,翻转角90°,矩阵240×140,FOV 360 mm×300 mm;(3)DWI 序列,TR 3 200 ms,TE 55 ms,层厚7 mm,翻转角90°,矩阵240×140,FOV 375 mm×305 mm,以b 值=800 s/mm2的图像重建表观扩散系数图。
1.4 图像分析
由具有10 年与15 年工作经验的两名放射科副主任医师在对病理结果不知情的情况下阅片并达成一致意见,若有分歧则咨询第三位具有20 年腹部影像诊断经验的主任医师意见。当患者病灶数目≥2时,选择最大者进行评估及测量。
根据LI-RADS v2018[18]对病灶进行评价。(1)HCC 主要征象包括:动脉期明显强化、非周边廓清、包膜强化、大小;(2)恶性肿瘤的辅助征象包括:结中结、马赛克征、瘤内脂肪、瘤内出血、轻中度T2 高信号、晕状强化;(3)LR-M(可能或确定的非HCC 恶性肿瘤)类征象包括:环形动脉期高强化、靶样扩散受限、中央延迟强化、移行期靶征、肝胆期靶征。
其他MRI 定性特征:瘤内坏死或囊变(肿瘤内长T2信号且无强化的区域)[19],肝胆期瘤周低信号(肿瘤周边的不规则低信号区域)[20],不光滑肿瘤边缘(肿瘤边缘结节状突起伸入肝实质或边界不清晰)[21]。定量特征:肿瘤-肝实质相对增强比(the relative enhancement ratio, RER)[22]。在平扫和增强动脉期、肝胆期图像上选取肿瘤最大层面手工勾画感兴趣区(region of interest, ROI),避开血管、坏死等区域,测量肿瘤和邻近肝实质的信号(signal intensity, SI),RER=(增强SI肿瘤/增强SI肝实质)/(平扫SI肿瘤/平扫SI肝实质)。
1.5 统计学分析
使用SPSS 22.0、Medcalc15.0 及R 软件进行统计分析。分别比较训练集、验证集资料的组间差异,符合正态分布的计量资料以均数±标准差(±s)描述并采用独立样本t检验,非正态分布的计量资料以中位(上下四分位数)M(P25,P75)描述并采用Mann-WhitneyU检验;计数资料组间差异的比较采用卡方检验或Fisher 精确检验。将训练集存在组间差异的临床资料、影像特征纳入单因素logistic 回归分析,并将P<0.1的变量进一步纳入多因素logistic回归分析。根据多因素分析结果构建列线图并绘制校准曲线,使用Hosmer-Lemeshow 检验校准曲线拟合度,绘制临床决策曲线评估预测模型的临床适用性。计算所有患者的列线图评分,采用受试者工作特征(receiver operating characteristic, ROC)曲线评估预测评分的诊断效能,计算曲线下面积(area under the curve,AUC)、敏感度、特异度、准确度、阳性预测值及阴性预测值。当约登指数最大时取评分截断值将患者分为高、低风险亚组。采用Kaplan-Meier 生存曲线及log-rank 检验比较CK19 表达阳性、阴性组患者的总体无复发生存率;并比较模型预测高、低风险组患者的总体、早期及晚期无复发生存率。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
共纳入HCC 患者病例220 例,其中男156 例,女64 例,年龄(58.6±9.1)岁。按7∶3 的比例随机分为训练集和验证集,训练集包括CK19 阳性组43 例、CK19 阴性组111 例,验证集包括CK19 阳性组16 例、CK19 阴性组50 例。训练集与验证集HCC 患者的临床病理资料如表1所示,组间比较显示训练集队列的男性患者更少(P=0.008),其余资料差异均无统计学意义(P均>0.05)。
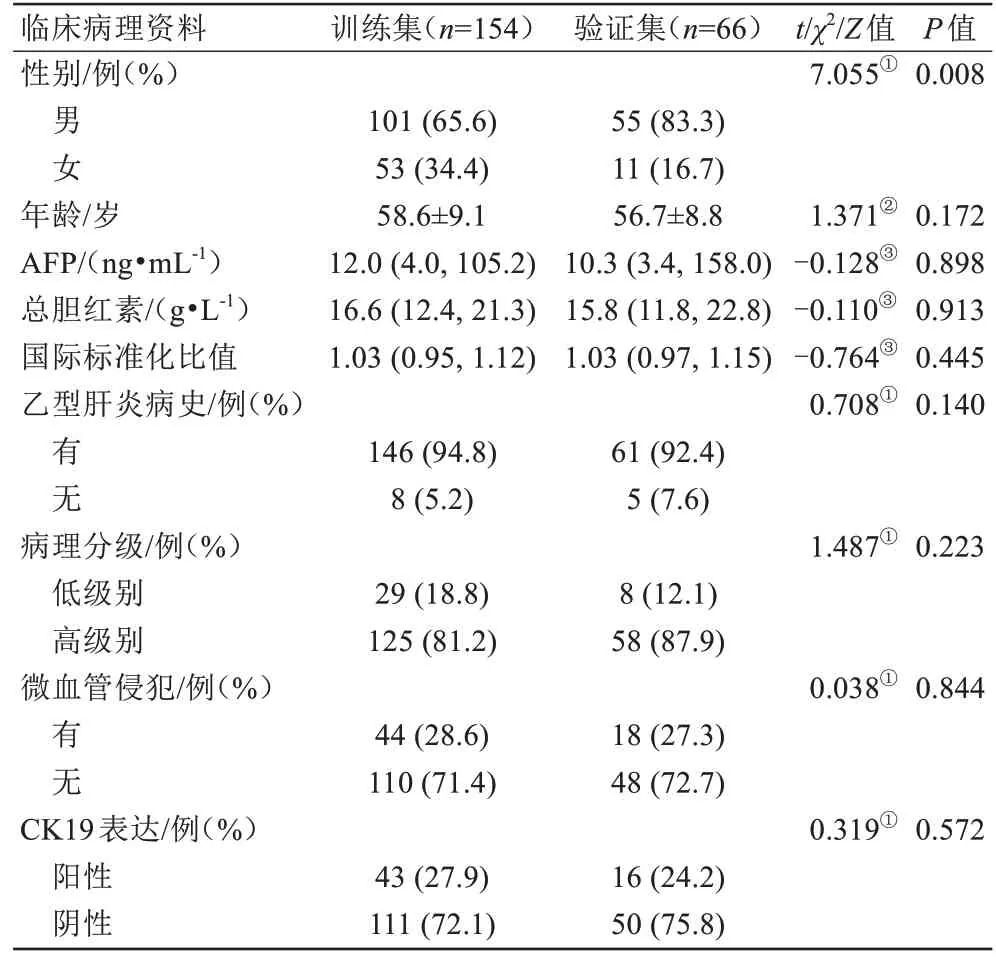
表1 HCC患者的临床病理资料的比较Tab.1 Comparison of clinical and pathological data of HCC patients
2.2 临床影像资料
训练集、验证集CK19 阳性组与CK19 阴性组HCC 患者的临床影像资料如表2所示。在训练集中,CK19阳性组患者AFP水平更高,LR-M 分类、动脉期明显强化、晕状强化、环形动脉期高强化、靶样扩散受限、瘤内坏死或囊变、不光滑肿瘤边缘比例更高,肝胆期RER更低(P均<0.05);在验证集中,CK19阳性组患者的LR-M 分类、动脉期明显强化、环形动脉期高强化、靶样扩散受限、不光滑肿瘤边缘比例更高(P均<0.05)。
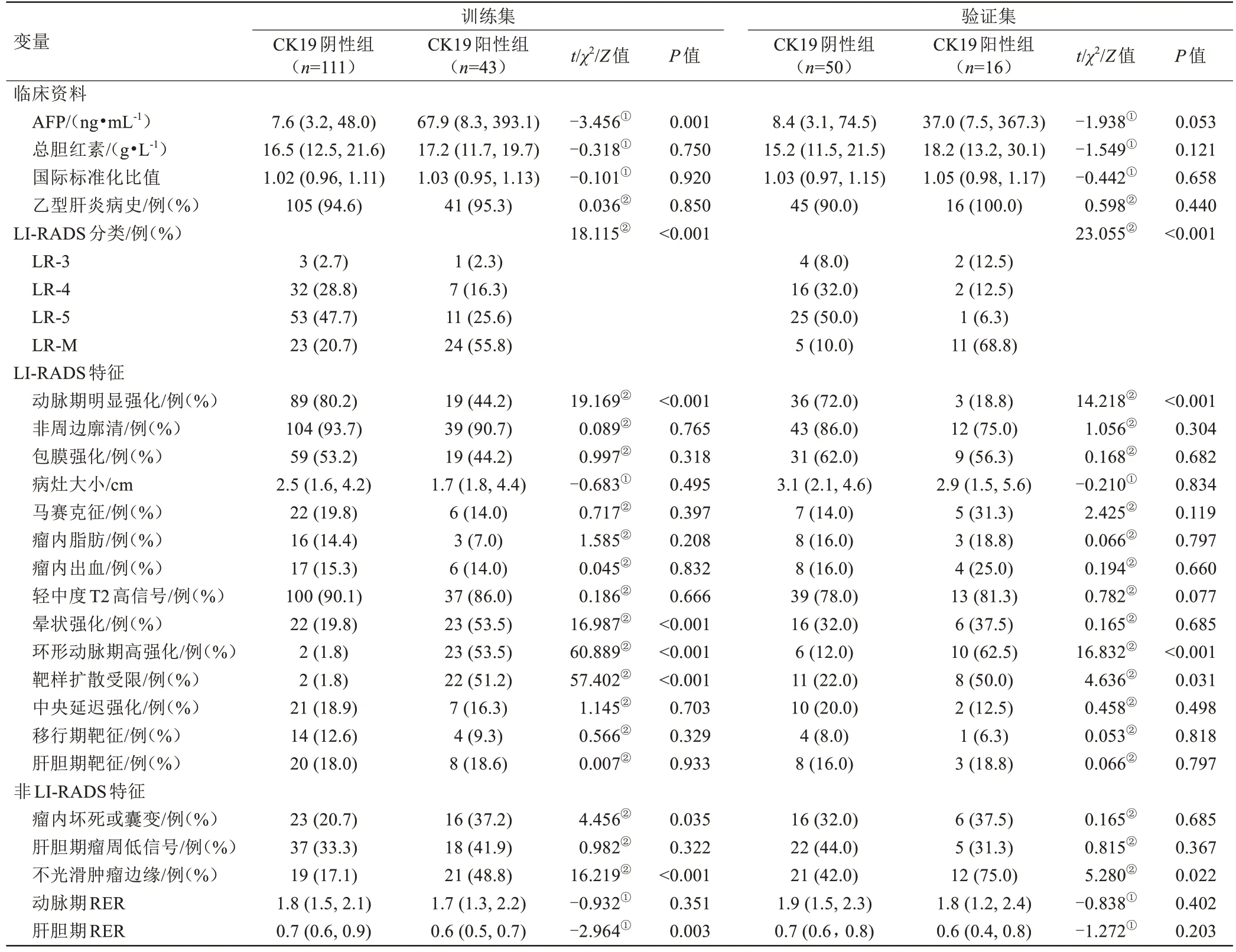
表2 CK19阳性组与CK19阴性组HCC患者的临床影像资料比较Tab.2 Comparison of clinical and imaging features between CK19-positive and CK19-negative HCC patients
2.3 训练集单因素与多因素logistic回归分析
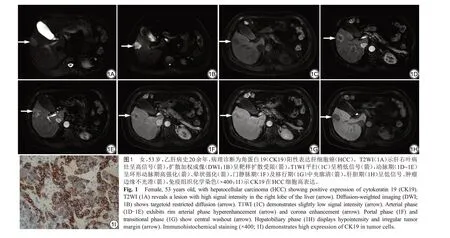
单因素logistic 回归分析结果显示,动脉期明显强化、晕状强化、环形动脉期高强化、靶样扩散受限、瘤内坏死或囊变、不光滑肿瘤边缘、肝胆期RER 与CK19 阳性表达HCC 之间存在潜在相关性(P均<0.05)。上述变量共同纳入多因素logistic 回归分析发现:晕状强化(OR=3.432,95%CI:1.029~11.447;P=0.045)、环形动脉期高强化(OR=32.073,95%CI:1.874~549.040;P=0.017)、靶样扩散受限(OR=12.941,95%CI:2.068~80.988;P=0.006)、不光滑肿瘤边缘(OR=4.590,95%CI:1.359~15.505;P=0.014)及肝胆期RER(OR=0.014,95%CI:0.001~0.549;P=0.023)为CK19 阳性表达HCC 的独立预测因素(表3)。典型病例的影像、病理表现见图1。
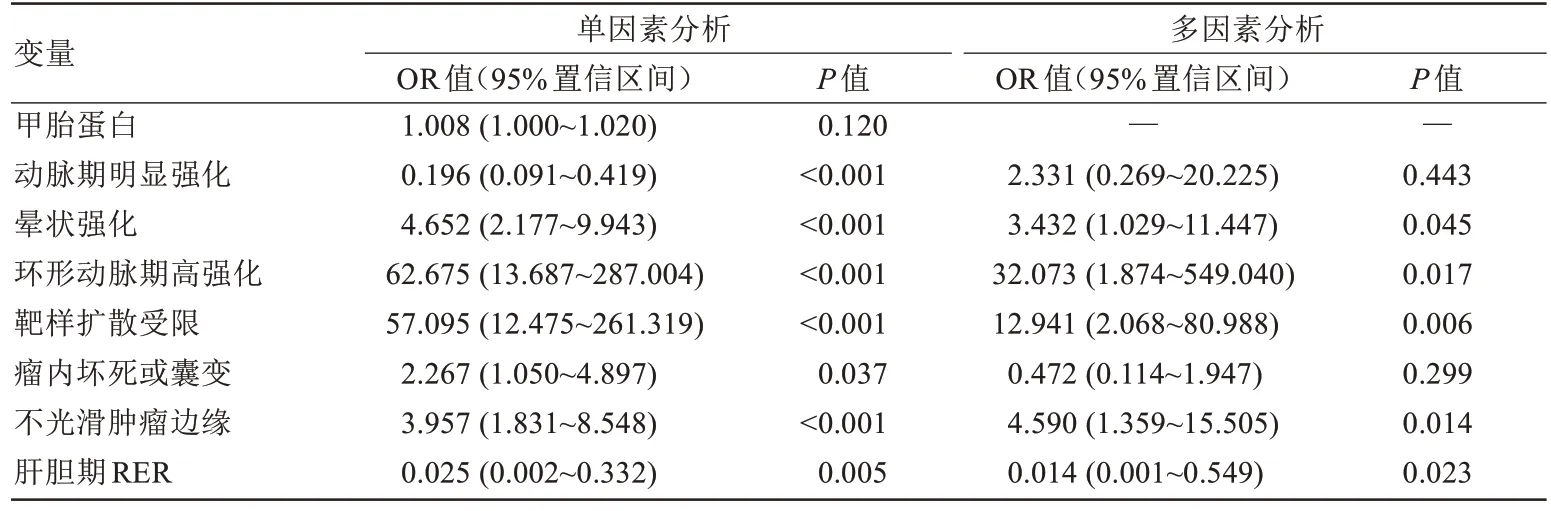
表3 训练集CK19阳性表达HCC的单因素及多因素logistic回归分析Tab.3 Univariate and multivariate logistic regression analysis of CK19-positive expression in HCC in the training set
2.4 列线图构建及模型验证
基于logistic 回归分析构建预测CK19 阳性表达HCC 的列线图(图2)并对各变量赋分,晕状强化=23 分,环形动脉期高强化=50 分,靶样扩散受限=57 分,不光滑肿瘤边缘=26 分,肝胆期RER=-91 分×数值,各变量的分值总和即为每位患者的预测评分。当约登指数最大时,ROC 曲线分析得出的预测模型各项指标如表4所示,提示模型诊断效能较高。预测模型在训练集、验证集的AUC分别为0.884(95%CI:0.823~0.930)、0.748(95%CI:0.625~0.846),显示模型的区分度较高;训练集、验证集的校准曲线(图3)均显示模型预测概率与实际概率之间一致性较好,Hosmer-Lemeshow 检验显示拟合度较高;训练集、验证集的决策曲线(图4)均显示预测模型有较好的临床适用性。

图2 预测角蛋白19 阳性表达肝细胞癌(HCC)的列线图。RER:肿瘤-肝实质相对增强比。Fig.2 Nomogram for predicting cytokeratin 19 positive expression in hepatocellular carcinoma (HCC).RER: the relative enhancement ratio.

表4 预测模型对CK19阳性HCC的诊断效能Tab.4 Diagnostic efficiency of predictive models for CK19-positive HCC
2.5 总队列生存分析
CK19 表达阳性、阴性组患者的中位生存期分别为27.1(95%CI:23.1~31.1)个月、49.7(95%CI:37.7~61.6)个月;模型预测高、低风险组患者的中位生存期分别为26.1(95%CI:20.0~32.2)个月、52.1(95%CI:35.8~68.3)个月。Kaplan-Meier 生存曲线及log-rank检验结果显示:CK19 阳性组患者的总无复发生存率显著差于CK19 阴性组(P=0.019)(图5A),高风险组患者的总无复发生存率显著差于低风险组(P=0.010)(图5B);高风险组患者的早期、晚期无复发生存率均显著差于低风险组(P=0.035,P=0.017)(图5C、5D)。
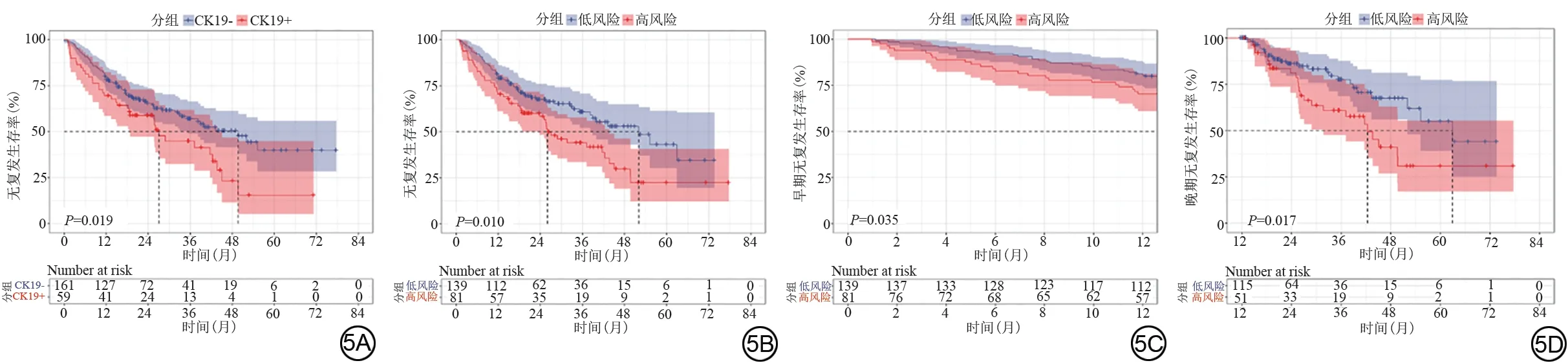
图5 Kaplan-Meier生存曲线分别比较CK19阳性与阴性组的总体无复发生存率(5A),高风险与低风险组的总体(5B)、早期(5C)及晚期(5D)无复发生存率。Fig.5 Kaplan-Meier survival curves comparing overall recurrence-free survival rates between the CK19-positive and negative groups (5A), as well as overall (5B),early (5C) and late(5D) recurrence-free survival rates between high-risk and low-risk groups.
3 讨论
本研究发现晕状强化、环形动脉期高强化、靶样扩散受限、不光滑肿瘤边缘、肝胆期RER 较低是HCC CK19表达的独立预测因素,并根据列线图对因素的危险程度量化赋分、对HCC 的CK19 表达风险进行分层。我们首次将LI-RADS v2018 及其他常用MRI 征象同时纳入研究构建预测模型,并且讨论了模型的预后价值,模型在验证集的ROC 曲线下面积(0.748)、校准曲线及决策曲线分析结果体现了其在临床上具有一定普适性和推广性,有助于临床制订更合理的治疗决策及改善患者预后。
3.1 LI-RADS及其他MRI特征分析
本研究发现晕状强化是HCC CK19 表达的独立预测因素。晕状强化属于LI-RADS 中支持恶性肿瘤的辅助征象,其生物学基础是肿瘤细胞增殖阻塞病灶内的肝静脉,导致血液流入肿瘤周围的窦状动脉或门静脉,从而瘤周肝实质在动脉晚期或者门静脉期强化[23]。既往有研究得出晕状强化是预测HCC CK19 阳性表达的关键因素[24],这与本研究的发现一致。此外,晕状强化还被证实与HCC低分化、MVI密切相关[25-26],提示该征象对于预测HCC的侵袭性方面具有重要价值,而CK19 阳性表达HCC 往往被归为一种侵袭性表型。本研究发现环形动脉期高强化、靶样扩散受限是HCC CK19 表达的独立预测因素,这与先前研究结论一致[13-14,27]。动脉期环状强化、靶样扩散受限属于LR-M 类靶样征象,常见于胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)、混合型肝细胞-胆管细胞癌(combined hepatocellular carcinoma and cholangiocarcinoma, cHCC-CC)及 不 典 型HCC[28]。这两个征象可能是病灶边缘肿瘤细胞丰富、中央纤维成分较多所致[29],类似于ICC和cHCC-CC的病理学特征[30]。CK19表达易促进纤维间质增生[4],预示HCC 有胆管细胞表型分化倾向,因此该类HCC 的组织学特征可介于典型HCC 与ICC 之间[15],从而在影像学上表现为靶样征象。在本研究中,训练集CK19 阳性表达HCC 表现为LR-M 的发生率远高于CK19 阴性表达HCC,这可能也是由于CK19 阳性表达HCC 的病理组织学特点所致,靶样征象的出现使病灶更容易被判定为LR-M类。
本研究发现肿瘤边缘不光滑是HCC CK19 表达的独立预测因素,这一结论与CHOI 等发现一致[12]。肿瘤边缘不光滑反映了肿瘤的病理生长模式,包括局灶性结节突起型、多结节突起型或浸润型,还可能提示包膜破裂或肿瘤细胞浸润到肝实质中,代表肿瘤细胞的侵袭能力[31]。既往研究数据表明,CK19 阳性表达HCC 的大体病理更多表现为多结节突起融合、浸润样生长外观,这也解释了不光滑肿瘤边缘在CK19 阳性表达HCC 出现更频繁的组织学基础[32]。本研究发现肝胆期RER 降低是HCC CK19 表达的独立预测因素。正常肝实质在HBP表现为高信号是由于有机阴离子转运多肽(OATP1B3)促进肝细胞对钆塞酸二钠的摄取,而肿瘤细胞中OATP1B3 表达减少导致其在HBP 表现为低信号[33]。笔者认为,CK19 阳性表达HCC 的侵袭性生物行为可能使肿瘤细胞中OATP1B3 的表达进一步下调,细胞摄取功能不足造成肿瘤HBP信号更低,从而导致肝胆期RER减低。
3.2 预后评估
本研究发现,模型预测高低风险分组的总体复发、早期及晚期复发均存在显著差异,提示HCC CK19表达的风险预测模型有助于评估HCC术后复发。先前研究已指出CK19阳性表达是HCC术后复发、转移的危险因素[34-35],本研究中CK19表达阳性组与模型预测高风险组患者的中位生存期相似,这一结果也提示预测模型与病理在评估预后方面具有相似作用。既往研究表明,不光滑肿瘤边缘、晕状强化与HCC术后侵袭、复发密切相关[36-37]。MOON等[38]发现,LR-M类靶样征象(包括靶样扩散受限、环形动脉期高强化)高度提示HCC患者预后不良。这与本研究结论类似,以上4个影像特征联合肝胆期RER构建的CK19风险预测模型在评估HCC术后复发方面具有一定价值。
3.3 不足与展望
本研究具有以下局限性:首先,本研究为单中心回顾性研究,后续需进行进一步的多中心前瞻性研究以完善预测模型的构建与验证;其次,本研究仅纳入手术切除后的患者,可能存在一定选择偏倚;最后,纳入病例多有乙肝病毒感染病史,后期研究将纳入更多其他肝病背景的HCC患者。
4 结论
综上所述,基于LI-RADS v2018 及其他MRI 征象构建的预测模型可对HCC 的CK19 表达风险进行量化分层,将HCC 患者分为CK19 表达高风险和低风险人群,并可评估HCC患者术后复发,为临床精准治疗提供有效参考。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:张学琴设计本研究的方案,对稿件重要的智力内容进行了修改,获得南通市科技计划项目基金资助;鲁梦恬起草和撰写稿件,获取、分析及解释本研究的数据;瞿琦、徐磊、张继云、刘茂童、姜吉锋、张涛获取、分析或解释本研究的数据,对稿件重要的智力内容进行了修改;徐磊获得南通市卫生健康委科研课题基金资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
