4D-Flow MRI 在肥厚型心肌病左室流出道血流评估中的价值探索
2024-04-12徐晶陈秀玉尹刚闫伟鹏陆敏杰赵世华
徐晶,陈秀玉,尹刚,闫伟鹏,陆敏杰,赵世华
0 引言
心腔内血流模式的识别有助于更好地理解心血管疾病的病理生理过程,可靠的血流分析更是精准诊疗的前提[1]。目前临床上最常用于血流分析的无创性影像学检查手段主要是彩色多普勒超声心动图和二维血流(tow-dimensional flow, 2D-Flow)磁共振成像(magnetic resonance imaging, MRI)技术。超声心动图简便易行,可快速获得平面内血流的可视化及超声束方向上的血流分析,而随心动周期不停流动的血流是多维多向的,但超声对血流的评估是基于正常血流切面及血管形状的假设,且具有实时性、声窗限制及操作者依赖性,只能计算单向血流,而缺少三维信息[2-4];2D-Flow 被认为是流量定量的金标准[5],但同样只能评估单个平面内单个方向的血流束,且在多次屏气扫描过程中很难捕捉到峰值血流速度(峰值流速)所在的平面[6]。四维血流(four-dimensional flow, 4D-Flow)MRI 是一种无创、无需使用对比剂的新兴技术,可以在三个维度上全面评估随时间而变化的血流,包括血流可视化和全面的定量评估[7]。然而,由于4D-Flow 扫描技术普及度不高,数据分析相对复杂,但大血管形态直观,随心动周期产生的位置及形态变化较小,故而既往的研究主要集中在大血管上[1,8-9]。随着4D-Flow技术的不断突破,其在心腔内的应用价值也逐渐受到关注[1,10-11],但主要集中在探索4D-Flow对疾病评估的先进性上[12-16],而少见对4D-Flow 在临床应用中鲁棒性的评估[17-21],尤其是缺乏在不同疾病状态的影响下4D-Flow 的可重复性研究。众所周知,良好的可重复性是决定一项新技术能否成功转化用于临床常规诊疗的关键。因此,本研究拟作为4D-Flow在心腔内应用的一项先验研究,前瞻性入选一批肥厚型心肌病(hypertrophic cardiomyopathy, HCM)患者评估其左室流出道(left ventricular outflow tract, LVOT)峰值流速,旨在通过与临床常用的无创性血流评估技术进行对比,探究4D-Flow 临床应用的可重复性及一致性,为进一步临床推广应用奠定基础。
1 材料与方法
1.1 研究对象
本研究为前瞻性、横断面研究,收集2022 年8 月至2023 年1 月于我院接受心脏MRI 检查的HCM患者。纳入标准:(1)符合2020 美国心脏协会/美国心脏病学会(American Heart Association/American College of Cardiology, AHA/ACC)指南中HCM 的诊断标准[22],包括左心室舒张末期最大室壁厚度≥15 mm,基因阳性或有家族史者≥13 mm,并排除其他导致心肌肥厚的原因等;(2)电影序列显示LVOT 狭窄,且高速血流在流速编码(velocity-encoded, Venc)值为150 cm/s 的2D 相位流速编码电影上存在失相位表现;(3)患者心脏MRI检查前后各一周内接受了超声心动图检查,并评估了LVOT 静息状态下峰值流速。排除标准:(1)心律不齐,合并其他心源性或全身性疾病的患者;(2)患有幽闭恐惧症或配合不佳,未能完成扫描的患者;(3)4D-Flow 图像质量不佳,无法进行后处理者。本研究遵守《赫尔辛基宣言》,通过中国医学科学院阜外医院伦理委员会审批(批准文号:IRB2022-BG-006),所有入选对象均签署知情同意书。
1.2 图像采集
采用3.0 T MRI 扫描仪(美国GE 医疗集团Discover MR750 和荷兰Philips 公司Ingenia),由心脏MRI诊断经验丰富的医生(≥10年,副主任医师)和扫描经验丰富的技师(≥10 年,中级工程师)共同配合,取患者仰卧位进行心脏扫描。2D-Flow 序列于呼气末屏气采集,首先采用平行于LVOT的平面内流速编码电影确定血流状态,然后在目测流速最高处,扫描垂直于血流方向的通过平面的流速编码电影,并选用合适的Venc值以确保获得图像内没有混叠效应伪影。4D-Flow 序列取斜矢状位,扫描范围覆盖整个心脏及胸主动脉,采用自由呼吸、回顾性心电门控同步采集数据和心脏运动状态,采用自适应笛卡尔采样自动校正重建加速技术(GE设备)或并行采集加速技术(Philips设备)以缩短扫描时间。同一患者的2D-Flow和4D-Flow 均在相同设备和相同状态(平扫/增强)下扫描,具体扫描参数详见表1。结合文献和本研究情况,4D-Flow的Venc值设为150~250 cm/s[12,23],同时使用带有相位展开技术的后处理软件进行信号校正后测量[24]。
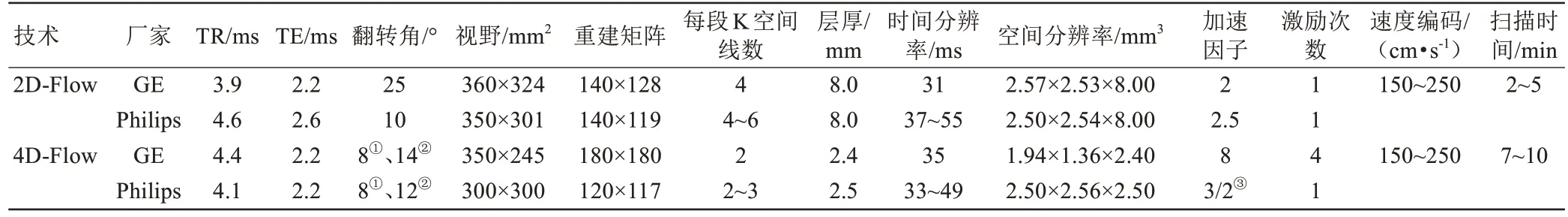
表1 2D-Flow和4D-Flow的基本扫描参数Tab.1 The basic scan parameters of 2D-Flow and 4D-Flow
所有患者于MRI 前后各一周内接受至少一次常规二维及多普勒超声心动图(EPIQ 7, Philips Healthcare)检查,取半左侧卧位,心尖五腔心或心尖三腔心切面,同时显示LVOT血流颜色最杂乱的部分及其近、远端血流,通过连续频谱多普勒测定收缩期峰值流速,定量评估LVOT梗阻严重程度。
1.3 图像分析
使用Circle CVI 42(Version 5.14.2,加拿大)软件,由2 名具有3 年以上心脏MRI后处理经验的住院医师以双盲法对2D-Flow 和4D-Flow 图像进行后处理分析,其中1 名医师于1 个月后再进行一次后处理。2D-Flow 后处理通过在CVI 相应模块内通过勾画感兴趣区、并进行背景校正后获得LVOT 峰值流速;4D-Flow 后处理需要首先划定感兴趣区、校正偏倚及混叠伪影,然后根据需要对心腔进行分割,保留部分/全部左房、完整左室及部分升主动脉,最后进行流速、迹线图等多种可视化分析,通过双平面定位法结合在可视化图像上融合高分辨率的左室流出道电影序列辅助定位,获得LVOT 峰值流速。图1 为心腔内4D-Flow后处理流程示意图。
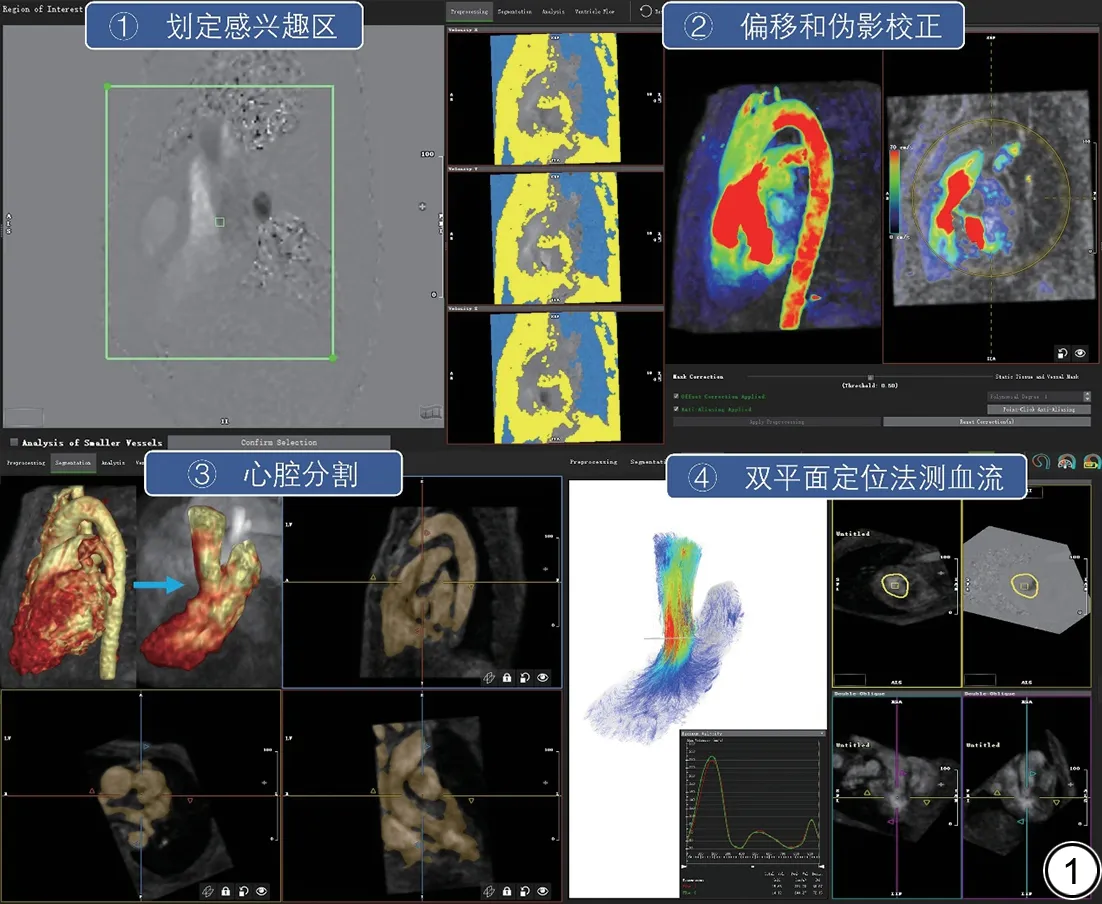
图1 使用Circle CVI 42 进行心腔内四维血流(4D-Flow)后处理流程示意图。Fig.1 Schematic diagram of intracardiac four-dimensional flow(4D-Flow) post-processing by Circle CVI 42.
1.4 统计学分析
采用SPSS 23.0软件进行统计学分析。采用组内相关系数(intra-class correlation coefficient, ICC)、变异系数(coefficient of variation, COV)及Bland-Altman分析评估2D-Flow、4D-Flow 的可重复性,组内/组间COV 则通过两次测量间差异的标准差除以测量平均值获得,并以百分比表示[25]。COV 和ICC 按照先前研究[26]使用的标准进行评价:COV<10%认为可以接受,11%~20%认为适度但足够,>20%认为过高;ICC<0.50表示一致性较差,0.50~<0.75认为一致性中等,0.75~0.90 认为一致性较好,0.90 以上一致性极好。采用ICC 及Bland-Altman 分析评估2D-Flow、4D-Flow、超声心动图间的一致性,并通过Pearson 相关性分析评估三者间的相关性,相关系数r的绝对值≥0.8 认为高度相关,0.5~<0.8 认为中度相关,0.3~<0.5 认为低度相关,<0.3 时认为基本不相关。P<0.05时认为差异有统计学意义。
2 结果
2.1 基本资料
共21 例HCM 患者完成全部心脏MRI 及超声心动图检查,图像质量均可用于后处理分析。入组患者总体年龄为14~70(46±14)岁,其中男14 例(66.7%),18例(85.7%)患者通过Philips MRI扫描仪完成扫描。2D-Flow 测量21 例患者的平均LVOT 峰值流速为(2.3±0.5) m/s,4D-Flow测量的平均值为(2.8±0.6) m/s,超声心动图测量的平均值为(3.5±1.2) m/s,三种技术的测量结果没有显示出一致的变化趋势,个体化变化趋势如图2所示。
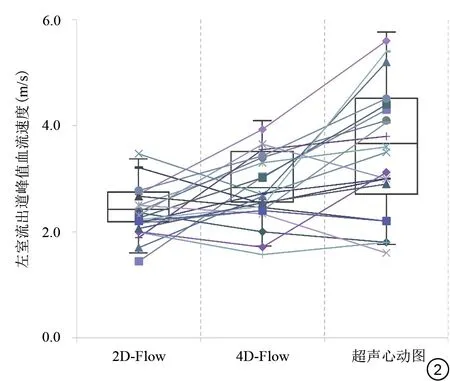
图2 二维血流(2D-Flow)、四维血流(4D-Flow)及超声心动图测量下左室流出道峰值流速的个体化变化趋势图。Fig.2 Individualized changes of peak velocity of left ventricular outflow tract measured by tow-dimensional flow (2D-Flow), four-dimensional flow (4D-Flow) and echocardiography.
2.2 2D-Flow观察者内和观察者间测量一致性
同一医师通过2D-Flow 两次测量同一患者的LVOT 峰值流速的ICC 及COV 分别为0.999(P<0.05)和0.5%;不同医师测量同一患者的LVOT峰值流速的ICC 及COV 分别为0.999(P<0.05)和0.5%。2D-Flow测量一致性的Bland-Altman分析结果如图3所示。
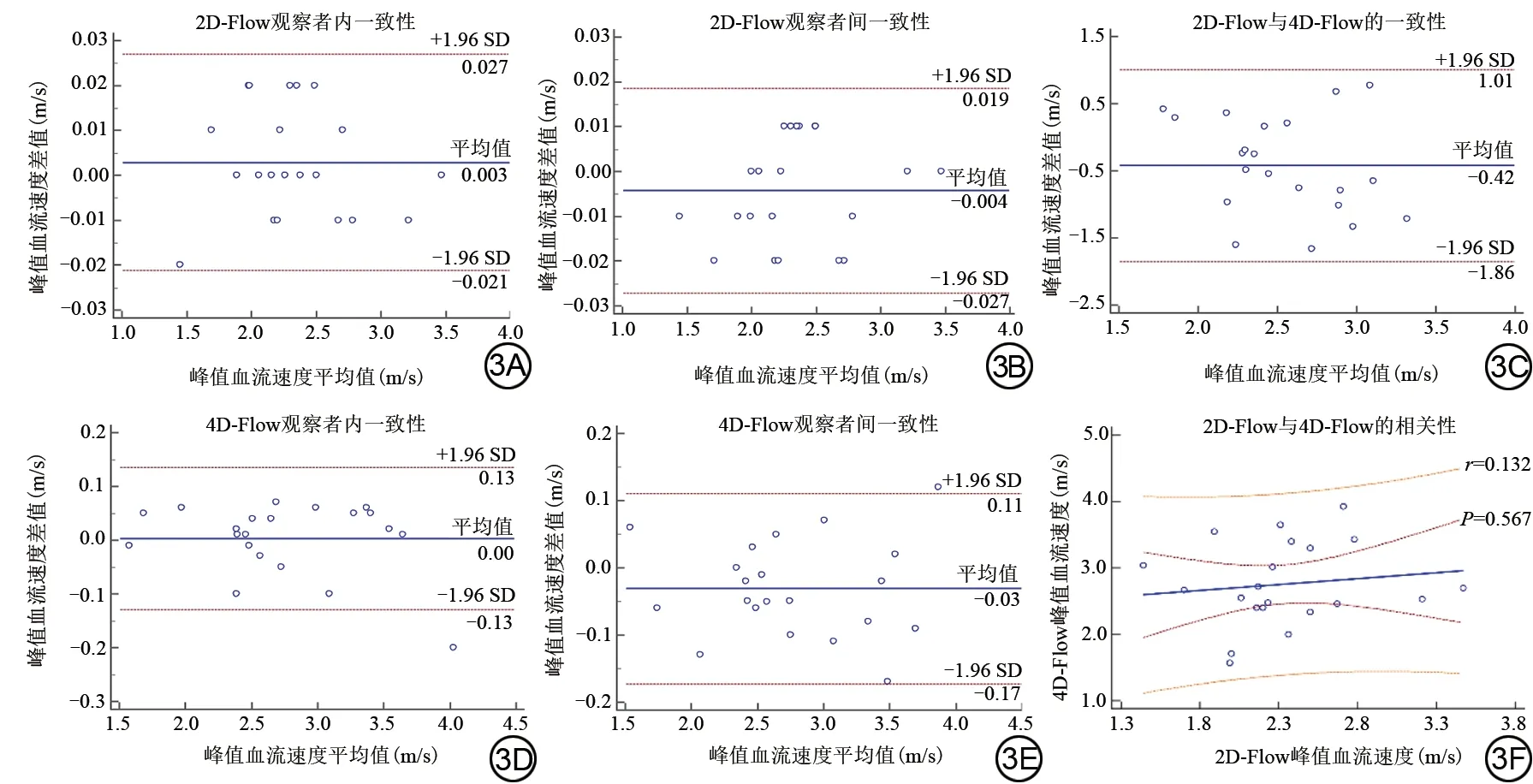
图3 二维血流(2D-Flow)和四维血流(4D-Flow)测量左室流出道(LVOT)峰值流速的可重复性及一致性分析。Fig.3 Repeatability and consistency analysis of peak velocity of left ventricular outflow tract (LVOT) measured by two-dimensional flow (2D-Flow) and four-dimensional flow (4D-Flow).
2.3 4D-Flow观察者内和观察者间测量一致性
同一医师通过4D-Flow 两次测量同一患者的LVOT峰值流速的ICC及COV分别为0.995(P<0.05)和2.4%;不同医师测量同一患者的LVOT峰值流速的ICC及COV 分别为0.992(P<0.05)和2.6%。4D-Flow 测量一致性的Bland-Altman分析结果如图3所示。
2.4 2D-Flow、4D-Flow、超声心动图间测量结果的比较
4D-Flow和超声心动图测量的LVOT峰值流速具有中度相关性(图3),相关系数r为0.574(P=0.006),但一致性较差,ICC 为0.375(P=0.013),Bland-Altman分析结果如图4 所示;2D-Flow 和超声心动图测量的LVOT 峰值流速间没有显著相关性(P=0.670,图4),ICC 为-0.038(P=0.617);2D-Flow 和4D-Flow 测量的LVOT 峰值流速亦没有显著相关性(P=0.567,图3),ICC为0.102(P=0.287)。

图4 二维血流(2D-Flow)、四维血流(4D-Flow)与超声心动图测量左室流出道(LVOT)峰值流速的一致性分析。Fig.4 Consistency analysis of peak velocity of left ventricular outflow tract (LVOT) measured by two/four-dimensional flow (two/four D-Flow) and echocardiography.
3 讨论
本研究通过在HCM患者中应用磁共振4D-Flow、2D-Flow 及超声心动图三种影像学技术测量LVOT的峰值流速,发现4D-Flow可以很好地可视化心腔内血流,具有较高的可重复性,且与超声心动图具有显著的一致性。这一发现有望推动4D-Flow 在不同疾病心腔内应用的研究进程,为进一步的血流动力学、形态学分析及相关疾病的预后研究打下基础。
3.1 4D-Flow的技术优势
本研究中的21 例患者在2D-Flow、4D-Flow 及超声心动图测量下LVOT峰值流速的变化较为迥异,三种技术间的一致性也有较大不同,2D-Flow 具有极高的观察者内和观察者间可重复性,但却与4D-Flow和超声心动图的测量结果间不具有显著一致性。结合三种技术的原理及局限性可以在很大程度上解释以上现象。彩色多普勒超声心动图是心腔内血流评估最常用的影像学工具,它通过简化的伯努利方程计算峰值流速和平均压差,不仅可以测量超声束方向上的血流速度分量,亦可提供单向血流速度的2D 可视化。然而,由于超声检查具有实时性,在很大程度上依赖于操作者的专业性,尤其是在有限的声窗下,较难实现对可变速度的准确评估(即超声束对准)[2-4]。2D-Flow 是心脏MRI 最常用的血流评估技术,它通过相位流速编码技术在垂直于2D 血流方向的平面上获得单个平面的流速编码电影序列[6,27],被认为是流量定量的金标准[5]。然而在临床应用中,由于心脏本身的运动以及患者前后扫描过程中可能存在的屏气幅度的不一致,2D-Flow 往往很难捕捉到峰值流速所在的平面,而这一局限性可以通过加强患者呼吸配合训练进行一定程度的弥补。4D-Flow 与前两者不同,它可以测量视野内所有空间区域、任意方向的血流,且允许临床进行回顾性的血流评估;此外,由于对视野内血流的完整量化,可以避免遗漏感兴趣区内的血流束,因此4D-Flow的可视化评估更有助于识别复杂的血流模式[1]。然而,回顾性的血流评估得益于特定的后处理软件,在精准的前提下可以有效缩短患者的检查时间,但也不可避免地增加了后处理时间。
3.2 4D-Flow在心腔内应用的可重复性
鉴于4D-Flow的成像优势,我们期望这项技术能在国内呈现良好的发展趋势,成为未来评估心腔内血流的可靠影像学工具。目前,4D-Flow 显示出与心脏结构、功能参数具有密切的相关性[14],且已在正常志愿者中被证实具有良好的扫描-再扫描的可重复性和稳定性[17];2021 年DEMIR 等[18]通过多中心的15 例健康志愿者证实了4D-Flow 具有良好-优秀的扫描-再扫描及观察者内、观察者间可重复性(ICC≥0.8),但他们也进一步发现不同扫描仪获得的4D-Flow 参数可能是不一致的(n=10)[18],虽然这项研究样本量有限,但也足以提示我们在今后的研究中应注意使用相同的扫描仪进行随访。在HCM 患者中,GUPTA 等[19]通过比较MRI 间接容积法、4D-Flow直接测量法和超声心动图评估二尖瓣反流间的一致性(n=37),发现间接容积法观察者间可重复性有限,4D-Flow 是一种潜在的替代技术,可以直接定量评估二尖瓣反流的严重程度,且具有出色的观察者间和观察者内的可重复性,与超声心动图的一致性也更高[19];另一项国际多中心较大样本研究(7 个中心,140 例)也证明了尽管使用不同的扫描仪和扫描方案,使用自动回顾性瓣膜追踪技术定量评估4D-Flow图像仍具有较高的观察者内和观察者间一致性[20]。然而,目前国内仍罕见4D-Flow在患有心脏疾病的患者心腔内应用的可重复性研究发表。国内先前的一项探究4D-Flow 可重复性及一致性的研究聚焦于评估法洛四联症矫正术后的肺动脉瓣反流情况[21],而更遗憾的是,另一项探究心腔内4D-Flow 评价HCM 患者左心室舒张功能可行性的研究中,没有指出该技术的可重复性[16]。因此,本研究前瞻性纳入一批HCM 患者,希望通过这一较为常见心肌疾患,为4D-Flow在心腔内的研究奠定基础。
3.3 4D-Flow的技术难点及解决方案
4D-Flow 的扫描和后处理技术是目前临床最为关注的难点。事实上,4D-Flow 的扫描并不复杂,结合心电门控及膈肌导航技术,患者可以在自由呼吸状态下完成整个序列的扫描,且在加速成像技术的支持下[28],4D-Flow 扫描时间大大缩短,目前临床完成一例主动脉扫描甚至可在2 min 内完成。然而,4D-Flow 的扫描时间与扫描范围密切相关,本研究中进行的全心4D-Flow 扫描,亦可在10 min 甚至更短时间内完成。在临床应用时,建议结合患者病情,个性化选择扫描范围、定制扫描方案即可大大缩短扫描时间。4D-Flow 的数据处理是心脏MRI 中公认的较为复杂的后处理过程,但随着近年来多样化分析工具的开发[1,29],逐步规范化的后处理流程已在较大程度上改善这一过程,尤其是人工智能的介入,已经被证明不仅可以有效辅助医生在后处理时简化对心腔分割这一复杂流程,还能有效减轻观察者间的变异性[30]。但进一步建立标准化分析方案、统一工作流程将更加有助于提高效率并提高技术的可重复性。此外,本研究中有15 例患者在输注钆对比剂之后进行4D-Flow 的数据采集。增强扫描可以有效提高信噪比,但其带来的改善可能因输注对比剂后的持续时间而异。
3.4 本研究的局限性
本研究为单中心前瞻性研究,样本量较小,且未对更多的参数及扫描-再扫描的可重复性进行研究,因此提供的可重复性及一致性分析价值有限,需要更大样本量、更多病种的前瞻性试验进行完善,并能够进一步探究心腔内血流形态学、动力学参数的改变特点及临床意义。
4 结论
综上所述,本研究初步证明了4D-Flow MRI 能够实现心腔内血流的可视化,其测量的左室流出道峰值流速具有很好的可重复性,且与超声心动图的测量结果具有一定的一致性。作为4D-Flow MRI 在心腔内应用的先验研究,本研究可为进一步探究4D-Flow MRI在不同疾病心腔内的血流动力学、形态学分析及预后研究打下基础。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:赵世华设计指导本研究的方案,对稿件重要内容进行了修改,获得了国家重点研发计划项目、国家自然科学基金项目资助;徐晶起草和撰写稿件,获取、分析和解释本研究的数据;陈秀玉、尹刚参与了研究方案设计,起草了稿件中关键性理论部分;闫伟鹏获取、分析和解释本研究的数据,参与撰写稿件初稿;陆敏杰获取、分析和解释本研究的数据,对稿件重要内容进行了修改,获得高水平医院临床科研青年重点项目资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
