LINC00115靶向miR-874-3p调控肝癌细胞生物学行为以及紫杉醇敏感性*
2024-04-11刘杨从
王 威, 夏 辉, 周 程, 刘杨从, 戴 斌△
华中科技大学同济医学院附属武汉中西医结合医院,武汉市第一医院 1肝胆外科 2药学部,武汉 430022
肝癌是全球癌症致死的第三大原因,每年导致约83万人死亡[1]。手术切除对早期肝癌有效,化疗是延长中晚期肝癌患者生存期的重要手段,但术后复发转移频繁,预后并不理想。紫杉醇是新型抗微管药物,其通过抑制细胞有丝分裂在卵巢癌、乳腺癌中疗效显著,但其对肝癌有效性一般,这主要与肝癌对紫杉醇耐药有关[2-3]。探讨肝癌转移和紫杉醇抗性的潜在机制对增加紫杉醇敏感性、抑制肝癌进展具有重要价值。长链非编码RNA(lncRNA)不具备编码蛋白质能力,其通过转录激活、吸附miRNA、结合蛋白、或编码小肽等多种方式调控细胞功能[4]。lncRNA表达失调已被证实与肝癌细胞的持续增殖、凋亡抵抗、血管形成、化疗耐药、异常侵袭有关[5]。结直肠癌中LINC00115表达上调,并通过促进癌细胞侵袭、抑制凋亡促进结肠癌进展[6]。LINC00115通过靶向miR-200s促进胶质瘤干细胞样细胞自我更新和致瘤性[7]。但LINC00115在肝癌中的生物学作用未见报道。miR-874-3p是一种肝癌抑制因子,miR-874-3p下调与肿瘤细胞分化较差、分期较晚和患者预后较差有关[8]。miR-874-3p能够抑制上皮性卵巢癌细胞的增殖、转移和紫杉醇耐药[9]。生物信息学预测显示miR-874-3p是LINC00115的潜在靶点,据此本研究探讨LINC00115靶向miR-874-3p在肝癌中的作用。本研究通过检测LINC00115、miR-874-3p在肝癌组织、细胞系中的表达情况,分析其对肝癌细胞生物学行为和紫杉醇敏感性的影响,揭示LINC00115对miR-874-3p的靶向调控作用,旨在为肝癌治疗提供潜在可用靶点。
1 材料与方法
1.1 肝癌组织和细胞系
在2019年1月至2019年12月收集被诊断为肝癌且在武汉市第一医院接受手术治疗的43例肝癌患者(男29例,女14例,年龄48~71岁,平均年龄56岁)的肝癌组织和匹配癌旁组织(非癌组织)。排除术前接受抗肿瘤治疗患者、既往癌症史者以及未签署书面知情同意书的患者。所有样品在使用前均保存在液氮中。所有程序均符合《赫尔辛基宣言》指导原则。
肝癌细胞系MHCC-97H、Hep3B、SK-HEP-1以及人肝永生化细胞THLE-3购自美国ATCC公司。
1.2 主要试剂
RNeasy Plus Mini试剂盒购自北京天根生化公司;PrimeScriptTM逆转录试剂盒、SYBR Premix Ex Taq购自大连TaKaRa公司;重组荧光素酶报告质粒、si-RNA、miRNA模拟物、anti-miRNA、pcDNA购自苏州迅捷生物公司;紫杉醇(纯度99.9%)购自上海研生生化试剂有限公司;CCK-8溶液、放射免疫沉淀测定(RIPA)缓冲液购自上海碧云天生物公司;多药耐药蛋白1(MRP1)兔多抗(pro_39022)购自北京世联博研生物公司;羊抗兔IgG二抗(ab205718)、基质金属蛋白酶2(MMP2)兔多抗(ab97779)、MMP9兔多抗(ab38898)、β肌动蛋白(β-actin)兔多抗(ab16039)购自上海艾博抗公司。
1.3 qRT-PCR检测LINC00115和miR-874-3p表达
用RNeasy Plus Mini试剂盒分离总RNA,用PrimeScriptTM逆转录试剂盒将总RNA逆转录为cDNA,用SYBR Premix Ex Taq进行qRT-PCR。LINC00115和miR-874-3p表达水平用2-ΔΔCt方法计算。LINC00115引物上游5′-TGGCTTGTCTT-CCATCGTCC-3′,下游5′-GCACGAGGGTTGTT-ACAGGA-3′;β-actin引物上游5′-GGGAAATCG-TGCGTGACATTAAG-3′,下游5′-GTCAGGCA-GCTCGTAGCTCT-3′;U6引物上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGA-ATTTGCGT-3′;miR-874-3p引物上游5′-GAAC-TCCACTGTAGCAGAGATGGT-3′,下游5′-CAT-TTTTTCCACTCCTCTTCTCTC-3′。
1.4 细胞培养和实验分组
MHCC-97H、Hep3B、SK-HEP-1以及THLE-3细胞接种在添加10%胎牛血清(FBS)的DMEM培养液,放入37℃、含5% CO2培养箱中孵育。将MHCC-97H细胞接种到6孔板,细胞密度为1×104个/孔,用脂质体3000将40 nmol/L的寡核苷酸或0.4 μg质粒分别转染50%汇合的细胞,分为对照(NC)组、si-NC组、si-LINC00115组、miR-NC组、miR-874-3p组、pcDNA组、pcDNA-LINC00115组、anti-miR-NC+si-LINC00115组、anti-miR-874-3p+si-LINC00115组,通过qRT-PCR检测转染48 h细胞中LINC00115或miR-874-3p表达,随后进行下一步实验。
1.5 CCK-8法检测细胞活力和对紫杉醇的IC50值
细胞活力测定:将转染细胞以1×103个/孔接种到96孔板,并在37°C培养箱孵育48 h,更换为含10% CCK-8溶液的培养液。通过酶标仪在450 nm处检测吸光度(A)值。
IC50值测定:将转染细胞以1×103个/孔接种到96孔板,分别用不同浓度(1.25、2.5、5、10、20、40 μmol/L)的紫杉醇处理细胞48 h,更换为含10% CCK-8溶液的培养液。通过酶标仪在450 nm处检测吸光度(A)值,绘制量效曲线,计算IC50值。
1.6 Transwell法检测细胞迁移和侵袭
用不含FBS培养液将转染细胞悬浮并稀释至1×105个/mL的密度,取200 μL加入带有(用于侵袭)或不带有(用于迁移)基质胶的Transwell上室。将小室置于24孔板,加入600 μL含FBS的培养液。37℃孵育24 h后,擦去上室内细胞,分别用4%多聚甲醛固定,0.1%结晶紫染色。在显微镜下计数随机5个视野细胞总数,取均值表示侵袭细胞数。
1.7 Western blot检测MRP1、MMP2和MMP9蛋白水平
收集转染细胞,加入RIPA缓冲液提取总蛋白。制备分离胶和浓缩胶,将样品以每道30 μg添加到凝胶孔中。在80 V(浓缩胶)、120 V(分离胶)进行电泳直到溴酚蓝到达凝胶边缘。将蛋白湿转至PVDF膜,随后用5%脱脂奶粉封闭2 h,然后与一抗4℃孵育12 h。用PBS洗膜后,将膜与二抗在室温下孵育2 h。将增强型化学发光显影剂A和B以等体积混合并滴加到PVDF膜进行曝光和成像。Image J软件测定MRP1、MMP2和MMP9条带及β-actin条带的灰度值。
1.8 双荧光素酶报告基因实验
将包含野生型(WT)或突变型(MUT)miR-874-3p结合位点的LINC00115片段分别克隆到pGL4荧光素酶报告载体,构建重组载体WT-LINC00115、MUT-LINC00115。将以上重组载体分别与miR-874-3p模拟物或miR-NC分别转染到MHCC97H细胞中,在转染48 h后测定细胞相对荧光素酶活性。
1.9 统计学方法

2 结果
2.1 肝癌组织中LINC00115和miR-874-3p表达情况
肝癌组织中LINC00115表达水平显著高于癌旁组织[(2.94±0.31)vs.(1.00±0.13),P<0.05],miR-874-3p表达水平显著低于癌旁组织[(0.46±0.06)vs.(1.00±0.14),P<0.05]。
2.2 肝癌细胞系中miR-874-3p和LINC00115的表达情况
与人肝永生化细胞THLE-3比较,肝癌细胞系(MHCC97H、Hep3B、SK-HEP-1)中LINC00115表达水平显著升高(均P<0.05),miR-874-3p表达水平显著降低(均P<0.05),见表1。
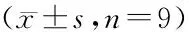
表1 肝癌细胞系中miR-874-3p和LINC00115的表达情况Table 1 Expression of miR-874-3p and LINC00115 in liver cancer cell
2.3 下调LINC00115表达对肝癌细胞MHCC97H增殖、迁移、侵袭以及紫杉醇敏感性的影响
与si-NC组比较,si-LINC00115组MHCC97H细胞LINC00115表达水平、A值、迁移数、侵袭数、对紫杉醇IC50值以及MRP1、MMP2和MMP9蛋白水平显著降低(均P<0.05),见图1和表2。

图1 Western blot检测MMP2、MMP9、MRP1蛋白表达Fig.1 The protein expressions of MMP2,MMP9 and MRP1 detected by Western blotting
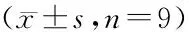
表2 下调LINC00115表达对肝癌细胞MHCC97H增殖、迁移、侵袭以及紫杉醇敏感性的影响Table 2 Effects of downregulation of LINC00115 on proliferation,migration,invasion and paclitaxel sensitivity of liver cancer cell
2.4 上调miR-874-3p表达对肝癌细胞MHCC97H增殖、迁移、侵袭以及紫杉醇敏感性的影响
与miR-NC组比较,miR-874-3p组MHCC97H细胞miR-874-3p表达水平显著升高(P<0.01),A值、迁移数、侵袭数、对紫杉醇IC50值以及MRP1、MMP2和MMP9蛋白水平显著降低(均P<0.01),见图2和表3。
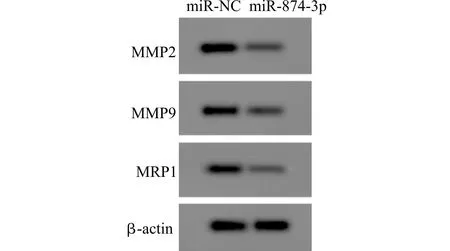
图2 Western blot检测MMP2、MMP9、MRP1蛋白表达Fig.2 The protein expression of MMP2,MMP9 and MRP1 detected by Western blotting
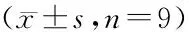
表3 上调miR-874-3p表达对肝癌细胞MHCC97H增殖、迁移、侵袭以及紫杉醇敏感性的影响Table 3 Effects of upregulation of miR-874-3p on proliferation,migration,invasion and paclitaxel sensitivity of liver cancer cell
2.5 LINC00115靶向调控miR-874-3p表达
LncBase Predicted V.2预测到miR-874-3p与LINC00115序列存在互补位点,见图3。miR-874-3p模拟物和WT-LINC00115共转染与miR-NC和WT-LINC00115共转染比较细胞活力显著降低[(0.47±0.04)vs.(1.00±0.11),P<0.05];miR-874-3p模拟物和MUT-LINC00115共转染与miR-NC和MUT-LINC00115共转染比较差异无统计学意义[(1.02±0.11)vs.(1.00±0.10),P=0.692]。pcDNA-LINC00115组MHCC97H细胞LINC00115表达水平显著高于pcDNA组[(2.48±0.21)vs.(1.00±0.08),P<0.05],miR-874-3p表达水平显著低于pcDNA组[(0.48±0.04)vs.(1.00±0.10),P<0.05];si-LINC00115组MHCC97H细胞LINC-00115表达水平显著低于si-NC组[(0.43±0.04)vs.(1.01±0.12),P<0.05],miR-874-3p表达水平显著高于si-NC组[(1.96±0.17)vs.(0.99±0.10),P<0.05]。

图3 LncBase Predicted V.2对LINC00115和miR-874-3p结合进行预测示意图Fig.3 The combination of LINC00115 and miR-874-3p predicted by LncBase Predicted V.2
2.6 下调miR-874-3p可以逆转LINC00115低表达对肝癌细胞MHCC97H增殖、迁移、侵袭以及紫杉醇敏感性的影响
与anti-miR-NC+si-LINC00115组比较,anti-miR-874-3p+si-LINC00115组MHCC97H细胞miR-874-3p表达水平显著降低(P<0.01),A值、迁移数、侵袭数、对紫杉醇IC50值以及MRP1、MMP2和MMP9蛋白水平显著升高(均P<0.01),见图4和表4。

1:anti-miR-NC+si-LINC00115;2:anti-miR-874-3p+si-LINC00115
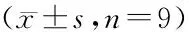
表4 下调miR-874-3p可以逆转LINC00115低表达对肝癌细胞MHCC97H增殖、迁移、侵袭以及紫杉醇敏感性的影响Table 4 Downregulation of miR-874-3p can reverse the effects of low LINC00115 expression on proliferation,migration,invasion and paclitaxel sensitivity of MHCC97H
3 讨论
肝癌是一种侵袭性恶性肿瘤,由于其复发率高、转移和化疗耐药频繁,现在的临床治疗效果总是不尽如人意。目前研究表明lncRNA表达异常与肝癌发生有关,其可调节肝癌细胞生物学行为和化疗敏感性,是抑制肝癌进展的理想靶点[5]。研究发现LINC00115参与乳腺癌的转移,其高表达预示预后较差[10]。下调LINC00115通过抑制肺癌上皮间质转化从而阻碍癌细胞迁移和侵袭[11]。本研究检测到LINC00115在肝癌组织、细胞系中表达增加,下调LINC00115表达显著降低肝癌细胞活力,减少迁移和侵袭数,同时伴随着促转移因子MMP2和MMP9水平降低,表明LINC00115在肝癌中扮演致癌基因角色,下调LINC00115可能是抑制肝癌细胞恶性行为的重要策略。肿瘤细胞通过耐药对化疗药物失去反应性,这是肿瘤复发和转移的关键,最终导致肿瘤治疗失败。MRP1是药物外排转运蛋白,其广泛表达参与多种癌细胞的化疗耐药性[12-13]。本研究中下调LINC00115表达可降低肝癌细胞对紫杉醇的IC50值,降低MRP1蛋白水平,表明下调LINC00115表达可提高肝癌细胞对紫杉醇的敏感性。
lncRNA可作为分子海绵与miRNA结合,导致miRNA靶基因重新激活从而发挥生物学功能[14]。据报道,LINC00115通过与miR-30a结合上调SOX9促进卵巢癌干细胞的干性并抑制凋亡[15]。本研究检测到miR-874-3p在肝癌组织、细胞系中表达下降,并证实miR-874-3p是LINC00115的直接靶点。研究表明miR-874-3p表达水平与食管鳞癌的淋巴结转移及临床分期之间有关联,miR-874-3p低表达是食管鳞癌预后不良的重要因素[16]。miR-874-3p通过下调靶基因调节剂G蛋白4(RGS4)水平抑制骨肉瘤细胞增殖和转移[17]。另有研究表明miR-874-3p还可作为TP73-AS1、DANCR、MCF2 L-AS1等lncRNA的下游靶miRNA,介导敲低lncRNA表达对视网膜母细胞瘤、三阴性乳腺癌、结直肠癌细胞恶性表型的抑制作用[18-20]。本研究证实上调miR-874-3p表达可降低肝癌细胞活力,下调MMP2、MMP9、MRP1蛋白表达,抑制细胞侵袭和迁移,并提高其对紫杉醇的敏感性。由于上调miR-874-3p表达和下调LINC00115表达对肝癌细胞的紫杉醇增敏以及抗增殖、抗迁移和抗侵袭效应一致,LINC00115靶向负调控miR-874-3p表达,这提示肝癌中可能存在LINC00115/miR-874-3p分子轴。下调miR-874-3p表达显著减弱LINC00115低表达对肝癌细胞活力、迁移、侵袭和紫杉醇敏感性的影响,这表明下调LINC00115通过促进miR-874-3p表达来抑制肝癌细胞增殖、迁移和侵袭行为,增加其对紫杉醇的敏感性。本研究主要局限性是并未对miR-874-3p下游靶基因进行探索,这将是下一步研究的重点。
综上,肝癌中LINC00115表达上调,miR-874-3p表达下调。下调LINC00115通过促进miR-874-3p表达来抑制肝癌细胞恶性生物学行为,并提高其对紫杉醇的敏感性。因此,靶向抑制LINC00115/miR-874-3p分子轴可能是抑制肝癌进展、逆转肝癌紫杉醇耐药的潜在有效策略。
