基于分子对接和分子动态模拟探讨葛根素缓解大鼠心肌缺血再灌注损伤的作用机制*
2024-04-11张春艳曹晓璐黄瑞松李姝雅王江友
张春艳, 曹晓璐, 刘 嵩, 黄瑞松, 李姝雅, 王江友
1武汉科技大学医学院制药工艺研究所,职业危害识别与控制湖北省重点实验室,武汉 430065 2武汉科技大学附属武汉亚洲心脏病医院心内科,武汉 430022 3武汉科技大学附属武汉亚心总医院心内科,武汉 430058
急性心肌梗死是冠心病高病死率的主要原因,其治疗主要是通过溶栓、扩管等药物,以及冠状动脉介入来尽快开通闭塞血管[1]。然而大量研究表明心肌恢复血氧供应会造成周围心肌细胞进一步死亡,心肌功能损伤加重,即心肌缺血再灌注损伤[2]。目前的临床处理手段仅解决了血管病变,未考虑周围心肌损伤的修复。因此,寻找安全有效的药物,并深入解析其药理作用,对改善临床急性心肌梗死患者预后具有重要意义。
葛根素(Puerarin)是从中药葛根的干燥根中提取的异黄酮类化合物,具有抗氧化、抗炎、抗肿瘤等多种活性[3]。近年来有研究表明,葛根素具有减轻冠心病大鼠心功能障碍的作用[4],可通过抑制TRPC6-CaN-NFATc3通路改善心功能,减轻心肌重构[5],表明葛根素在治疗心血管疾病中具有积极作用。不仅如此,葛根素还可能通过调控SIRT1、核因子κB(NF-κB)等通路减轻心肌缺血介导的炎症反应[6]。但葛根素的具体药理作用靶点和机制,未见报道,还有待进一步研究。
中药因其有效性和高安全性的特点已受到越来越多关注,利用现代计算机辅助药物研发技术联合体内传统药理研究策略,可准确揭示药物具体作用靶点和作用机制[7]。因此,本研究拟通过分子对接及分子动态模拟评估葛根素缓解心肌缺血再灌注损伤的主要作用靶点,并通过整体动物实验进一步验证其作用与调控机制,以此为葛根素的临床应用提供理论依据。
1 材料和方法
1.1 分子对接
于PDB蛋白质数据库中(https://www.rcsb.org/)下载SIRT1(PDBID:4ZZI)的蛋白结构文件。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载葛根素的晶体结构文件。使用Discovery studio 2020软件处理蛋白与葛根素的结构文件。使用Autodock Vina程序进行SIRT1与葛根素的分子对接,并根据能量匹配做出评价。
1.2 分子动力学(MD)模拟
使用GROMACS 2018.8软件对SIRT1葛根素复合物进行100 ns的分子动力学模拟。在300 K的温度下使用2.0fs步长执行NVT平衡,执行时间为500 ps。在一个标准大气压下执行NPT平衡,执行时间为500 ps;使用NPT平衡之后的复合物在300 K下进行动态模拟。计算空白SIRT1蛋白与葛根素-SIRT1复合物的均方根偏差(RMSD),单端氨基酸残基的均方根波动(RMSF)轨迹及氢键变化。应用g_mmpbsa程序分析模拟平衡期间的最后5 ns的平均动态结合能。使用g_covar和g_anaeig进行主成分分析(PCA)。使用PyMOL 1.5软件进行可视化分析。
1.3 动物分组
6周龄SPF级雄性SD大鼠,体重250~280 g,购自湖北省疾病预防控制中心(编号42000600039604)。分笼饲养于标准环境中(实验动物使用许可证号:SYXK鄂2018-0045),常温、常规大鼠饲料喂养,自由饮水。利用随机数字法将SD大鼠均分为4组,每组20只。Sham组:仅打开胸腔,未结扎冠状动脉左前降支;Model组:结扎冠状动脉左前降支缺血40 min再灌注120 min;Puerarin组:腹腔注射葛根素[(纯度>98.0%)上海源叶生物科技有限公司;20 mg/(kg·d),1次/d)]连续3 d后,构建模型;EX527组:腹腔注射葛根素[20 mg/(kg·d),1次/d]连续3 d后,给予EX527(美国Selleckche公司;5 mg/kg)处理20 min后构建模型。
1.4 动物实验方法
1.4.1 2,3,5-氯化三苯基四氮唑(TTC)染色 再灌注结束后,将心脏取下冻存于-20℃约1 h。沿纵轴将心脏切成4~6片厚度均匀的切片,并将切片放入盛有1%TTC溶液(中国武汉科瑞)的12孔板中,37℃避光水浴15 min。然后放入10%多聚甲醛中室温固定2 d。将染好的心脏切片用数码相机拍照,使用Image J软件测量心肌梗死面积。心肌梗死面积百分比的计算公式为:心肌梗死面积/总面积×100%。
1.4.2 TUNEL法联合免疫荧光检测 将处理完的大鼠经左室心肌组织注入500 mL生理盐水后,再用4%多聚甲醛固定,取心脏缺血区组织行常规石蜡包埋、切片,片厚4~5μm。石蜡切片60℃烤片1 h,二甲苯脱蜡后梯度乙醇复水,Proteinase K工作液37℃恒温孵育30 min,加入TUNEL(Meilunbio)反应液,37℃孵育1 h,滴加50 μL FITC液,37℃避光孵育1 h。10%山羊血清封闭30 min,湿盒中孵育一抗(SIRT1,Bioss公司,1∶150)4℃冰箱过夜,孵育二抗(Cy3,Solarbio公司,1∶200),甘油封片。TUNEL阳性细胞呈绿色荧光,SIRT1表达呈红色荧光,激光共聚焦显微镜(奥林巴斯,FV1000)观察拍照,随机选取5个视野用于分析凋亡率及SIRT1平均荧光强度。
1.4.3 透射电镜(TEM)观察 取大鼠心脏缺血区组织(约1 mm3),用生理盐水洗涤,然后用2.5%戊二醛砷酸二甲酯钠固定液浸泡2~3 h。样品脱水后,用二甲砷酸钠缓冲液洗涤2次。用1%的四氧化锇固定后,包埋样品,制作超薄切片,然后用醋酸铀酰和柠檬酸铅双染色。最后,用透射电镜(Talos L120C,由中国科学院武汉病毒研究所分析测试中心提供)观察心肌超微结构并拍照。
1.4.4 Western blot检测 取心脏梗死区组织,提取组织总蛋白,采用BCA法进行蛋白定量分析,配制10%或12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离胶,30 μg蛋白变性后上样,电泳,电转。用5%脱脂奶粉室温封闭2 h,将脱脂奶粉洗去,分别加入一抗SCL7A11(CST公司,1∶1000)、GPX4(Boiss公司,1∶500)、IEBR2(Bioss公司,1∶1000)和β-actin(武汉博士德生物工程有限公司,1∶5000)4℃静置过夜;第二天,洗膜缓冲液洗去非特异性结合的一抗,二抗(武汉博士德生物工程有限公司,1∶5000)室温孵育2 h,洗膜缓冲液洗去非特异性结合的二抗,ECL显色,用Image J图像分析软件进行灰度值分析,以目的蛋白和β-actin的比值进行相对定量。
1.5 统计学方法

2 结果
2.1 葛根素与SIRT1蛋白的分子对接
采用分子对接实验对葛根素和SIRT1蛋白的结合潜力进行了评估。结果显示葛根素与SIRT1的结合能为-9.4 kcal/mol,表明葛根素与SIRT1蛋白具有良好的结合潜力。如图1所示,葛根素可与SIRT1蛋白的HIS-363蛋白残基形成氢键,与PHE-273、PHE-297及PHE-414蛋白残基形成Pi-Pi堆积键,说明葛根素可以与SIRT1对接,并形成稳定的复合物。
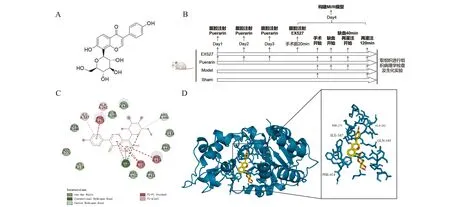
A:葛根素化学结构;B:研究过程和设计;C、D:在分子对接实验中葛根素与SIRT1相互作用的二维(C)和三维(D)图
2.2 葛根素与SIRT1的分子动力学模拟
选取分子对接结果中葛根素与SIRT1结合的最优构象进行MD模拟分析并从100 ns内每隔20 ns抽取一帧观察其结合状态(图2A)。整个过程中葛根素均未脱离蛋白活性区域,说明葛根素与SIRT1蛋白具有比较优越的结合稳定性,能够稳定结合。
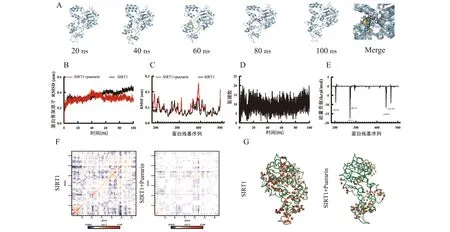
A:分子动态模拟过程中葛根素和SIRT1形成的复合物结构变化(20 ns、40 ns、60 ns、80 ns、100 ns);B:空白SIRT1蛋白与葛根素-SIRT1复合物的RMSD分析;C:空白SIRT1蛋白与葛根素-SIRT1复合物的RMSF分析;D:葛根素-SIRT1复合物在模拟期间的氢键变化分析;E:葛根素-SIRT1复合物残基结合能量贡献分析;F~G:空白SIRT1蛋白和葛根素-SIRT1复合物的PCA分析
为了更好地分析葛根素与SIRT1蛋白的结合稳定性,对SIRT1-葛根素复合物的骨架原子的RSMD与空白SIRT1蛋白进行了比较(图2B)。葛根素-SIRT1复合物的RMSD值为(0.3221±0.0380)nm。空白SIRT1蛋白的RMSD值为(0.3631±0.0549)nm。在相同的模拟条件下,SIRT1-葛根素复合物的迁移率相较于空白SIRT1受体更低,表明葛根素与SIRT1蛋白结合稳定。
SIRT1-葛根素复合物与空白SIRT1的RMSF对比分析结果(图2C)发现,相较于SIRT1受体,SIRT1-葛根素复合物在GLY-319~GLN-322间表现出单峰波动;CYS-398~PRO-403区域出现较大波动。但在活性位点区域没有观察到大的构象波动,SIRT1与葛根素的结合较为稳定。这些差异可能与蛋白质的体积和结合能力的差异有关。
通过葛根素和SIRT1之间在模拟期间的氢键变化(图2D)发现,葛根素与SIRT1显示出持续稳定的氢键相互作用,最高达到20个氢键相互作用。这些结果表明,葛根素与SIRT1的分子间氢键相互作用非常稳定且连续。
本研究结合上述结果分析模拟平衡期间的最后5 ns的平均动态结合能(图2E)。SIRT1与葛根素的总结合能为-(65.67 ± 3.17) kcal /mol,SIRT1中的残基ASP204、ASP-272、ARG-274、LYS-444和GLU-467贡献了主要的结合能(<-5.0 kcal/mol),这与分子对接实验的结果一致。
主成分分析(PCA)有助于分析动态轨迹中最重要的运动模式,是分析蛋白质动力学行为的一种有效方法。为了深入研究葛根素与SIRT1蛋白结合后,其运动方向和运动模式发生如何变化,我们提取MD轨迹中每个α-碳原子的主要运动轨迹。图2F为空白SIRT1蛋白与SIRT1-葛根素复合物在模拟过程中蛋白α-碳原子的协方差矩阵分析,结果表明在与葛根素结合后SIRT1蛋白中的α-碳原子运动幅度显著降低,特别是MET-193~GLY-195,GLU-208~THR-209,VAL-285~PRO-288,ARG-397~ASP-401,ALA-425~ASP-429残基中的α-碳原子运动幅度降低最为显著;同时蛋白活性区域中的ALA-262、ILE-270、ASP-272、PHE-273、PHE-297、ASN-346、ILE-347、HIS-363、PHE-413、PHE-414、LEU-418、VAL-445、ARG-446、PRO-447残基α-碳原子运动皆出现了明显降低。图2G为空白SIRT1蛋白与SIRT1-葛根素复合物在模拟过程中的α-碳原子运动趋势对比。如图所示,空白SIRT1蛋白中的α-碳原子运动方向杂乱无序,整体趋于膨胀;与葛根素结合后,SIRT1蛋白α-碳原子的运动整体呈现出收缩趋势,蛋白的活性区域变得更加稳定,这可能与葛根素和SIRT1之间的氢键作用有关。
2.3 葛根素通过调控SIRT1蛋白缓解心肌缺血再灌注损伤
在心肌缺血再灌注损伤大鼠体内给予葛根素处理,并进一步使用EX527干预抑制SIRT1表达。通过TTC染色发现(图3A、3B),模型构建明显增加大鼠心肌梗死面积;与模型组对比,葛根素治疗组的心肌梗死面积显著减小;与单纯葛根素治疗组相比,EX527干预后心肌梗死面积再次升高。通过TUNEL联合免疫荧光检测发现(图3C~3E),相比假手术组,模型组大鼠心肌细胞凋亡率明显上升,且SIRT1的表达下降;与模型组对比,葛根素治疗组的心肌细胞凋亡率显著降低,SIRT1的表达量增加;而EX527干预后SIRT1表达被抑制且心肌细胞凋亡率再次升高。说明葛根素具有缓解心肌缺血再灌注损伤的作用,且这一作用是通过作用于SIRT1实现的。
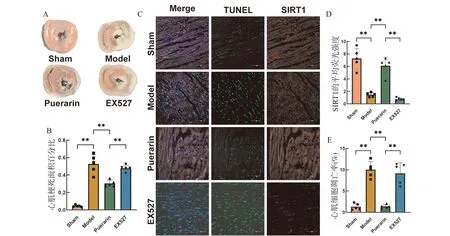
A:大鼠心肌TTC染色;B:心肌梗死面积百分比分析;C:TUNEL和免疫荧光检测SIRT1;D:SIRT1蛋白平均荧光强度分析;E:心肌细胞凋亡率分析;**P<0.01;n=5
2.4 葛根素通过SIRT1调节铁死亡改善心肌缺血再灌注的超微结构损伤
透射电镜发现(图4A~4C),模型组的心肌纤维断裂,结构异常,线粒体嵴坍塌,形态模糊,线粒体评分降低;与模型组对比,葛根素治疗组的心肌纤维结构完整,线粒体嵴结构清晰,线粒体评分显著上升;与葛根素治疗组相比,EX527干预后心肌纤维超微结构和线粒体损伤增加。通过Western blot技术检测铁死亡相关通路蛋白表达(图4D~4G)发现,相比假手术组,模型组SLC7A11、GPX4蛋白的表达明显下降,IREB2的蛋白表达明显上升。与模型组对比,葛根素治疗组SCL7A11、GPX4的表达显著增加,IREB2的表达显著下降。与葛根素治疗组对比,EX527干预后SLC7A11、GPX4蛋白表达量下降,IREB2的表达明显上升。说明葛根素能够通过激活SIRT1蛋白抑制铁死亡发生,改善心肌缺血再灌注引起的心肌超微结构损伤性改变。
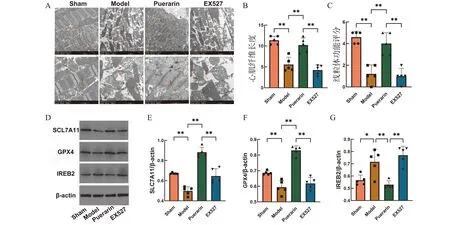
A:透射电镜观察大鼠心肌超微结构;B:心肌纤维长度分析;C:心肌细胞线粒体评分;D~G:Western blot检测铁死亡相关蛋白的表达;*P<0.05,**P<0.01;n=5
3 讨论
天然药物安全性高,但由于作用机制不明确使得其在药物研发和临床应用过程中受到一定的阻碍[8-9]。天然药物药理研究需要确定药物作用靶点并揭示其可能调控的机制,如果使用文献参考、蛋白检测或高通量测序等传统方法对可能的靶标进行一一筛选,费时、费力、耗费高[10]。随着结构生物学的迅速发展,采用分子对接及分子动态模拟等先进计算机虚拟筛选技术,可高效、精准、经济地评估药物与潜在靶点的作用潜力,大大加快了天然产物活性成分筛选工作[7,11]。分子对接可预测分子与靶点的结合潜力,从而为药物设计和药物筛选提供指导。对筛选结果的分子动力学模拟有助于我们进一步揭示受体与蛋白质相互作用的机制,提高虚拟筛选的可靠性[12]。此外,通过化合物与某些疾病的关键蛋白质计算机预测结果,可以为我们进一步的实验指明方向,更好地揭示化合物的药理机制。
葛根素作为葛根主要活性成分,已被证实对心肌损伤具有一定的修复作用,可调节心肌缺血再灌注后心肌酶学指标,并减少心肌梗死面积[13],这一点与我们的研究结果一致。我们的研究不仅证实了葛根素能够减少心肌梗死面积,同时还明确了葛根素可显著减少梗死区心肌细胞的凋亡,有效抑制心肌的损伤。在明确葛根素抗心肌缺血再灌注损伤药效的基础上,揭示分子机制的过程具有关键作用。虽然有少量研究发现葛根素通过调控组蛋白乙酰化酶、抑制炎症因子等达到缓解心肌缺血损伤的作用[14],但无进一步的研究证实葛根素的具体作用靶点。
SIRT1是一种依赖烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白/非组蛋白去乙酰化酶[15],参与机体多种生理调控、代谢[16-18]。已有研究证实葛根素可影响SIRT1的表达活性,调控NF-κB/含pyrin结构域NOD样受体家族3(NLRP3)炎症通路、降低叉头状转录因子O亚型1(FOXO1)乙酰化水平,从而缓解心肌缺血再灌注损伤[6,19],说明SIRT1可能是葛根素发挥保护心肌作用的关键靶点。为确定这一问题,本研究利用计算机预测模型,重点关注葛根素和SIRT1蛋白的对接能力,并通过分子动态学模拟揭示了葛根素与SIRT1的相互作用。不仅如此,动物水平的研究也验证了葛根素在抗心肌缺血再灌注损伤的过程中具有调控SIRT1蛋白表达的能力。一旦SIRT1表达被抑制,葛根素的药理作用就会明显降低,以此初步确定了葛根素的潜在作用靶点为SIRT1。
研究证明SIRT1能够通过调节铁代谢相关基因,影响细胞内铁离子的平衡[20]。如:SIRT1可抑制铁转运蛋白的表达,减少细胞内铁离子的摄取和积累,从而降低铁死亡的发生[21]。在心肌损伤发生过程中,炎症小体NLRP3可促进心肌铁死亡的发生[22-23],下调Toll样受体4(TLR4)/NF-κB炎症通路活性可抑制铁死亡[24],提示铁死亡与心肌组织的炎症反应有直接作用关系。由于葛根素可通过SIRT1抑制心肌缺血再灌注介导的炎症反应[6],那么葛根素是否能通过调控铁死亡抑制心肌缺血再灌注损伤,且这一作用是否是通过作用于SIRT1实现的?因此,为了系统揭示葛根素的调控机制,本研究在验证上述计算机预测结果的基础上,进一步在体内实验中对比SIRT1表达被抑制前后,葛根素抗心肌缺血损伤以及调控下游铁死亡相关蛋白表达的变化,以此证明葛根素药理活性与SIRT1活性密切相关。
线粒体作为细胞能量厂影响细胞氧化磷酸化并提供腺嘌呤核苷三磷酸(ATP)[25-26],并同时参与多种细胞死亡类型,包括:凋亡、焦亡和铁死亡等[27]。由于机体损伤导致线粒体形态发生变化,使其嵴增大、外膜破裂,异常线粒体结构功能障碍增加了细胞铁死亡易感性[28-29]。本研究在透射电镜下观察到心肌缺血再灌注损伤过程中,大鼠心肌缺血组织中不仅心肌纤维结构异常改变,线粒体超微结构也发生严重损伤,提示心肌缺血损伤会引发铁死亡的发生,这一结果与以往的研究是一致的。葛根素抗心肌细胞凋亡同时,伴随着心肌纤维和线粒体结构恢复至正常水平,这就说明葛根素可能就是通过调控铁死亡抑制心肌缺血再灌注损伤的。而EX527作为SIRT1特异性蛋白表达抑制剂,其干预结果也进一步体现了SIRT1活性水平在葛根素调控铁死亡影响心肌缺血损伤中的重要性。
基于此,本研究也重点关注了SIRT1表达被抑制前后,葛根素对心肌缺血区铁死亡关键蛋白表达的影响变化,发现葛根素可增加缺血区SCL7A11、GPX4的蛋白表达,降低IREB2的蛋白表达;且葛根素的这一作用在SIRT1活性被抑制后则降低。现有研究证实,SLC7A11与其亚基溶质载体家族3成员2(SLC3A2)形成系统Xc-(xCT),吸收胞外胱氨酸交换细胞内谷氨酸,入胞的胱氨酸最终合成谷胱甘肽(GSH),GPX4将GSH氧化成氧化型谷胱甘肽,抑制脂质过氧化物进而抑制铁死亡[30-32]。另一方面,IREB2作为细胞铁死亡的关键因素之一,通过与内部核糖体进入位点(IREs)结合来响应细胞内铁水平变化,IREB2的上调可以阻止转铁蛋白受体(Tfr)的降解,增加细胞内铁含量[33-34]。本研究证实葛根素逆转了心肌缺血介导的铁死亡蛋白的异常表达,并与SIRT1的活性息息相关。
综上所述,本研究利用计算机分子对接和动态模拟揭示了葛根素与SIRT1蛋白相互作用的潜在能力,并联合整体动物水平实验揭示了葛根素缓解心肌缺血再灌注损伤介导的铁死亡与SITR1活性的相关性。不仅为中药药理研究和药物研发提供了新思路,同时为临床应用葛根素作为心肌保护剂提供了理论依据。
