丙泊酚调节MPP+诱导的SH-SY5Y 细胞线粒体氧化应激和凋亡
2024-04-11秦海燕苏彦伊王英宝
谭 莹 ,秦海燕 ,孙 翔 ,苏彦伊 ,王英宝
(1)昆明医科大学第一附属医院麻醉科,云南 昆明 650032;2)昆明市延安医院泌尿外科,云南 昆明 650051)
帕金森(Parkinson's disease,PD)是α-突触核蛋白聚集介导的黑质致密性多巴胺能神经元丢失的神经退行性疾病,可导致运动和非运动症状,运动症状的特征是运动障碍,包括运动迟缓、静止性震颤和肌肉强直,非运动症状包括认知障碍、抑郁、焦虑、嗅觉和味觉减退以及睡眠障碍等[1]。流行病学研究显示,60 岁以上人群的PD 发病率增加,80 岁以上人群的发病率达3%,且男性的PD 发病率高于女性[2]。随着人口老龄化的加重,全球范围内PD 的发病率也在逐渐升高。然而,目前尚没有治愈PD 的有效方法。
氧化应激诱导的稳态失衡是多种神经退行性疾病的常见特征。一般认为氧化应激主要由活性氧(reactive oxygen species,ROS)、活性氮等强氧化性自由基引起。ROS 主要在线粒体中产生,ROS 增多可能会使细胞的氧化还原平衡转向氧化状态,促进细胞的氧化应激水平,使线粒体中的大分子受到氧化损伤,损伤大分子的积聚进一步导致细胞的基本功能受损并激活细胞死亡途径,最终引起细胞死亡。临床研究表明,PD 患者氧化应激水平升高[3]。因此,抑制氧化应激水平可能是PD 治疗的关键途径。
丙泊酚(propofol,PPF)是临床常用的全身静脉麻醉剂,具有抗氧化活性。研究发现,PPF 刺激可减少PD 大鼠大脑中的氧化应激,具有氧化损伤的神经保护作用[4]。本研究通过MPP+诱导PD 细胞模型,探讨不同浓度的PPF 预处理对PD模型细胞氧化应激的作用。
1 材料与方法
1.1 主要试剂
细胞完全培养基购自南京科佰生物科技有限公司。1 mM MPP+购自美国Sigma-Aldrich。PPF购自美国Merck。CCK-8 试剂盒、H2DCF-DA 荧光探购自美国MedChemExpress。MDA 和NADPH氧化酶测定试剂盒购自南京建成。细胞质蛋白提取试剂盒购自上海泽叶生物,线粒体蛋白提取试剂盒购自北京百奥莱博。兔抗细胞色素c、GAPDH、Bcl-2、Bax 抗体、山羊抗兔二抗购自北京博奥森。兔抗COX4 和Cleaved caspase-3 抗体购自Abcam。Annexin V-FITC/PI 试剂盒购自美仑生物。
1.2 细胞及细胞培养
人神经母细胞瘤细胞SH-SY5Y 购自南京科佰。细胞培养于细胞完全培养基(含1%非必需氨基酸、1 mM 丙酮酸钠以及10%胎牛血清),放入5% CO2细胞培养箱培养,每2 d 更换一次新鲜培养液。
1.3 细胞处理
状态良好的SH-SY5Y 细胞,经消化后接种至新的培养板,将1mM MPP+加至培养液中,轻轻摇匀。将培养板放入细胞培养箱,培养24 h 以诱导PD 细胞模型。
MPP++10 µM PPF 组、MPP++20 µM PPF 组、MPP++40 µM PPF 组、MPP++80 µM PPF 组SHSY5Y 细胞在经MPP+处理前,分别培养于含10、20、40、80 µM PPF 的培养基内4 h。弃去培养液,再将细胞转移至含1 mM MPP+的培养基中培养24 h。NC 组细胞常规培养,不进行MPP+和PPF 处理。
1.4 CCK-8 检测细胞增殖
处理完成的各组细胞接种至96 孔板,置于细胞培养箱过夜培养,向每孔中加入含10 µL 的CCK-8 溶液100 µL,37 ℃孵育2 h,酶标仪测定吸光度值(450 nm)。
1.5 ROS 水平
H2DCF-DA 荧光探针用于检测SH-SY5Y 细胞中ROS 的水平。经MPP+或PPF 处理后的细胞,用PBS 漂洗2 次,加入含20 µM H2DCF-DA 的PBS 与细胞37 ℃避光孵育30 min。洗涤后,利用流式细胞仪检测荧光强度。
1.6 MDA 和NADPH 氧化酶活性检测
MDA 和NADPH 氧化酶检测试剂盒用于检测SH-SY5Y 细胞中MDA 和NADPH 氧化酶水平。
MDA:根据试剂盒说明书,配置MDA 的三号试剂并用50%冰醋酸按2∶1 稀释。各组中的细胞经超速离心使其破裂,使用前摇匀。分别向离心管中加入等量的待测样品和试剂一、1.5 mL 试剂二、1.5 mL 试剂三,混匀后95 ℃水浴40 min,冷却后4 000 r/min,离心10 min,取上清测定吸光度值。
NADPH 氧化酶:试剂盒中的试剂一和三用于裂解细胞,离心后取上清。再用10 000 r/min,离心10 min,下层沉淀中加入试剂二和试剂三,利用超声波处理90 s(每超声3s 间隔10 s)。取40 µL样本中分别试剂四(700 µL)、五(100 µL)、六(160 µL),混匀。分光光度计检测600 nm 处20 s(A1)和80 s(A2)的吸光度值。ΔA=A1-A2。
1.7 Western blot 检测细胞色素c 以及Bcl-2、Bax 和Cleaved caspase-3 蛋白表达
收集对照组、MPP+以及MPP+和PPF 处理后的SH-SY5Y 细胞,分别利用细胞质蛋白和线粒体蛋白提取试剂盒提取细胞质和线粒体中的蛋白。采用聚丙烯酰氨凝胶电泳法将蛋白样品按分子量分离并转移至PVDF 中。转移后的蛋白与5%脱脂牛奶在室温中封闭2 h,漂洗后与一抗(兔抗细胞色素c 抗体1∶1 000,兔抗GAPDH 抗体1∶10 000,兔抗COX4 1 µg/mL,兔抗Bcl-2 1∶1 000,兔抗Bax 1∶1 000,1∶兔抗Cleaved caspase-3 1∶500)在4 ℃条件中孵育过夜,洗涤,再分别与山羊抗兔二抗室温孵育2 h。增强化学发光试剂处理后,凝胶成像仪显影。GAPDH 作为细胞质及全细胞蛋白检测的内参,COX4 作为线粒体蛋白检测内参。Image J 软件分析目的蛋白。
1.8 流式细胞术检测细胞凋亡率
利用Annexin V-FITC/PI 试剂盒检测凋亡率。收集处理后的各组细胞,室温中用Annexin VFITC 染色10 min,洗涤后用PI 试剂染色10 min。流式细胞仪分析凋亡细胞比例。
1.9 统计学处理
所有数据均表示为“均数±标准差”。独立样本t检验分析2 组间差异。单因素方差分析多组间差异,Tukey's 事后检验用于多组间的进一步两两比较。P<0.05 认为差异存在统计学意义。所有数据分析和绘图利用GraphPad Prism 8.0 完成。
2 结果
2.1 MPP+诱导对SH-SY5Y 细胞线粒体氧化应激的作用
通过MPP+刺激SH-SY5Y 细胞构建PD 细胞模型,实验检测发现,相比NC 组,MPP+诱导组中细胞增殖活力降低,见图1A,差异有统计学意义(P<0.001)。H2DCF-DA 荧光探针检测结果显示,MPP+作用增加SH-SY5Y 细胞中ROS 水平(P<0.001,图1B 和图1C)。试剂盒检测结果见图1D和图1E,MPP+诱导组中MDA(P<0.001,图1D)和NADPH 氧化酶活性(P<0.01,图1E)高于NC 组。对细胞质和线粒体中细胞色素c 检测发现(图2A),与NC 组相比,MPP+诱导组SH-SY5Y细胞线粒体中细胞色素c 表达降低(P<0.001,图2B),细胞质中细胞色素c 表达升高(P<0.01,图2B)。双染法流式细胞术结果表明,MPP+刺激组中SH-SY5Y 细胞凋亡率高于NC 组(P<0.001,图2C 和D)。凋亡相关蛋白表达表明,Bcl-2 在MPP+处理组中表达降低(P<0.01,图2E 和F),MPP+处理组中Bax 和Cleaved caspase-3 表达高于对照组(P<0.01)。由此可知,MPP+诱导抑制SH-SY5Y 细胞增殖,诱导细胞氧化应激和凋亡。
2.2 PPF 对MPP+诱导的SH-SY5Y 细胞线粒体氧化应激和凋亡的作用
有研究表明,PPF 可抑制大脑中的氧化应激水平,对氧化损伤的神经具有保护作用[4]。但其对MPP+刺激引起的细胞氧化应激的作用尚不清楚。利用不同浓度的PPF 分别刺激SH-SY5Y 细胞,探讨其对细胞线粒体氧化应激的作用。对细胞增殖活力检测发现,与MPP+组相比,PPF 处理促进细胞的增殖活力(P<0.001),且随着PPF浓度的增加,细胞的增殖活力增加,其中40 µM和80 µM PPF 处理对细胞增殖活力没有明显差异,见图3A。流式细胞术检测H2DCF-DA 探针荧光强度,结果见图3B、图3C,PPF 处理组中ROS浓度降低,20 µM、40 µM 和80 µM 组与未经PPF处理组相比差异有统计学意义(P<0.001)。对MDA 和NAGPH 氧化酶水平检测发现,随着刺激细胞的PPF 浓度增加,细胞中MDA(P<0.001),见图3D 和NADPH 氧化酶(P<0.001,图3E)的水平逐渐降低,40 µM 和80 µM PPF 处理组中MDA 和NADPH 氧化酶浓度差异无统计学意义(P>0.05)。

图3 PPF 调控MPP+诱导的SH-SY5Y 细胞线粒体氧化应激Fig.3 PPF regulated MPP+-induced mitochondrial oxidative stress in SH-SY5Y cells
随后,通过Western blot 检测SH-SY5Y 细胞线粒体和细胞质中细胞色素c 的蛋白表达,见图4A,相比较于MPP+组,PPF 刺激促进线粒体中细胞色素c 的蛋白表达(P<0.001),见图4B,降低细胞色素c 在细胞质中的水平(P<0.001),见图4B。对细胞凋亡率检测发现,PPF 预处理可减少MPP+诱导的细胞凋亡,且40 µM 和80 µM PPF 刺激组细胞的凋亡率与MPP+组相比差异有统计学意义(P<0.001),见图4C 和图4D。Western blot结果显示,Bcl-2 相对表达随PPF 的浓度升高而升 高(P<0.001,图4E 和F),Bax 和Cleaved caspase-3 表达随PPF 的浓度升高降低,且在40µM 和80 µM PPF 组 中Bcl-2、Bax 和Cleaved caspase-3 相对表达与对照组相比差异有统计学意义(P<0.001)。由此表明,PPF 通过抑制SHSY5Y 细胞线粒体氧化应激和凋亡,降低MPP+诱导的神经毒性。
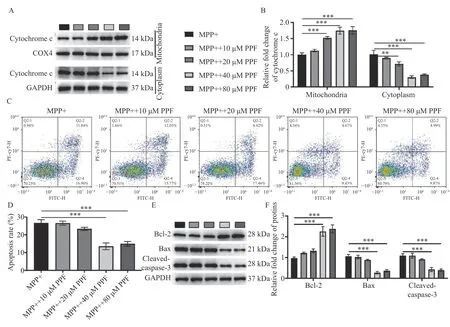
图4 PPF 调控MPP+诱导的SH-SY5Y 细胞中细胞色素c 和细胞凋亡Fig.4 PPF regulated MPP+-induced cytochrome c and cell apoptosis in SH-SY5Y cells
3 讨论
PD 是一种进行性、年龄依赖性神经退行性疾病。由于全球人口预期寿命的延长,PD 患者的数量将随老龄化进一步增加,给经济和医疗保健系统增加很大的负担[5]。因此,了解疾病的发病机制对寻找PD 的有效治疗方法至关重要。
3.1 诱导PD 细胞模型的常见试剂
笔者的研究表明,MPP+诱导可抑制SHSY5Y 细胞的增殖,促进细胞的氧化应激并诱导细胞凋亡。此外,还可通过6-羟基多巴胺(6-hydroxydopamine,6-OHDA)、1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)、百草枯、鱼藤酮等神经毒素诱导PD 细胞模型。Alarcon-Gil 等[6]利用35 µM 6-OHDA 处理的SH-SY5Y 细胞存活率明显降低,凋亡率增加。Yao 等[7]通过2 500 µM MPTP诱导PC12 细胞构建PD 模型,诱导后的细胞存活率降低、凋亡增加、线粒体膜电位降低、ROS 水平增加。300 µM/mL 的百草枯诱导SH-SY5Y 细胞可抑制细胞活力、促进细胞凋亡和ROS 积累[8]。Han 等[9]利用鱼藤酮诱导SH-SY5Y 细胞,发现1~200 µM 鱼藤酮可降低细胞活力并促进细胞凋亡。
3.2 氧化应激与PD
氧化应激在PD 的发生和发展中发挥主导作用。目前,已经有大量研究表明抑制氧化应激可缓解PD。过表达miR-375 可通过抑制SP1,改善PD 大鼠的神经炎症和氧化应激,促进大鼠纹状体中的多巴胺含量并减轻神经元凋亡[10]。恩格列净可以缓解鱼藤酮诱导的PD 大鼠内质网应激并增强自噬[11]。抗组胺药依巴斯汀可通过下调PD 模型小鼠的氧化应激、组胺和炎症水平,减轻PD 症状[12]。注射硒纳米颗粒至PD 大鼠可减轻氧化应激,降低MDA 水平[13]。白藜芦醇可充当抗氧化剂,提高内源性抗氧化状态、清除ROS,从而减少PD 的氧化应激[14]。笔者的研究发现,PPF 预处理可减轻MPP+诱导对HY-SY5Y 细胞增殖的抑制作用,降低细胞中ROS、MDA 以及NADPH 水平,减少细胞凋亡。
3.3 PPF 与氧化损伤
PPF 是常见的静脉镇静药物,具有起效快、消除快、作用持续时间短、麻醉恢复快、不良反应发生率低、无致畸和致突变作用等特点,是临床上广泛使用的静脉镇静剂。研究发现,PPF 具有抗氧化特性,可通过降低氧化应激对脑缺血再灌注损伤[15]、心肌梗死[16]、PD 大鼠[4]等氧化损伤起保护作用。在心肌缺血再灌注损伤中,PPF可减轻异丙肾上腺素诱导的氧化损伤、炎症反应和心肌细胞凋亡[16]。PPF 通过减少促炎细胞因子的分泌、乙酰胆碱酯酶活性以及氧化应激水平,保护大鼠脑室内链脲佐菌素诱导的认知功能障碍和神经元损伤[17]。在顺铂诱导的周围神经病变大鼠中,PPF 可增加内源性抗氧化剂,减少脂质过氧化以及炎症水平,对顺铂诱导的神经毒性发挥保护作用[18]。笔者发现40 µM 和80 µM PPF 预处理后,MPP+诱导的SH-SY5Y 细胞增殖活性相比于对照组增加,氧化应激水平和凋亡率明显降低,表明PPF 可能通过抑制氧化应激对PD 模型细胞具有保护作用。同时,Wang 等[19]也表明,PPF可缓解MPP+诱导的神经毒性。高青等[20]发现,PPF 可通过激活Nrf2 抑制RAGE/NF-κB 信号通路,抑制PD 大鼠脑黑质区的神经炎性因子,改善大鼠认知障碍。对于需要全身麻醉的PD 患者,具有神经保护及抗氧化作用的PPF 对需要全身麻醉的PD 患者具有良好优势。然而,PPF 对PD 中氧化应激的具体调节机制需要在未来的研究中进一步探索。
综上所述,MPP+刺激可抑制SH-SY5Y 细胞的增殖、诱导氧化应激和细胞凋亡。PPF 预处理可明显缓解细胞的氧化应激和凋亡,对MPP+处理的细胞具有保护作用。
