稳定表达ATP5a 细胞系的建立
2024-04-11闫浩鑫李明蔚郭龙军
闫浩鑫,李明蔚,吴 洋,郭龙军★,冯 力,★
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163000;2.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069)
线粒体ATP 合酶是一种位于线粒体膜内的多亚基酶复合物,是生理条件下氧化磷酸化所必需的。ATP 合酶由两部分组成:F1 的水溶性蛋白质复合物和疏水部分F0。F1 由3 种α 亚基和3 种β亚基交替排列,组成六聚环状定子。F0 部分由a、b2、c10~15 等3 种亚基组成。其中F1 部分的α 亚基由ATP5a(55kd)编码,ATP5a 在癌症的发生发展中发挥重要功能,例如ATP5a 在结肠癌的细胞增殖中起促进作用,以及其与前列腺癌发展之间存在相互关联。ATP5a 的表达失调在已在几种恶性肿瘤中报道,但它在不同的癌症类型中显示出致癌或肿瘤抑制作用。但与病毒之间的关系尚不明确,有研究发现猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)编码的E 蛋白可以通过抑制ATP5a 诱导细胞凋亡,从而促进病毒的复制。另有研究表明,ATP5a 与轮状病毒(Rotavirus,RV)的3'UTR 具有高亲和力。ATP5a 的基因缺失减少了感染性病毒子代的产生,并在RV 基因组组装和颗粒形成中起一定的作用。
虽然ATP5a 参与了许多癌变与病毒感染过程,但该蛋白的生物学功能尚不清楚。为进一步研究ATP5a 的功能,构建一个稳定的、可表达ATP5a 的细胞系,将有助于相关研究领域的发展。本研究将ATP5a 克隆到修饰过的PLVX-IRES-ZsGreen1 载体上,建立了稳定表达ATP5F1A 的细胞系。我们通过Western Blotting 验证ATP5a 细胞系的稳定表达。
1 材料与方法
1.1 细胞与质粒 293T 细胞和IPI-2I 细胞保存于本实验室,DH5α 感受态和慢病毒载体pLVX-IRES-ZsGreen1 及相应的辅助质粒PSPAI2、PMG 2.0 保存于本实验室。
1.2 试 剂 T4 连接酶、PCR 酶、限制性内切酶购自NEB 公司和Thermos Scientific 公司;KOD NEO高保真DNA 聚合酶购自TOYOBO 公司;PCR 清洁试剂盒、DNA 胶回收试剂盒、质粒提取试剂盒购于Axygen 有限公司;DMEM 培养基购自Gibico 公司;胎牛血清购自内蒙古奥普赛生物科技有限公司;转染试剂购自Roche 公司;anti-HA tag(1∶10000)以及anti-β-actin(1∶3000)购自Sigma 公司;羊抗鼠IgG(H&L)-Dy680(1∶10000)购自LI-COR 公司。
1.3 ATP5a 引物设计 根据GenBank 网站中的上huATP5aCDS 区序列(NG_041769.2),使用软件SnapGene4.1.9 设计一对扩增ATP5a 的特异性引物,引物序列(见表1)。

表1 引物序列
1.4 慢病毒表达质粒的构建 以本实验室保存的PCAGGS-ATP5a 质粒作为模板,以Ecor1-F 和Xbal-R 为引物。进行人ATP5a 基因的扩增。获得PCR 产物经1%琼脂糖凝胶电泳,使用PCR 清洁试剂盒去除杂质,将ATP5a 片段与PLV-IRES-Zs-Green1 载体均使用Ecor1 和Xbal 双酶切,条件为37 ℃,酶切1 h。酶切完毕后将酶切产物进行琼脂糖凝胶电泳并利用凝胶回收试剂盒回收酶切产物。使用T4 连接酶体系16 ℃过夜连接。次日连接产物用DH5α 感受态进行转化,经由菌落PCR 鉴定后测序。将测序正确的质粒命名为PLV-IRES-Zs-Green1-ATP5a 并保存于-20 ℃冰箱中。
1.5 慢病毒的包装 使用去除内毒素质粒提取试剂盒提取慢病毒表达质粒pLVX-IRES-Zs-Green1-ATP5a,并与辅助质粒PSPAI2 和辅助质粒PMG2.0 组成三质粒慢病毒包被体系pLVX-IRES-Z sGreen1-ATP5a、PSPAI2 和PMG2.0 质量比为3:2:1,用Roche 转染试剂共转HEK-293T 细胞中,48h后在倒置荧光显微镜下观察荧光情况,收取上清培养基,过0.45 μm 滤膜。收集病毒,测定重组慢病毒滴度,并分装于-80 ℃保存。
将IPI-2I 细胞平铺于100 mm 培养皿中,待细胞密度达至70%~90%时。接种重组慢病毒3 mL,并加入6 μL 的Polybrene,充分混匀后在37 ℃细胞箱敷育1 h。补充培养液至10 mL。36 h 后在荧光倒置显微镜下观察细胞的荧光情况,利用流式细胞术筛选表达绿色荧光的IPI-2I 细胞,经由培养传代后可得到稳定表达ATP5a 的IPI-2I 细胞系。
1.6 Western Blotting 选取培养传代后得到得IPI-FX/ATP5F1A 细胞,收集细胞沉淀,加入含有PMSF 的RIPA 细胞裂解液,冰上裂解30 min,离心收集上清加入5×上样缓冲液,沸水浴10 min,上样(浓缩胶80 V,分离胶120 V),将凝胶转移至NC膜,冰浴恒流200 mA 90 min,提前配制封闭液(一直用的4% TBST 配制的脱脂奶粉),将膜放入含有5%脱脂乳的封闭液中室温孵育1 h,弃去封闭液,PBST 洗2 次,加入5%BSA 稀释的一抗4 ℃过夜孵育,次日,PBST 洗膜3 次×5 min,加入稀释好的二抗,室温孵育45 min,利用显色。
2 结果
2.1 ATP5a 扩增产物的鉴定以及双酶切鉴定 目的基因经1%琼脂糖凝胶电泳分析,可见1528bp 的特异性目的条带,与预期结果一致,见图1a。重组慢病毒表达质粒经ECORI 和Xbal 双酶切,通过1%琼脂糖凝胶电泳分析,可见1528bp 的特异性目的条带,与预期结果一致,见图1b,表明ATP5a 基因成功插入慢病毒基因组内。
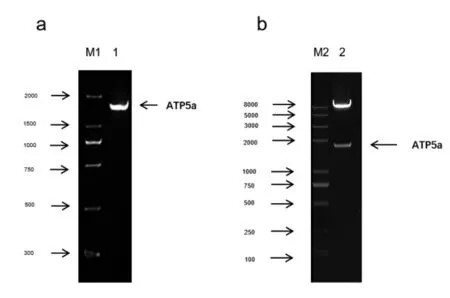
图1 PCR 扩增产物及酶切鉴定
2.2 重组慢病毒表达质粒的表达 将感染慢病毒的293T 细胞在显微镜下观察荧光,收集沉淀通过Western blotting 检测ATP5a 的表达,与对照相比,转染细胞组在55KD 出现特异性目的条带,重组质粒成功表达(见图2)。
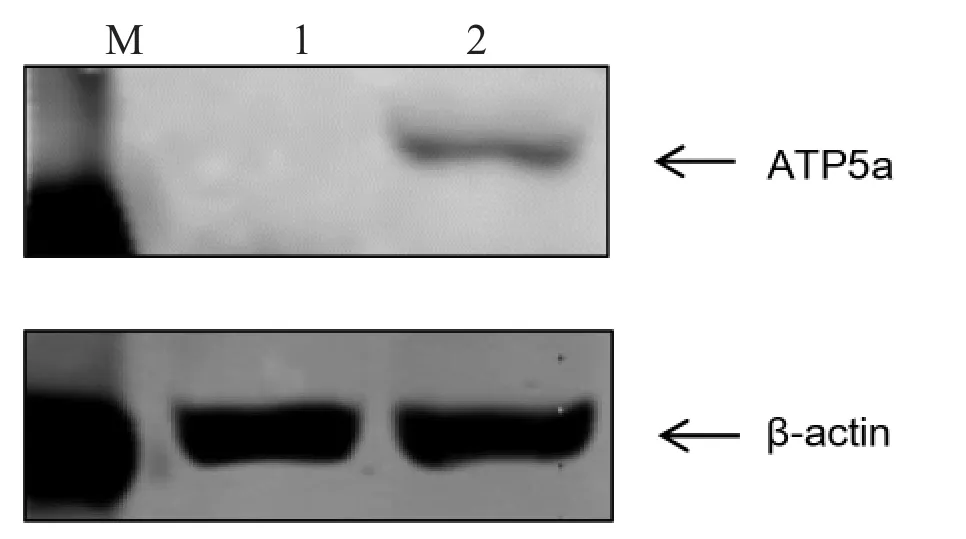
图2 293T 细胞Western Blot 分析
2.3 ATP5a 过表达IPI-2I 细胞中ATP5a 荧光观察 将感染重组慢病毒的IPI-2I 细胞显微镜下观察荧光,结果显示,与对照IPI-2I 细胞相比,IPI-2I-ATP5a 细胞中的绿色荧光明显增多(见图3),表明IPI-2I-ATP5a 细胞系构建成功。

图3 IPI-2I 细胞的荧光图像
2.4 流式细胞术鉴定IPI-2I-ATP5a 细胞系 将感染重组慢病毒的IPI-2I 细胞和对照细胞通过流式分选,结果显示,与对照IPI-2I 细胞相比,获得更多的IPI-2I-ATP5a 细胞(见图4),表明IPI-2I-ATP5a细胞系构建成功。
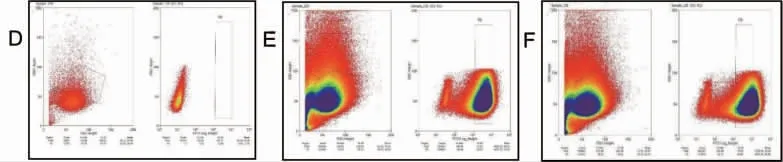
图4 IPI-2I 细胞流式细胞术筛选
2.5 IPI-2I-ATP5a 细胞中ATP5a 的检测结果 收集IPI-2I-ATP5a 和IPI-2I-PLVX 细胞沉淀,通过western blotting 检测ATP5a 的表达,与对照相比,IPI-2I-ATP5a 细胞组在55KD 出现特异性目的条带,表明IPI-2I-ATP5a 细胞系构建成功(见图5)。

图5 IPI-FX/ATP5F1A western blot 分析
3 讨论
慢病毒最早可追溯至1989 年开发的一种可携带外源目的基因的复制型慢病毒,由于初代慢病毒来自于HIV 病毒因而具有高突变率具有安全隐患。因此为了提高慢病毒的安全性开发了第一代至第四代慢病毒载体系统,第一代系统采取三质粒系统包含包装质粒、包膜蛋白质粒、穿梭质粒组成。以后的三代都是在一代的载体系统上优化而来。其中我们选取的PLVX-IRES-ZsGreen1 也安全的应用在其他的慢病毒包装体系。
ATP 合酶是几乎所有真核生物和原核生物中主要的能量生产酶,近年来对ATP 合酶的不断研究。其中ATP5a 是ATP 合酶重要的组成部分,ATP5a 与PRRSV 病毒的Gp5 蛋白之间存在相互作用,Gp5 可能与PSSRV E 蛋白共同作用ATP5a 来感染宿主。在细胞系研究中,科学家通常会使用基因编辑技术如CRISPR/Cas9 来改变ATP5a 基因的表达水平,以观察细胞内能量代谢的变化。这样的研究有助于揭示ATP5a 基因的功能和调控机制,在细胞生物学和医学研究领域具有重要意义。此外,ATP5a 细胞系还可以应用于药物筛选和治疗方法的研究。通过研究ATP5a 基因的功能和与之相关的信号通路,科学家可以发现新的药物靶点,为相关疾病的治疗提供新途径。
稳定表达ATP5a 细胞系是一种用于研究细胞能量合成和与之相关疾病的重要工具。通过对该细胞系的研究,我们可以更好地理解细胞内能量代谢的机制,并为相关疾病的治疗提供科学依据。
