长期干旱胁迫下Mdm-miR160-MdARF17-MdHYL1模块调控苹果生长发育的研究
2024-04-11刘晨毛秀山刘祥梅申小霞刘振中
刘晨 毛秀山 刘祥梅 申小霞 刘振中

摘 要 为了研究长期干旱条件下Mdm-miR160- MdARF17- MdHYL1 调控网络在苹果生长发育中的作用,以GL-3和Mdm-miR160e OE、 MdARF17 RNAi、 MdmARF17 OE、 MdHYL1 OE及 MdHYL 1 RNAi转基因苹果为试验材料,进行为期3个月的长期干旱处理,测定苹果株高、根干质量、根冠比以及叶片净光合速率、胞间CO2浓度、气孔导度、蒸腾速率、叶绿素荧光值和水分利用效率。结果表明,在长期干旱胁迫下, Mdm-miR160e OE转基因苹果植株更矮化,根冠比、根干质量、光合能力及水分利用效率大于GL-3植株,具有更强的耐旱性; MdARF17 RNAi植株比GL-3更矮,且具有更大的根冠比、根干质量、光合能力和水分利用效率,而 MdARF17 OE与之相反; MdHYL1 RNAi植株对长期干旱胁迫更敏感,其株高大于野生型且具有更小的根冠比、更低的光合能力和水分利用效率,而 MdHYL1 OE植物对长期干旱条件具有更强的适应性,生长发育表型与RNAi植株相反。综上所述,Mdm-miR160- MdARF17- MdHYL1调控网络在苹果响应长期干旱过程中发挥了重要功能,为苹果抗旱分子育种提供了候选基因。
关键词 苹果;长期干旱; MdARF17;Mdm-miR160; MdHYL1
MicroRNA(miRNA)是一类长度约为21~24个核苷酸(nt)的短链小分子RNA[1]。在植物中,miRNA由RNA聚合酶Ⅱ(Pol Ⅱ)转录,产生初级miRNA(pri-miRNA),经DICER-LIKE1(DCL1)进一步裂解产生成熟的miRNA,它们可以通过形成一个RNA诱导的沉默复合物(RISC)与目标mRNA结合,从而表现为对靶基因的负调节[2-4]。miRNA在植物响应非生物胁迫的过程中发挥重要作用[5],过表达拟南芥(Arabidopsis thaliana)ath-miR156、ath-miR408或大豆(Glycine max)gma-miR 172c等可以提高这些植物的耐旱能力[6-8]。前人研究表明,miR160通过靶向生长素响应因子(AUXIN RESPONSE FACTORS,ARF) ARF10、 ARF16、 ARF17,调节植物的生长发育[9]。
植物体内的ARF转录因子可以通过特异结合Aux/IAA(Auxin/Indole-3-acetic acid)、GH3(Gretchen Hagen 3)等生长素响应基因启动子区域的生长素响应元件,激活或抑制靶基因的表达[10]。前人研究表明,拟南芥中的ARF5、ARF6、ARF7、ARF8、ARF19会促进生长素响应基因的表达,其余ARF蛋白起转录抑制作用[11]。在拟南芥中, ARF17是miR160的靶基因,是拟南芥不定根生长的主要调控因子,过表达 ARF17(35S:5mARF17株系,破坏miR160驱动的 ARF17降解)会导致根、叶片、花器官的发育缺陷[12]。
苹果(Malus domestica)是中国重要的经济作物,在全国范围内都有广泛栽种。根据国家统计局数据,2019年中国苹果总产量高达4 242 万t,超过世界总苹果产量的二分之一。 西北黄土高原地区是中国重要的优质苹果产区,但该地区自然降水少,且年降水量分布不均,影响苹果的产量和品质,严重制约当地苹果产业的发展[13]。水分在植物生长发育中具有重要作用,无论是长期的干旱还是短期的水分亏缺,都可能对植物体造成不可逆的伤害[14-15]。然而,其是否参与长期干旱调控并不清楚。
本研究分别对苹果Mdm-miR160、 MdARF17 及 MdHYL1 转基因苹果植株进行了长期干旱处理,研究了Mdm-miR160- MdARF17- MdHYL1正反馈调节环在苹果长期干旱胁迫中的作用,为深入研究苹果响应长期干旱胁迫的分子机制,并进一步利用基因工程手段培育抗旱苹果新种质提供了理论基础。
1 材料与方法
1.1 试验材料
基因克隆和载体构建所用的‘金冠苹果盆栽苗,生长于西北农林科技大学园艺场。转基因材料背景为‘皇家嘎啦(Royal Gala)实生后代GL-3,所用植物材料(GL-3、Mdm-miR160e OE、 MdARF17 RNAi、 MdARF17 OE、 MdHYL 1 RNAi、 MdHYL 1 OE转基因株系)均来自于前期报道[17]。
1.2 试验处理
长期干旱胁迫处理:参照Geng等[18]的方法进行长期干旱处理。取长势一致的转基因苹果和GL-3,移栽至30 cm×18 cm大盆中[基质∶沙=10∶1(体积比)],在温室大棚中正常管理两个月后,对照组保持正常浇水,处理组浇水至最大田间持水量后,用TDR测量,保持土壤含水量45%~55%,进行3个月的长期干旱处理。处理结束时进行株高、根干质量、根冠比、光合速率、胞间CO2浓度、气孔导度、蒸腾速率、叶绿素荧光值、水分利用效率等一系列指标的测定。
1.3 测定指标及方法
1.3.1 生长指标的测定 处理结束时,对照组和干旱处理组的每个株系各自随机选取12株进行株高的测定。株高用卷尺(1 mm)测定(从土壤表面至主干顶芽)。随后各自随机选取5株拔出、洗净,分为地上部分和地下部分,之后放入105 ℃烘箱杀青15~20 min,70 ℃烘干。天平称量地上部分和地下部分,地下部分干质量即为根干质量,其比值为根冠比。
1.3.2 光合作用指标及水分利用效率的测定 光合參数(净光合速率、蒸腾速率、气孔导度和胞间CO2浓度)测定:使用Li-6400 XT光合仪(Li-Cor Inc.,Lincoln,Nebraska,USA),选取每株主干顶部第9~10片成熟叶进行测定,测定时间为晴天的 9:00-11:00。
叶绿素荧光参数(PSⅡ最大量子产量 Fv/Fm)测定:使用PAM-2500便携式调制叶绿素荧光仪(Walz Company,Germany),选取每株主干顶部第9~10片成熟叶,暗适应30 min后进行测定。
水分利用效率(WUE)检测:长期干旱处理结束后,摘取植株中部成熟叶片,每个株系取3片叶子,烘干后粉碎过80目筛,测定碳同位素丰度比(13C/12C)。
2 结果与分析
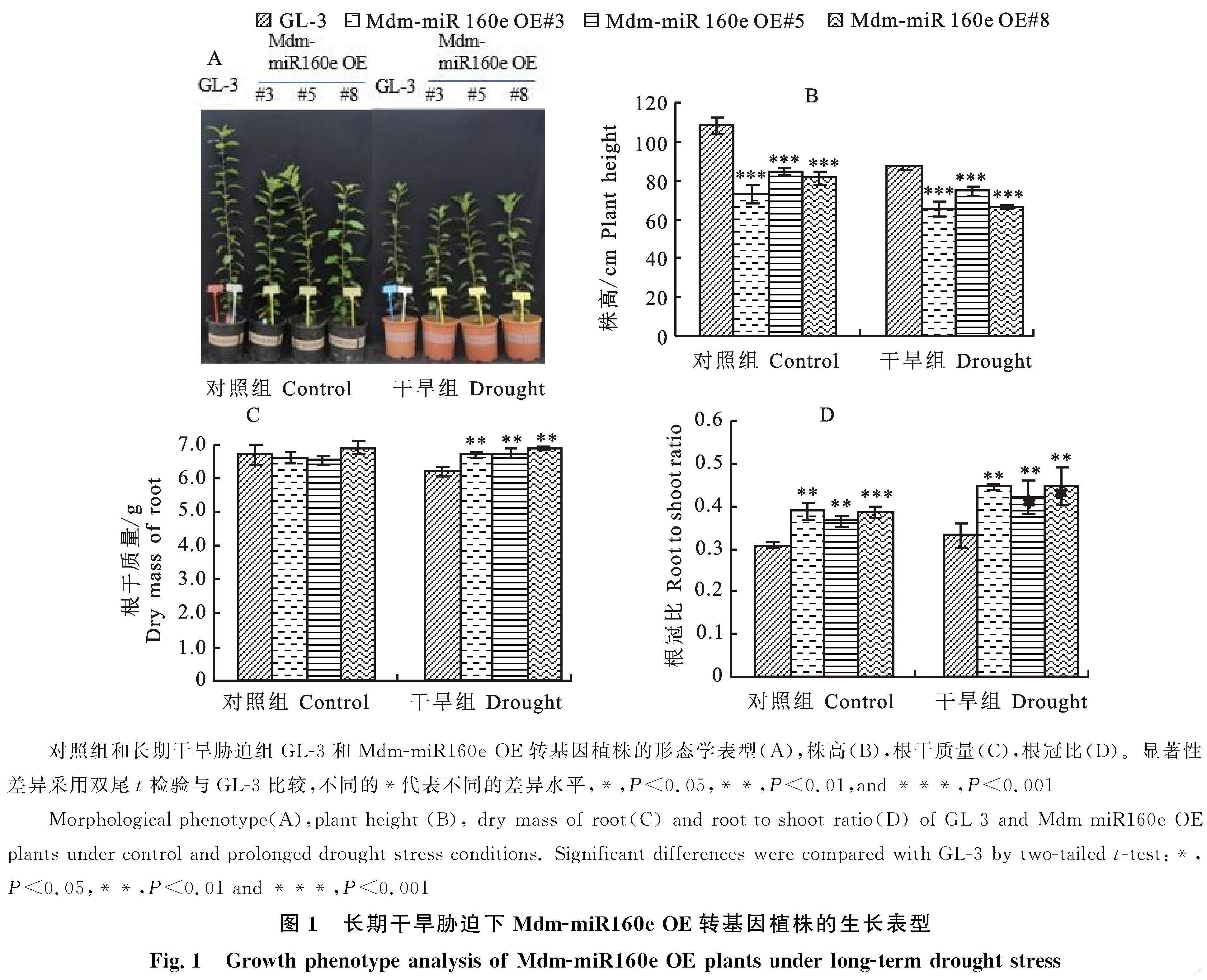
2.1 Mdm-miR160e OE转基因植株在长期干旱胁迫下表型分析
对GL-3 和Mdm-miR160e OE转基因苹果植株进行3个月的长期中度干旱胁迫处理,结果显示,与GL-3植株相比,Mdm-miR160e OE植株在干旱处理前后均具有矮化表型,且干旱胁迫后,转基因植株与GL-3株高之间的差异减小(图1-A、1-B)。分析Mdm-miR160e OE植株和GL-3根的干质量和根冠比发现,Mdm-miR160e OE株系具有更大的根干质量和根冠比,说明干旱胁迫条件下Mdm-miR160e过表达能够维持根系的生长发育状态(图1-C、1-D)。
利用光合仪测定光合速率、胞间CO2浓度、气孔导度及蒸腾速率,便携式调制叶绿素荧光仪测定叶绿素荧光, 结果显示,干旱胁迫使苹果植株的光合能力下降(图2-A~2-E)。与GL-3相比,干旱胁迫后Mdm-miR160e OE转基因植株的气体交换加强,且叶片PSⅡ光合作用反应中心具有更大的光化学效率,其光合速率、胞间CO2浓度、气孔导度、蒸腾速率和叶绿素荧光参数Fv/Fm均显著高于野生型(图2-A~2-E),说明其具有比野生型更强的光合能力,对长期干旱的环境具有更强的适应性。植物的水分利用效率(WUE)与植物干物质中稳定碳同位素组成(δ13C)正相关,本研究通过测定碳同位素组成(δ13C)评价植物WUE,结果显示,在长期干旱胁迫前后,与GL-3相比,Mdm-miR160e OE转基因植株均具有更高的WUE(图2-F),说明其在水分亏缺状态下,能更高效地利用有限的水分。
2.2 MdARF17转基因植株在长期干旱胁迫下表型分析
对GL-3、 MdARF17 RNAi苹果植株进行3个月的长期中度干旱胁迫处理,结果显示,与GL-3植株相比, MdARF17 RNAi植株在干旱处理前后均具有矮化表型,且长期干旱胁迫后转基因植株与GL-3株高的差异减小(图3-A、3-B)。 MdARF17 RNAi植株在长期干旱胁迫处理后,根干质量显著高于GL-3(图3-C),根冠比明显大于GL-3(图3-D),说明沉默 MdARF17 有利于植物根系发育,使苹果具有更强的抗旱性。
与GL-3相比,干旱处理后 MdARF17 RNAi转基因植株具有更强的光合能力,其光合速率、胞间CO2浓度、气孔导度、蒸腾速率和叶绿素荧光参数均显著高于野生型(图4-A~4-E),说明 MdARF17 RNAi转基因植株在干旱胁迫处理下具有更强的气体交换能力,且其PSⅡ反应中心的最大光合效率高于野生型,对长期干旱胁迫有更强适应能力。但与正常浇水的对照组相比,干旱处理使所有株系的光合能力下降(图4-A~4-E)。通过测定δ13C发现 MdARF17 RNAi株系比GL-3具有更高的水分利用效率(图4-F)。
对GL-3、 MdmARF17 OE转基因苹果植株进行3个月的长期中度干旱胁迫处理,结果显示,干旱胁迫使 MdmARF17 OE转基因株系表现出与 MdARF17 RNAi植物相反的趋势(图5-A~ 5-D)。与GL-3相比, MdmARF17 OE转基因植株具有矮化表型,且这种株高间的差异在干旱胁迫后并未减小(图5-A、5-B),说明 MdmARF17 OE转基因植株在干旱胁迫条件下生长量小于GL-3;且 MdmARF17 OE植物具有比野生型更低的根干质量(图5-C)和根冠比(图5-D),说明过表达 MdARF17 会抑制苹果根系的生长发育,导致 MdmARF17 OE转基因植株对干旱胁迫更敏感。
长期干旱胁迫处理后,测定 MdmARF17 OE转基因株系光合相关参数和叶绿素荧光值,结果显示,与GL-3相比, MdmARF17 OE植株的光合速率更慢(图6-A)、胞间CO2浓度较低 (图 6-B)、气孔导度更小(图6-C)、蒸腾速率更慢(图6-D),具有更低的叶绿素荧光参数Fv/Fm (图 6-E)。分析δ13C结果,发现 MdmARF17 OE株系的水分利用效率低于GL-3(图6-F)。以上结果表明,过表达 MdARF17 会导致植物抗旱能力下降。
2.3 MdHYL1转基因植株在长期干旱胁迫下表型分析
對GL-3 、 MdHYL1 OE苹果植株进行3个月的长期中度干旱胁迫处理,结果显示,与GL-3相比, MdHYL1 OE株系表现出更强的抗旱能力。干旱处理前, MdHYL 1 OE植株矮于GL-3植株,且株高差异较大,长期干旱胁迫后差异变小(图7-A、7-B),说明转基因植株在长期干旱条件下,具有更大的生长量。根系发育状况可以表征植物在干旱胁迫条件下的吸水能力和抗旱性。且长期干旱胁迫处理后, MdHYL1 OE植株具有更高的根干质量和根冠比(图7-C、7-D)。
检测长期干旱胁迫处理的 MdHYL1 OE与GL-3株系的各项光合参数,结果显示,与正常浇水的对照组相比,干旱处理使所有株系的光合气体交换能力显著下降(图8-A~8-E),但与GL-3相比,干旱处理后 MdHYL1 OE转基因植株具有更强的光合能力,其光合速率、胞间CO2浓度、气孔导度、蒸腾速率和叶绿素荧光参数Fv/Fm均高于野生型(图8-A~8-F)。检测 MdHYL1 OE植株和GL-3在长期干旱条件下的δ13C,结果发现 MdHYL1 OE株系比GL-3具有更高的水分利用效率(图8-F)。
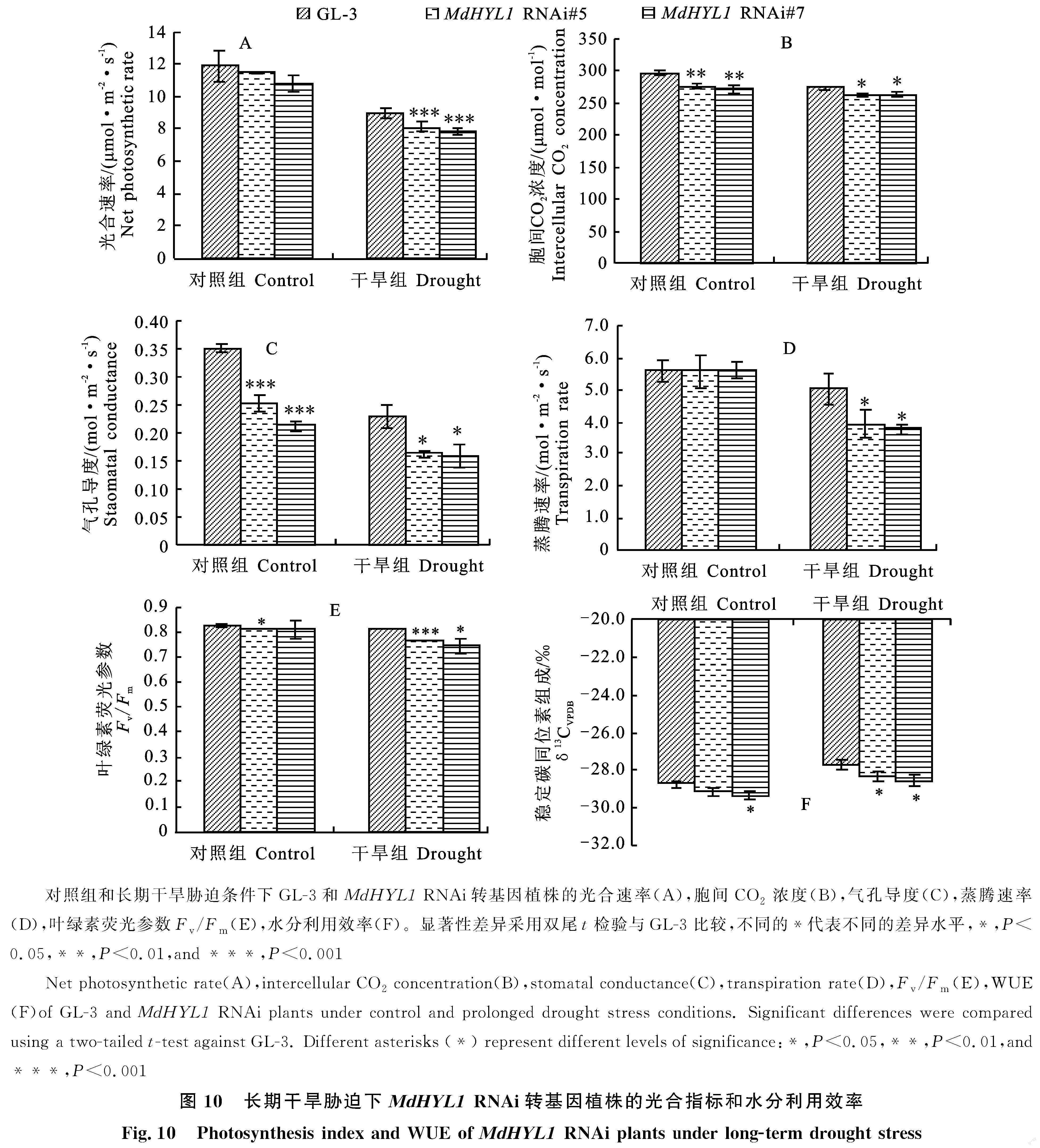
对GL-3 、 MdHYL 1 RNAi苹果植株进行3个月的长期干旱处理,结果显示, MdHYL1 RNAi植株与GL-3长期干旱胁迫后株高间的差异变大(图9-A、9-B),说明转基因植株在长期干旱条件下生长量低于野生型。分析 MdHYL1 RNAi植株和GL-3的根系发育情况发现, MdHYL1 RNAi植株在长期干旱胁迫处理后根干质量和根冠比均低于GL-3(图9-C、9-D)。
检测长期干旱胁迫处理的 MdHYL1 RNAi与GL-3株系的各项光合参数,发现 MdHYL1 RNAi株系的光合参数具有与 MdHYL1 OE株系相反的变化趋势。与GL-3相比,干旱处理后 MdHYL1 RNAi植物的光合能力较差,其光合速率、胞间CO2浓度、气孔导度、蒸腾速率和叶绿素荧光参数Fv/Fm均低于野生型(图10-A~ 10-E)。检测 MdHYL1 RNAi植株和GL-3在长期干旱条件下的δ13C,发现 MdHYL1 RNAi株系比GL-3具有更低的水分利用效率(图10-F)。
3 讨论与结论
植物的生长需要碳源和适宜的生长环境[19]。干旱胁迫下,植物的光合能力是描述其对逆境的适应能力和抗旱能力的重要指标[20],受气孔因素和非气孔因素的影响[21],叶片气孔是植物与外界环境进行气体和水分交换的重要通道,气孔的开张度对植物的光合作用和蒸腾作用有重要影响[22]。长期干旱胁迫条件下,植物叶片气孔开张度下降,光系统Ⅱ(PSⅡ)部分失活,光合作用减弱[20-21]。在传统模型中,认为光合作用CO2的吸收对植物生长起主导作用,但在越来越多的研究表明,植物吸收CO2的能力是有限的,当植物光合气体交换达到最大程度时,增加CO2的浓度并不能改善成熟植物的生长状况[23]。植物光合作用获得的碳还需要在体内经过分配[24-25],一部分转化为植物的茎生长量,一部分转化为根系的生长量[26]。本研究发现,Mdm-miR160e OE、 MdARF17 RNAi、 MdHYL1 OE等转基因株系在具有更强的光合能力的同时,表现出矮化表型,这可能是由于这些转基因苹果体内的碳分配模式发生了改变,光合作用获得的碳更多地流向地下部,使Mdm-miR160e OE、 MdARF17 RNAi、 MdHYL1 OE等转基因株系苹果具有更加发达的根系,根系形态变化是苹果对干旱胁迫的适应性表现,表明Mdm-miR160e OE、 MdARF17 RNAi、 MdHYL1 OE等转基因株系苹果在干旱条件下具有更强的吸水能力。而在干旱胁迫条件下,苹果叶片气孔开张度下降,光合气体交换能力强弱成为植物生长的主要限制因素,Mdm-miR160e OE、 MdARF17 RNAi、 MdHYL1 OE转基因植株具有更强的光合能力、更高的水分利用效率,能更好地适应干旱条件[27-29],使其与野生型GL-3之间的株高差异减小。
miRNA是植物响应干旱胁迫中的重要参与者,其在不同植物间通常具有保守性,但来自不同植物的miRNA可能对干旱胁迫的表现出不同的响应模式[30-31]。在水稻和番茄中,干旱胁迫会导致miR160的表达量下调,但在小麦和桃中,干旱胁迫后miR160的表达上调[17]。在本研究中,干旱诱导表达的Mdm-miR160e OE转基因苹果植株高低于野生型植株,具有更高的根干质量、根冠比、水分利用效率、更强的光合能力,对长期干旱胁迫具有更强的适应性。
一些转录因子可以被 miRNA靶定,在一个复杂的调节环路模型中调节miRNA的表达。在拟南芥中,ARF17是miR160的靶基因,可以调控miR160的丰度但不调节pri-miR160的含量[32]。前人研究表明,在干旱胁迫下, MdARF17 通过负调控正响应干旱胁迫的 MdWRKY71 、 MdLTP3 等基因,以及Mdm-miR156 p5,Mdm-miR160,Mdm-miR164c p5,Mdm-miR166c p5,Mdm-miR396 p5等正响应干旱胁迫的miRNA,参与苹果的耐旱调节[17]。拟南芥中,miR167结合 AtARF6 和 AtARF8 ,参与调控不定根的生成[33],本研究中, MdARF17 转基因植株也表现出生长发育表型,与GL-3相比, MdARF17 RNAi 植物株高更矮,且在长期干旱胁迫条件下,MdARF17 沉默株系具有更大的根干質量和更高的根冠比,转基因植株根系发达,使其表现更为抗旱;此外, MdARF17 RNAi植物水分利用效率和光合能力均大于野生型。而 MdARF17 OE植物与沉默株系具有相反的表型,其根系弱于野生型且对干旱胁迫更为敏感。
实验室前期研究发现, MdHYL1 是 MdARF17 的下游靶基因, MdHYL1是双链RNA结合蛋白,其同源二聚体化使pri-miRNA种的切割位点可以被正确选择[17], MdARF17 通过 MdHYL1 调控miRNA的合成,形成Mdm-miR160- MdARF17 - MdHYL1 在干旱胁迫下的正反馈调节网络。前人研究表明, MdHYL1 可以调控苹果发育表型, MdHYL1 OE植株的不定根数目增多,且长度更长,而沉默株系与之相反[34]。本研究中,3个月长期干旱处理后, MdHYL1 过表达株系根干质量和根冠比的值均高于野生型,光合能力和水分利用效率同样大于野生型植物,而沉默株系与之相反,说明Mdm-miR160- MdARF17 - MdHYL1 正反馈调节网络在苹果响应干旱胁迫中同样重要。
本研究证实在长期干旱胁迫下,干旱诱导表达的Mdm-miR160e转基因苹果植株具有更强的耐旱性,而Mdm-miR160的靶基因 MdARF17 是干旱胁迫的负调控因子,在长期干旱胁迫下, MdARF17 RNAi植株表现出更强的耐旱性,而 MdmARF17 OE植株对干旱更敏感。 MdHYL1 是 MdARF17 的下游靶基因, MdHYL1 在苹果耐旱调节中也发挥积极作用, MdHYL1 RNAi植株对长期干旱胁迫更敏感,而过表达株系对长期干旱条件具有更强的适应性。
综上所述, Mdm-miR160- MdARF17 - MdHYL1 调控网络在苹果响应长期干旱过程中发挥了重要功能,研究结果为苹果抗旱分子育种提供了候选基因,為深入研究苹果响应长期干旱胁迫的分子机制,并进一步利用基因工程手段培育抗旱苹果新种质提供了理论基础。
参考文献 Reference:
[1] JIN H. Endogenous small RNAs and antibacterial immunity in plants[J]. Febs Letters,2008,582(18):2679-2684.
[2] SWAPNA M,KUMAR S. MicroRNAs and their regulatory role in sugarcane[J]. Frontiers in Plant Science,2017,8:997.
[3] SAMAD A F A,SAJAD M,NAZARUDDIN N,et al. MicroRNA and transcription factor:key players in plant regulatory network[J].Frontiers in Plant Science,2017,8:565.
[4] ROGERS K,CHEN X. Biogenesis,turnover,and mode of action of plant microRNAs[J]. Plant Cell,2013,25(7):2383-2399.
[5] SONG X,LI Y,CAO X,et al. Micro RNAs and their regulatory roles in plant-environment interactions[J]. Annual Review of Plant Biology,2019,70:489-525.
[6] LI W,WANG T,ZHANG Y,et al. Overexpression of soybean miR172c confers tolerance to water deficit and salt stress,but increases ABA sensitivity in transgenic Arabidopsis thaliana[J]. Journal of Experimental Botany,2016,67(1):175-194.
[7] ARSHAD M,FEYISSA B A,AMYOT L,et al. MicroRNA156 improves drought stress tolerance in alfalfa (Medicago sativa) by silencing SPL13[J]. Plant Science,2017,258:122-136.
[8] HAJYZADEH M,TURKTAS M,KHAWAR K M,et al. miR408 overexpression causes increased drought tolerance in chickpea[J]. Gene,2015,555(2):186-193.
[9] WANG J W,WANG L J,MAO Y B,et al. Control of root cap formation by microRNA-targeted auxin response factors in Arabidopsis[J]. Plant Cell,2005,17(8):2204-2216.
[10] LUO J,ZHOU J J,ZHANG J Z. Aux/IAA gene family in plants:molecular structure,regulation,and function[J]. International Journal of Molecular Sciences,2018, 19(1):259.
[11] GUILFOYLE T J,HAGEN G. Auxin response factors[J]. Journal of Plant Growth Regulation,2001,20(3):281-291.
[12] MALLORY A C,BARTEL D P,BARTEL B. MicroRNA-directed regulation of Arabidopsis AUXIN RESPONSE FACTOR17 is essential for proper development and modulates expression of early auxin response genes[J]. Plant Cell,2005,17(5):1360-1375.
[13] 谢银鹏. 苹果MdMYB88和MdMYB124转录因子在低温和干旱胁迫中的作用机理研究[D]. 陕西杨凌:西北农林科技大学,2018.
XIE Y P.Molecular mechanisms of MdMYB88 and MdMYB124 in response to cold and drought stresses in apple[D]. Yangling Shaanxi:Northwest A&F University,2018.
[14] 李瑞雪,孙任洁,汪泰初,等.植物抗旱性鉴定评价方法及抗旱机制研究进展[J]. 生物技术通报,2017,33(7):40-48.
LI R X,SUN R J,WANG T CH,et al.Research progress on identification and evaluation methods,and mechanism of drought resistance in plants[J]. Biotechnology Bulletin,2017,33(7):40-48.
[15] FELLER U. Drought stress and carbon assimilation in a warming climate:Reversible and irreversible impacts[J]. Journal of Plant Physiology,2016,203:84-94.
[16] JONES-RHOADES M W,BARTEL D P. Computational identification of plant microRNAs and their targets,including a stress-induced miRNA[J]. Molecular Cell,2004,14(6):787-99.
[17] SHEN X,HE J,PING Y,et al. The positive feedback regulatory loop of miR160-auxin response factor 17-HYPONASTIC LEAVES 1 mediates drought tolerance in apple trees[J]. Plant Physiology,2021,188(3):1686-1708.
[18] GENG D,CHEN P,SHEN X,et al. MdMYB88 and MdMYB124 enhance drought tolerance by modulating root vessels and cell walls in apple[J]. Plant Physiology,2018,178(3):1296-1309.
[19] KRNER C. Paradigm shift in plant growth control[J]. Current Opinion in Plant Biology,2015,25:107-114.
[20] 張德辉. 苹果转录因子MdMYB88、MdMYB124和MdMYB3在干旱和低氮胁迫中的功能机理研究[D]. 陕西杨凌:西北农林科技大学,2021.
ZHANG D H.Characterization of transcription factors MdMYB88,MdMYB 124,and MdMYB 3 in response to drought and low nitrate stresses in apple[D]. Yangling,Shaanxi:Northwest A&F University,2021.
[21] 张 栋. 干旱胁迫对苹果光合作用和叶绿素荧光的影响及叶片衰老特性研究[D]. 陕西杨凌:西北农林科技大学,2011.
ZHANG D.Effects of drought stress on photosynthesis and fluorescence chlorophyll parameters of apple leaves and leaf senescence characteristics[D]. Yangling Shaanxi:Northwest A&F University,2011.
[22] 张强强. 水稻气孔导度和光合作用在不同光环境下的响应差异与机理[D]. 武汉:华中农业大学,2020.
ZHANG Q Q. Studies on the mechanisms of the responses of stomatal conductance and photosynthesis to different light environments in Oryza[D]. Wuhan:Huazhong Agricultural University,2020.
[23] JIANG M,MEDLYN B E,DRAKE J E,et al. The fate of carbon in a mature forest under carbon dioxide enrichment[J]. Nature,2020,580(7802):227-231.
[24] CABON A,KANNENBERG S A,ARAIN A,et al. Cross-biome synthesis of source versus sink limits to tree growth[J]. Science,2022,376(6594):758-761.
[25] FATICHI S,LEUZINGER S,KRNER C. Moving beyond photosynthesis:from carbon source to sink-driven vegetation modeling[J]. New Phytologist,2014,201(4):1086-1095.
[26] SHAMUYARIRA K W,SHIMELIS H,FIGLAN S,et al. Path coefficient and principal component analyses for biomass allocation,drought tolerance and carbon sequestration potential in wheat[J]. Plants Basel,2022,11(11):1407.
[27] 劉丙花. 苹果资源苗期水分利用效率的评价和高效用水的生理机制及其调控研究[D]. 陕西杨凌:西北农林科技大学,2012.
LIU B H.Evaluation of water use efficiency and the physiological mechanism and regulation of efficient water use in young apple genetic resources[D]. Yangling Shaanxi:Northwest A&F University,2012.
[28] DING S,ZHANG B,QIN F. Arabidopsis RZFP34/CHYR1,a Ubiquitin E3 Ligase,regulates stomatal movement and drought tolerance via SnRK2.6-Mediated phosphorylation[J]. Plant Cell,2015,27(11):3228-3244.
[29] 张翠梅. 不同抗旱性紫花苜蓿响应干旱的生理及分子机制研究[D].兰州:甘肃农业大学,2019.
ZHANG C M. Physiological and molecular mechanisms of response to drought stress in different drought-resistant alfalfa (Medicago sativa L.) varieties [D]. Lanzhou:Gansu Agricultural University,2019.
[30] ZHAO J,YUAN S,ZHOU M,et al. Transgenic creeping bentgrass overexpressing Osa-miR393a exhibits altered plant development and improved multiple stress tolerance[J]. Plant Biotechnology Journal,2019,17(1):233-251.
[31] XIA K,WANG R,OU X,et al. OsTIR1 and OsAFB2 downregulation via OsmiR393 overexpression leads to more tillers,early flowering and less tolerance to salt and drought in rice[J]. PLoS One,2012,7(1):e30039.
[32] GUTIERREZ L,BUSSELL J D,PACURAR D I,et al. Phenotypic plasticity of adventitious rooting in Arabidopsis is controlled by complex regulation of AUXIN RESPONSE FACTOR transcripts and microRNA abundance[J]. Plant Cell,2009,21(10):3119-32.
[33] 温绍廷. 生长素调控拟南芥不定根再生的分子机制研究[D]. 上海:上海师范大学,2021.
WEN SH T. Mechanism of auxin-mediated adventitious roots formation in Arabidopsis thaliana[D]. Shanghai:Shanghai Normal University,2021.
[34] 王丽平,姜丽娟,马锋旺,等.苹果 HYL1基因在干旱中的表达与功能分析[J]. 西北农林科技大学学报(自然科学版),2018,46(7):109-116.
WANG L P,JIANG L J,MA F W,et al. Expression and fuction analysis of MdHYL1 gene in apple under drought tolerance [J].Journal of Northwest A&F University(Natural Science Edition),2018,46(7):109-116.
Regulation of Apple Growth and Development by Mdm-miR160- MdARF17- MdHYL1 Module under Long-term Drought Stress
Abstract GL-3 and Mdm-miR160e OE, MdARF17 RNAi,MdmARF17 OE, MdHYL1 OE, MdHYL1 RNAi transgenic apples were used as materials to investigate the role of Mdm-miR160- MdARF17- MdHYL1 regulatory network in growth and development of apple trees under long-term drought stress,after three months of drought treatment,we measured plant height,root dry mass,root to shoot ratio,and leaf net photosynthetic rate,intercellular CO2 concentration,stomatal conductance,transpiration rate,Fv/Fm and water use efficiency.The results showed that under long-term drought stress,compared with GL-3 plants,Mdm-miR160e OE transgenic apple plants exhibited a more dwarf symptom,with a higher root-to-shoot ratio,root mass,photosynthetic capacity,and water use efficiency compared to GL-3 plants. They demonstrated a stronger drought tolerance; MdARF17 RNAi plants were shorter than GL-3,with a higher root to shoot ratio,greater root dry mass,enhanced photosynthetic capacity,and improved water use efficiency. In contrast, MdARF17 OE plants displayed characteristics opposite to those of MdARF17 RNAi lines. MdHYL1 RNAi plants were more sensitive to long-term drought stress,with higher plant height compared to the wild-type,a smaller root-to-shoot ratio,lower photosynthetic capacity,and reduced water use efficiency. On the other hand, MdHYL1 OE plants were better adapted to long-term drought conditions and exhibited phenotypes that were the opposite of those seen in MdHYL1 RNAi lines.Therefore,Mdm-miR160- MdARF17- MdHYL1 regulatory network plays an important role in apple responses to long-term drought stress and provides candidate genes for molecular breeding to enhance drought resistance.
Key words Apple;Long-term drought; MdARF17; Mdm-miR160; MdHYL1
