H2O2催化氧化缓释螯合铁离子处理碱性含氰废水的研究
2024-04-10文志东魏连启楼涵王海超刘国梁武晓峰
*文志东 魏连启 楼涵 王海超 刘国梁 武晓峰
(1.山东(烟台)中日产业技术研究院(烟台市产业技术研究院) 山东 264003 2.中国科学院过程工程研究所 北京 100190 3.招远中环科技有限公司 山东 265400 4.生态环境部固体废物与化学品管理技术中心 北京 100029)
含氰废水一般为碱性的水体,为了降低废水中氰化物的含量,同时不影响水体的酸碱度,除了游离氰和易挥发氰可以通过强氧化剂进行氧化破氰处理,亚铁氰根类的含氰络合物则很难实现碱性环境下脱除。H2O2作为一种强氧化剂,可用来处理含氰废水中的简单氰化物和部分金属氢络合物[1-5]。H2O2氧化法的原理是在碱性条件下,Cu2+作为催化剂氧化分解氰化物,产物多为碳酸根离子和铵根离子等无毒物质,总反应方程式如式(1)所示[6-10]。
过氧化氢氧化法可以破坏Cu、Zn、Pb、Ni、Cd等的含氰络合物,使CN配体释放出来,处理后的含氰废水中CN-浓度可降至0.5mg/L以下。H2O2氧化法的优点是不引入其他杂质元素,无二次污染,处理速度快,工艺简单,缺点是不能氧化分解铁氰络合物。
本文针对黄金氰化行业中的碱性含氰废水进行无害化处理,拟引入有机螯合铁来补充铁离子沉降亚铁氰根、铜氰络合物为亚铁氰化铁,达到废水脱氰回用的目的。选用H2O2作为强氧化剂,拟利用其在碱性条件下快速氧化体系中的游离氰化物,同时氧化分解有机铁螯合剂释放出Fe3+,而Fe3+催化作用加速H2O2产生大量的羟基自由基氧化分解氰化物和有机螯合剂,加快氧化分解的效率。采用单因素实验法分析H2O2氧化分解铁螯合剂的主要影响因素,使释放出的铁离子能够继续与溶液中的铁氰络合物反应,生成普鲁士蓝类化合物。同时可确定最佳反应条件。
1.试验部分
(1)废水性质
某黄金冶炼企业氰化渣浮选废水,废水pH值为8,总氰化物浓度为221.59mg/L,其中游离氰化物为9.6mg/L,其余主要为亚铁氰根离子、铜氰络离子形式。实验主要针对总氰化物含量进行处理与检测。
(2)试验方法
间歇试验:取该含氰废水200mL,利用XJT型充气多功能浸出搅拌机搅拌,投加有机螯合铁药剂EDDHAFe药剂反应一定时间后,加入一定量过氧化氢溶液(H2O2,质量分数为30%),反应一段时间后抽滤,分析滤液组分。
2.结果与讨论
(1)初始pH的影响
取8等份200mL废水,通过加入(1+1)H2SO4和20%氢氧化钠溶液分别调节初始pH分别为7、8、9、10、11、12、13和14,加入质量分数为10% EDDHA-Fe水溶液5mL,搅拌均匀,然后加1mL H2O2,匀速搅拌20min,过滤后测定废水中总氰化物浓度,废水总氰化物浓度和氰化物去除率结果见图1。

图1 废水总氰浓度和去除率与初始pH的关系图
由图1可知,随着pH的逐渐增大,氰化物的去除率逐渐降低。在初始pH=7和pH=8时,废水中总氰化物浓度分别为16.19mg/L和20.18mg/L,去除率分别为92.69%和90.89%,去除率均在90%以上;在初始pH>9之后,氰化物去除率急剧下降,由80.05%降至低于5.65%,这是因为在碱性条件下,尤其是pH>9之后,溶液中存在大量的氢氧根会先与释放出的Fe3+反应生成氢氧化铁沉淀,即使Fe3+与铁氰络合物发生反应产生Fe4[Fe(CN)6]3,也会迅速发生下面解离反应,导致生成的Fe4[Fe(CN)6]3又溶解在水中,使得氰化物去除率较低。
在初始pH=7和pH=8时,反应完成后溶液为蓝色,表明生成了普鲁士蓝类化合物;在初始pH为11~14时,加入H2O2后溶液由清澈透明变得浑浊,反应完成后过滤,滤纸上残留红棕色沉淀,也能侧面证明所在pH下生成的沉淀为Fe(OH)3沉淀,而非铁氰络合物沉淀。因此为了更好地去除废水中的氰化物且不影响废水原始酸碱度,实验最佳条件选择初始pH=8。
(2)H2O2加入量的影响
取9等份200mL废水,在初始pH=8时,分别加入0mL、0.5mL、1.0mL、1.5mL、2.0mL、2.5mL、3.0mL、3.5mL、4.0mL H2O2,搅拌20min,过滤后测定废水中总氰化物浓度,废水总氰化物浓度和氰化物去除率结果见图2。
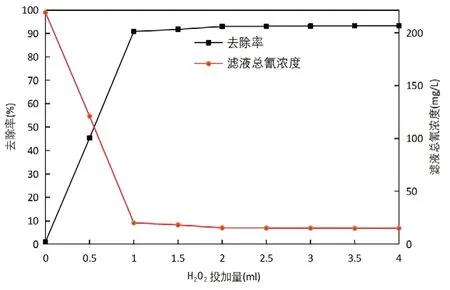
图2 废水总氰浓度和去除率与H2O2加入量的关系图
由图2可知,随着H2O2加入量的增加,废水氰化物去除率逐渐增大。在加入H2O2量为2mL时,氰化物去除率相较于未加入H2O2时有较大提升,去除率由0.96%提高至93.02%;在加入H2O2量为4mL时,废水中总氰化物浓度为15.14mg/L,去除率为93.26%;在加入H2O2量为2~4mL过程中,废水中总氰化物浓度基本趋于平衡。因此后续实验选择H2O2加入量为2mL。
(3)反应时间的影响
取200mL废水,在初始pH=8时,加入2mL H2O2,分别在搅拌10min、20min、30min、40min、50min、60min、70min、80min和90min时分别取样10mL,过滤后测定废水中总氰化物浓度,废水总氰化物浓度和氰化物去除率结果见图3。
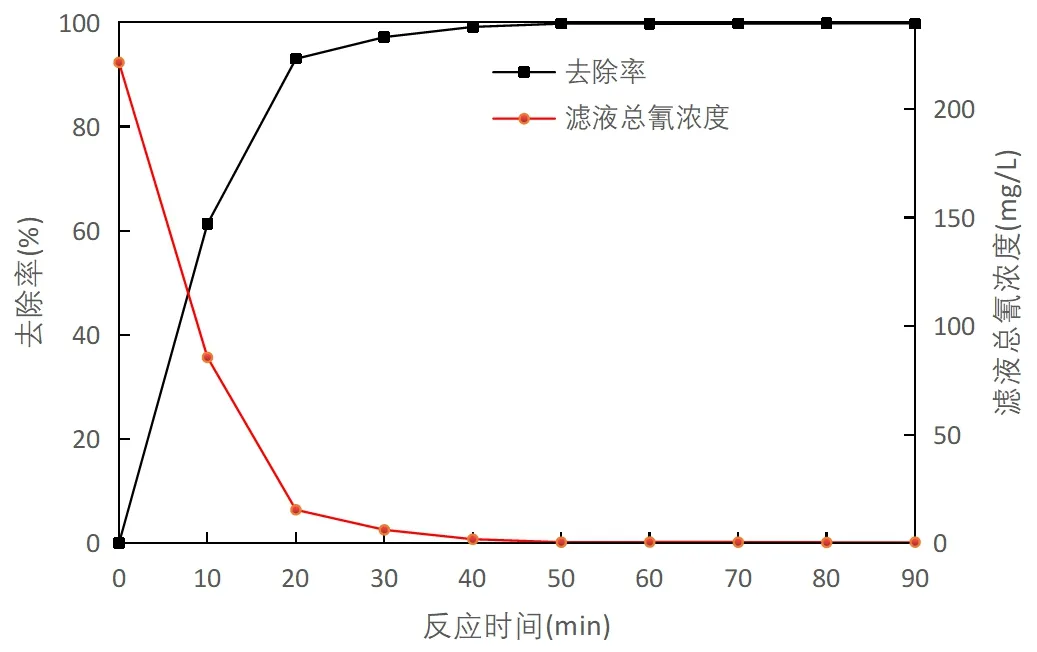
图3 废水总氰浓度和去除率与反应时间关系
由图3可知,随着反应时间的延长,废水中总氰化物浓度逐渐降低,去除率逐渐增大。在反应的前20min,去除率与反应时间大致呈线性相关,在50min时去除率为99.77%;在50min后,去除率增长变缓,反应时间50~90min之间,废水中的总氰化物浓度基本稳定,维持在0.5mg/L左右,此时氰化物去除率为99.76%左右。综上所述,最佳反应时间为50min。
(4)优化条件下效果及产物组成分析
多次重复在初始pH=8时加入2mL H2O2反应50min条件下,对滤液中的氰化物进行处理,结果见表1。
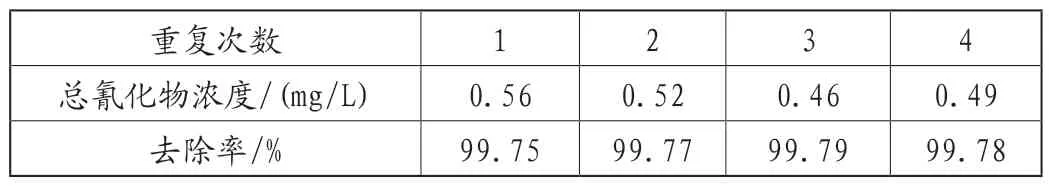
表1 重复实验总氰化物浓度和去除率结果表
由表2可知,在最佳实验条件下,氰化物去除率基本稳定,平均去除率99.77%,残留总氰化物浓度平均在0.51mg/L左右,远远低于氰化物排放标准。在此条件下的产物为蓝色,如图4所示,推测为普鲁士蓝Fe4[Fe(CN)6]3。对此条件下的产物进行XRD分析,由图5可知,通过XRD标准卡片对比,分析产物的主要物相为Fe4[Fe(CN)6]3,在2θ=17.24°、24.68°和37.42°处的特征峰为Fe4[Fe(CN)6]3的衍射峰,其位置相较于标准卡片位置有所偏移,可能是因为掺杂了钠原子等原子粒径比Fe大的原子。

图4 最佳条件下沉淀产物颜色图
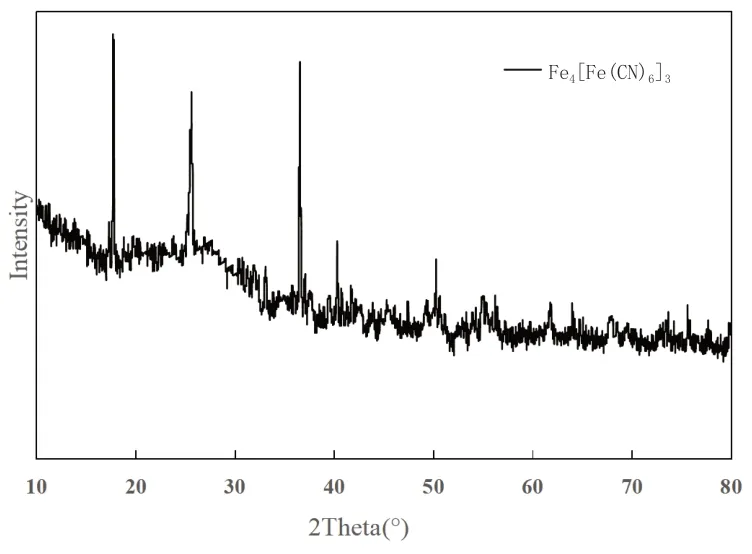
图5 最佳条件下产物XRD图
3.结论
沉降法去除络合氰化物多在酸性环境下进行,采用H2O2催化氧化分解游离氰和有机螯合铁EDDHA-Fe的方法可实现弱碱性环境下间接处理回收利用废水中的氰化物,而不需要酸化废水。对初始pH、H2O2投加量以及反应时间等影响因素进行了分析,确定了最佳反应条件为初始pH=8、H2O2投加量为2mL、反应时间为50min,此时废水中总氰化物浓度降低到0.51mg/L,去除率达到99.77%;对最佳条件下的产物进行了XRD分析发现产物主要为蓝色的Fe4[Fe(CN)6]3。
