三种抗氧化剂对斑马鱼卵母细胞冷冻保存效果比较
2024-04-10黄柯嘉蔡心清郭冰玉张全根张俊芳韩兵社
黄柯嘉 蔡心清 郭冰玉 张全根 张俊芳 韩兵社
摘 要:为研究抗氧化剂对斑马鱼卵母细胞冷冻保存效果的影响,在基础冷冻保护液配方中分别添加褪黑素、谷胱甘肽和甜菜碱等3种抗氧化剂进行了冷冻保存试验,比较冷冻后卵母细胞的活性氧(ROS)含量、总抗氧化能力(T-AOC)、腺嘌呤核苷三磷酸(ATP)含量、琥珀酸脱氢酶(SDH)活性、凋亡基因表达水平和存活率。试验结果显示:经过筛选,3种抗氧化剂的最优添加浓度分别为褪黑素1×10-3 mol/L、谷胱甘肽5×10-4 mol/L、甜菜碱1×10-3 mol/L。与对照组相比,添加最优浓度抗氧化剂的3个试验组(褪黑素组、谷胱甘肽组和甜菜碱组)的ROS含量均显著降低,ATP含量和SDH活性均显著提高,褪黑素组和甜菜碱组的T-AOC水平显著提高(P<0.05);褪黑素组卵母细胞的caspase3、caspase9和bax基因表达量显著降低,bcl-2基因表达量则显著升高(P<0.05);谷胱甘肽组卵母细胞的caspase3基因表达量显著下降,bcl-2基因表达量显著上升(P<0.05);甜菜碱组卵母细胞的caspase9和bax基因表达量显著降低(P<0.05)。复苏后的卵母细胞在体外培育120 min,褪黑素组、谷胱甘肽组、甜菜碱组卵母细胞的存活率分别比对照组提高10.13%、14.20%和15.99%;冷冻保存1、7、30、60、90 d,3个试验组卵母细胞的存活率均显著高于对照组(P<0.05);冷冻保存90 d,褪黑素组、谷胱甘肽组、甜菜碱组的存活率分别提高了9.05%、7.34%、6.68%。试验结果说明,在斑马鱼卵母细胞冷冻保存过程中添加1×10-3 mol/L褪黑素或5×10-4 mol/L谷胱甘肽或1×10-3 mol/L甜菜碱,均能够增强冷冻保存后卵母细胞的线粒体功能,降低细胞氧化应激水平,减少细胞凋亡,从而提高斑马鱼卵母细胞冷冻效率。
关键词:冷冻保存;卵母细胞;斑马鱼;抗氧化剂;褪黑素;谷胱甘肽;甜菜碱
冷冻保存是在超低温下长期保存生物配子的技术,可以减少遗传漂变,保持活跃的繁殖群体,为保护种质资源提供一种方案[1]。由于母体遗传的存在,母本基因组在种质资源保护中十分重要,卵母细胞的冷冻保存能够提高物种的保护效率[2]。迄今,对卵母细胞冷冻保存的研究已开展了40多年,并已成功实现了人、小鼠、兔、牛、羊、猪等哺乳动物卵母细胞的冷冻保存[3]。对于鱼类,目前研究者已对斑马鱼、鲤、鲟、彩虹鱼、褐鳟、鲫等的卵巢组织或卵母细胞进行了冷冻保存,但是由于鱼类卵母细胞具有体积大、卵膜通透性差、卵黄含量多、对抗冻剂毒性敏感等特点,对鱼类卵母细胞冻存的效果还不够理想,保存方案的可重复较差[4],再加上长期冻存研究数据的缺乏,卵母细胞的冻存方案亟待进一步优化。
冷冻保存过程中细胞内活性氧(ROS)的积累是引起氧化应激,导致细胞损伤的重要原因[5]。近年来,在哺乳动物卵母细胞冷冻保存过程中会使用一些抗氧化剂,如褪黑素、白藜芦醇、N-乙酰半胱氨酸、谷胱甘肽、槲皮素和甜菜碱等来改善保存效果。褪黑素是一种高效的抗氧化剂,它可以清除细胞内的自由基,提高抗氧化酶的活性,减少细胞的氧化损伤,维持卵膜的通透性,从而改善卵母细胞的体外成熟和胚胎发育历程[6-7]。谷胱甘肽作为体内重要的抗氧化剂和自由基清除剂,在细胞抗氧化应激中,其分子中的巯基能够与活性氧自由基结合,将体内的有害毒物进行无害转化[8]。研究发现,在小鼠卵母细胞玻璃化、升温或体外成熟培养基中补充谷胱甘肽可以减少卵母细胞受到的冷冻损伤,提高受精卵的发育能力[9]。甜菜碱具备抗氧化特性,能够抑制ROS的产生,并清除部分氧化自由基[10]。研究发现,含有甜菜碱的CaCO3微粒可以提高猫卵泡线粒体的活性、降低活性氧从而提高存活率[11]。然而,目前有关抗氧化剂在鱼类卵母细胞冷冻保存中的研究尚不多见。
斑马鱼(Danio rerio)是一种常见的热带观赏鱼,其个体小、繁殖周期短、产卵量大,并且具有胚胎体外受精、体外发育、胚体透明等特点,是重要的脊椎动物模式生物之一,也是开展水产动物基础技术研究的重要模式生物。本试验在冷冻过程中分别添加褪黑素、谷胱甘肽和甜菜碱等3种抗氧化剂,通过检测斑马鱼卵母细胞的活性氧(ROS)含量、总抗氧化能力(T-AOC)、腺嘌呤核苷三磷酸(ATP)含量、琥珀酸脱氢酶(SDH)活性、凋亡基因表达水平以及存活率的变化,分析抗氧化剂种类及其浓度对斑马鱼卵母细胞冷冻保存效果的影响,以期为鱼类卵母细胞冷冻保存技术的的优化提供参考。
1 材料和方法
1.1 主要试剂与仪器
主要试剂(来源):褪黑素、L-15培养基(北京索莱宝科技有限公司),谷胱甘肽(上海泰坦科技股份有限公司),甜菜碱(源叶生物科技有限公司),三卡因、甲醇、二甲基亚砜(赛默飞公司),蔗糖(上海百研科技生物有限公司),ROS检测试剂盒(碧云天生物技术有限公司,S0033S),增强型ATP检测试剂盒(碧云天生物技术有限公司,S0027),T-AOC检测试剂盒(南京建成生物工程研究所有限公司,A015-3-1),SDH檢测试剂盒(南京建成生物工程研究所有限公司,A022-1-1),TransScript Uni All-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Remo-val)(北京全式金生物技术有限公司,AU341),Perfectstart Green qPCR SuperMix(北京全式金生物技术有限公司,AQ601)。
主要仪器:体视显微镜(蔡司Stemi 2000),荧光定量PCR仪器(罗氏LightCycler48)。
1.2 斑马鱼卵母细胞的采集
挑选性成熟(腹部饱满)的雌性斑马鱼,用质量浓度为168 mg/L的三卡因溶液麻醉后置于冰上,解剖取出其两侧的卵巢并转移到L-15培养基中。用外科镊将卵巢分散,再使用5 mL无菌巴氏吸管对卵母细胞轻轻吹打,分离出单个卵母细胞。使用L-15培养基清洗后,将卵母细胞放在培养基中待用。
1.3 冷冻保护剂的配制
冷冻保护剂的基础配方为:1.5 mol/L甲醇+5.5 mol/L二甲基亚砜+0.5 mol/L蔗糖。根据文献[9,11-12],在基础配方上分别添加褪黑素(0、1×10-3、1×10-5、1×10-7 mol/L)、谷胱甘肽(0、5×10-4、2×10-3、4×10-3 mol/L)和甜菜碱(0、1×10-3、1×10-4、1×10-5 mol/L)制备成含有不同浓度抗氧化剂的冷冻保护液。
预平衡溶液:1.5 mol/L甲醇+2.75 mol/L二甲基亚砜,稀释液为90%的L-15培养基。
1.4 卵母细胞的冷冻与复苏
将卵母细胞分装进2 mL冻存管中,加入500 μL预平衡溶液。室温预平衡15 min后,将预平衡溶液吸出,分别加入各浓度的冷冻保护剂200 μL,静置90 s后,放进液氮中冷冻。24 h后,将冻存管从液氮中取出,迅速在28 ℃水浴条件下解冻30 s。待玻璃化液解冻后,迅速将卵母细胞转移到离心管中,采用三步平衡法,依次在1.00、0.50、0.25 mol/L的蔗糖溶液中分别平衡1、3、5 min,再用L-15培养基洗涤2~3遍。
1.5 斑馬鱼卵母细胞存活率的检测
将4种冻存方案的卵母细胞解冻,每种取5管重复,每管取出至少100颗卵母细胞,加0.4%台盼蓝染色5 min。使用显微镜观察、拍照、计数,其中被染色的卵母细胞判定为死细胞,未被染色的细胞为活细胞,根据以下公式计算存活率。
细胞存活率=未染色细胞数/细胞总数×100%(1)
1.6 斑马鱼卵母细胞ROS含量和T-AOC水平检测
将4种冻存方案冻存的卵母细胞解冻,每种取3管重复,按质量(g)∶体积(mL)=1∶6加入预冷的0.5 mol/L Tris-HCl,进行匀浆。在4 ℃下以 3 500 g 离心10 min,用预冷的PBS缓冲液将上清稀释100倍,检测总蛋白浓度。在白色不透光酶标板的每个孔内加入20 μL样品,再加180 μL浓度为 10 μmol/L的DCFH-DA(ROS荧光探针),28 ℃孵育2 h。使用488 nm激发波长、525 nm发射波长进行检测,参照标准曲线计算ROS含量。
将4种冻存方案冻存的卵母细胞解冻,每种取3管重复,按质量(g)∶体积(mL)=1∶4加入PBS缓冲液,进行匀浆。在4 ℃下以3 500 g 离心10 min,取上清,按照总蛋白(TP)和T-AOC检测试剂盒说明书检测T-AOC水平。
1.7 斑马鱼卵母细胞ATP和SDH水平检测
将4种冻存方案冻存的卵母细胞解冻,每种取3管重复,按质量(g)∶体积(mL)=1∶6加入预冷的裂解液,进行匀浆。在4 ℃下以12 000 g离心5 min,取上清待测。按照ATP、总蛋白定量(TP)试剂盒说明书检测ATP含量。
将4种冻存方案冻存的卵母细胞解冻,每种取3管重复,按质量(g)∶体积(mL)=1∶9加入预冷的PBS缓冲液,进行匀浆。在4 ℃以2 500 g离心10 min,取上清待测。按照SDH、总蛋白定量(TP)试剂盒说明书检测SDH活性。
1.8 凋亡相关基因表达检测
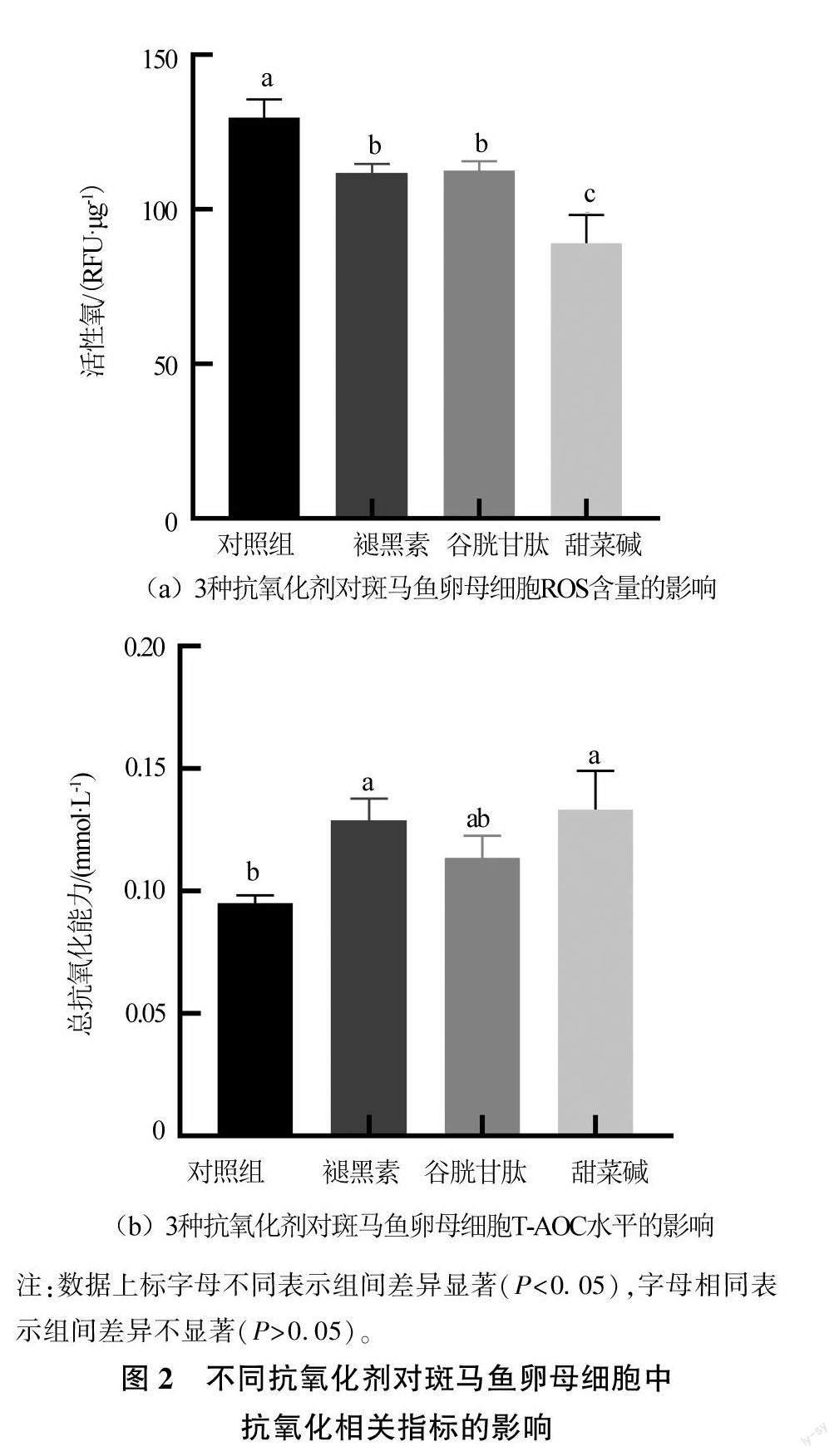
将4种冻存方案冻存的卵母细胞解冻,每种取3管重复,采用TRIzol法提取斑马鱼卵母细胞的总RNA,使用反转录试剂盒将总RNA反转成cDNA后,进行qPCR扩增。在NCBI网站设计凋亡相关基因引物(见表1)。以β-actin为内参,用相对定量方法(2-△△Ct)进行数据分析。
1.9 数据分析
试验数据以(平均值±标准差)表示,采用SPSS Statistics 26.0软件统计进行数据分析,采用单因素分析方法(one-way ANOVA)检验分析不同组别之间的显著差异性,设显著性水平为0.05。
2 结果和分析
2.1 不同抗氧化剂最优浓度的筛选
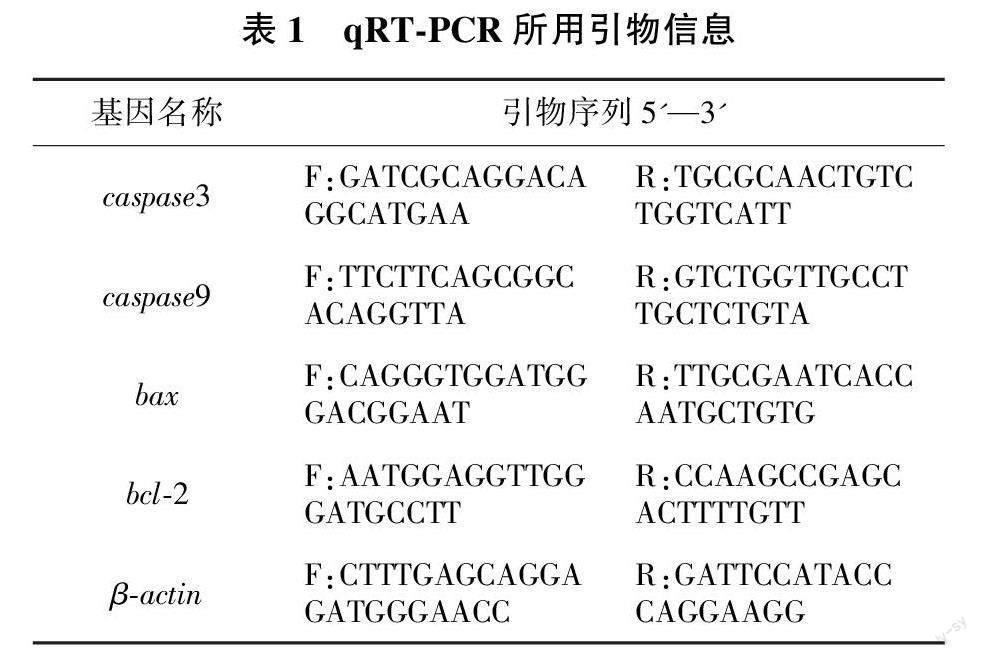
由图1可见,与对照组(未添加组)相比,褪黑素添加浓度为1×10-3、1×10-5和1×10-7 mol/L的试验组均可显著提高卵母细胞的存活率(P<0.05),3个组的存活率分别为(84.04±1.45)%、(84.30±4.01)%和(87.88±2.55)%,分别提高了6.58%、6.84%和10.42%,但3个组间差异不显著(P>0.05)。谷胱甘肽添加浓度5×10-4、2×10-3 mol/L的试验组均可显著提高卵母细胞的存活率(P<0.05),与对照组相比分别提高了8.48%和7.60%,其中5×10-4 mol/L组卵母细胞的存活率最高,为(89.18±4.70)%。添加浓度1×10-3 mol/L甜菜碱的试验组可显著提高卵母细胞的存活率(P<0.05),其存活率为(85.88±8.75)%,与对照组相比提高了11.16%。试验结果显示,上述3种抗氧化剂均可以提高冻存斑马鱼卵母细胞的存活率,其最优添加浓度分别为褪黑素1×10-3 mol/L,谷胱甘肽5×10-4 mol/L,甜菜碱1×10-3 mol/L。
2.2 不同抗氧化剂对冻存卵母细胞ROS含量和T-AOC水平的影响
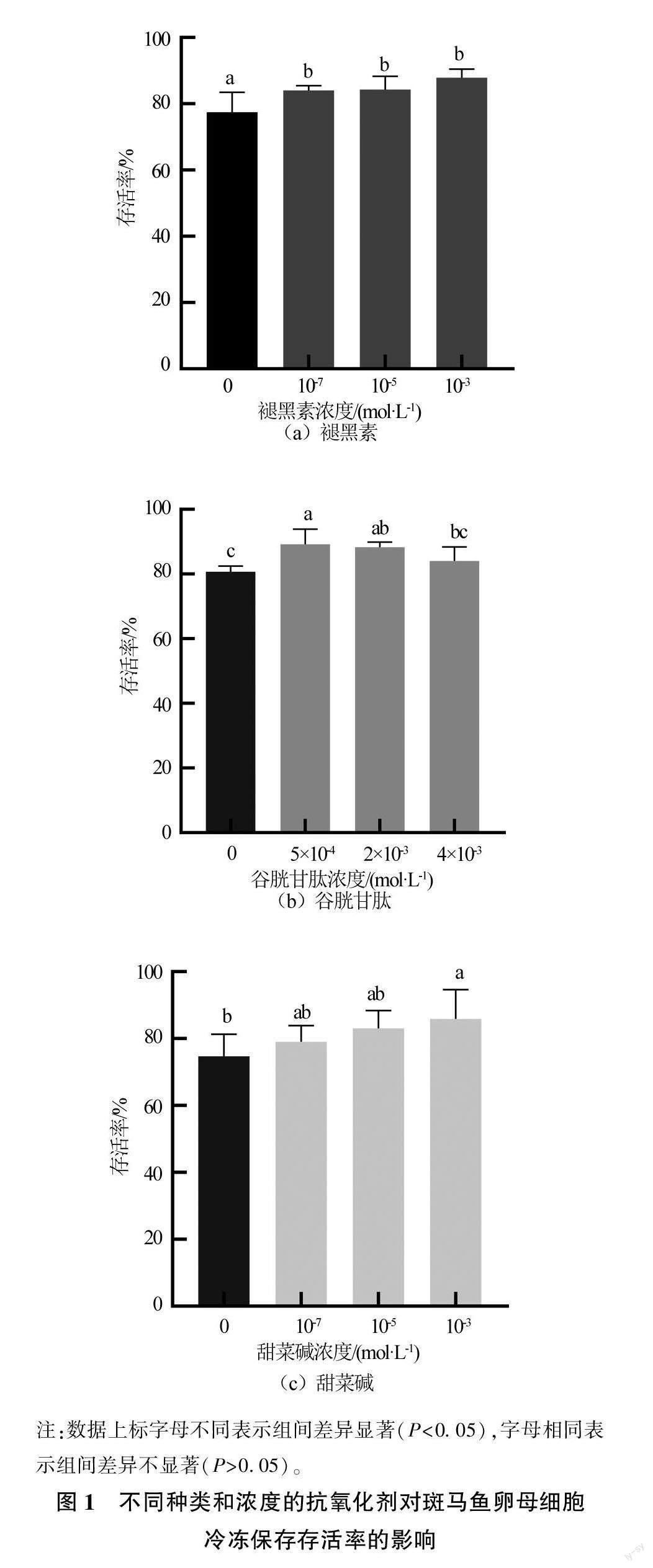
由图2可见,与对照组相比,添加褪黑素、谷胱甘肽、甜菜碱这3种抗氧化剂均可显著降低卵母细胞的ROS含量(P<0.05),3个添加组的ROS含量分别为(111.86±2.76)、(112.58±2.93)、(88.11±9.04)RFU/μg,分别降低了13.72%、13.17%、31.27%。褪黑素和甜菜碱可以显著提高卵母细胞的T-AOC水平(P<0.05),其T-AOC分别为(0.129±0.009)、(0.133±0.016)mmol/L,与对照组相比分别提高约35.79%、40.00%。
2.3 抗氧化剂对冻存卵母细胞ATP含量和SDH活性的影响
由图3可见,与对照组相比,添加褪黑素、谷胱甘肽、甜菜碱3种抗氧化剂均可显著提高斑马鱼卵母细胞的ATP含量,其中褪黑素组的ATP含量最高(P<0.05),3个添加组的ATP含量分别为(5 515.74±1 189.94)、(4 086.64.62±369.72)、(3 717.11±167.18)nmol/mg,分别比对照组提高了140.98%、78.54%、62.40%。褪黑素、谷胱甘肽、甜菜碱3种抗氧化剂均可显著提高斑马鱼卵母细胞的SDH活性(P<0.05),3个添加组的SDH活性分别为(14.70±0.89)、(15.44±0.10)、(13.64±0.27)U/mg,分别比对照组提高了20.39%、26.45%、11.71%。
2.4 抗氧化剂对冻存卵母细胞凋亡相关基因表达的影响
由图4可见,与对照组相比,褪黑素组斑马鱼卵母细胞的凋亡相关基因caspase3、caspase9和bax的表达量显著下降,bcl-2表达量显著上升(P<0.05);谷胱甘肽组斑马鱼卵母细胞的凋亡基因caspase3表达量显著下降,bcl-2表达量显著上升(P<0.05);甜菜碱组斑马鱼卵母细胞的凋亡相关基因caspase9和bax的表达量显著下降(P<0.05)。
2.5 抗氧化剂对复苏后卵母细胞体外培育过程中存活率的影响
由图5可见,复苏后的卵母细胞在体外培育30 min,褪黑素、谷胱甘肽、甜菜碱添加组卵母细胞的存活率分别为(76.02±1.28)%、(75.69±1.58)%、(76.35±3.57)%,3个添加组之间没有显著差异(P>0.05);体外培育60 min后,谷胱甘肽、甜菜碱组卵母细胞的存活率分别为(72.62±3.32)%、(73.28±1.88)%,显著高于对照组(P<0.05),分别比对照组提高了5.26%、5.92%;体外培育120 min后,褪黑素、谷胱甘肽、甜菜碱添加组卵母细胞的存活率分别为(43.37±4.59)%、(47.44±3.00)%、(49.23±3.31)%,均显著高于对照组(P<0.05),分别比对照组提高了10.13%、14.20%、15.99%。
2.6 抗氧化剂对斑马鱼卵母细胞长期冻存存活率的影响
由图6可见,与对照组相比,添加褪黑素、谷胱甘肽、甜菜碱均可显著提高玻璃化冻存1 d、7 d、30 d、60 d、90 d后的卵母细胞的存活率(P<0.05)。冻存1 d后,褪黑素、谷胱甘肽、甜菜碱组卵母细胞的存活率分别为(89.32±0.62)%、(89.19±1.93)%、(89.20±1.29)%,分别提高了4.98%、4.85%、4.86%;冻存7 d后,上述3组的存活率分别为(78.60±0.51)%、(74.37±2.95)%、(76.18±2.94)%,分别提高了16.54%、12.31%、14.12%;冻存30 d后,上述3组的存活率分别为(56.60±5.19)%、(58.58±4.07)%、(60.55±0.51)%,分别提高了7.88%、9.86%、11.83%;冻存60 d后,上述3组的存活率分别为(48.74±3.37)%、(46.00±4.59)%、(48.42±4.16)%,分别提高了10.18%、7.44%、9.86%;冻存90 d后,上述3组的存活率分别为(34.66±2.47)%、(32.95±3.59)%、(32.29±2.89)%,分别提高了9.05%、7.34%、6.68%。
3 讨论
褪黑素、谷胱甘肽和甜菜碱等抗氧化劑已在人、小鼠、水貂、猪、猫等动物配子的冷冻保存中得到应用,但在鱼类卵母细胞冷冻保存研究中尚未见相关报道[3,6-11]。本试验在斑马鱼卵母细胞冷冻保存和体外培育过程中分别添加1×10-3 mol/L的褪黑素、5×10-4 mol/L的谷胱甘肽和1×10-3 mol/L的甜菜碱,结果发现,3种浓度的抗氧化剂均可显著提高复苏后的卵母细胞在体外培育120 min和长期冻存1、7、30、60、90 d的存活率。试验结果说明,在鱼类卵母细胞冷冻保存过程中加入抗氧化剂同样能改善保存效果,该方法在鱼类卵母细胞冷冻保存中具有应用前景。
本试验结果显示,在冷冻保存过程中分别添加褪黑素、谷胱甘肽或甜菜碱可以显著降低卵母细胞的ROS含量;褪黑素和甜菜碱组斑马鱼卵母细胞的T-AOC水平显著升高。以上结果与褪黑素用于人卵母细胞冷冻保存[7]和甜菜碱用于猫卵泡冷冻保存[11]中的研究结果相一致。这说明上述抗氧化剂可以清除细胞内的自由基,提高抗氧化酶的活性,对降低冷冻引起的卵母细胞氧化损伤有一定的保护作用。
本试验结果显示,在冷冻保存过程中添加褪黑素、谷胱甘肽或甜菜碱可以显著提高斑马鱼卵母细胞的ATP含量和SDH活性。线粒体数量减少和活性降低会导致卵母细胞发育障碍,影响其成熟、受精及早期胚胎发育,而线粒体的功能通常可以由ATP含量和SDH活性来反映[13-14]。有研究发现,在小鼠GV卵母细胞和人卵母细胞冷冻保存过程中加入褪黑素,能够保护线粒体功能,提高ATP含量[15-16]。本研究结果表明,在鱼类卵母细胞冻存中,添加褪黑素等抗氧化剂均可以增强其线粒体功能,促进ATP的产生,进而提高冻存效率。
本试验结果显示,在冷冻保存过程中添加褪黑素、谷胱甘肽后,卵母细胞的caspase3表达量显著降低;添加褪黑素、甜菜碱后,caspase9表达量显著降低;添加褪黑素、甜菜碱后,bax表达量显著降低;添加褪黑素、谷胱甘肽后,bcl-2表达量显著提高。上述结果与Shirzeyli等[17]在冷冻保存中添加抗氧化剂可以降低bax/bcl-2比率和caspase3的mRNA相对表达量、降低细胞凋亡的结果相一致。有研究表明,冷冻损伤会对线粒体功能造成负面影响,并且启动相关凋亡通路,线粒体损伤能够诱导细胞凋亡[18]。线粒体在细胞凋亡中通过释放caspases激活因子,使caspase活化,最终使蛋白质裂解和细胞解体死亡[19],同时,BCL-2家族蛋白,包括抗凋亡bcl-2成员和促凋亡bax成员等通过相互作用来调节线粒体的外膜通透性,控制线粒体向细胞质释放的细胞死亡信号分子[20]。本试验表明,所用的3种抗氧化剂可改善线粒体功能,减少细胞凋亡,与添加3种抗氧化剂后斑马鱼卵母细胞ATP含量上升的试验结果相符。
综上所述,在冷冻保存和体外培育斑马鱼卵母细胞时,在基础冷冻保护液配方中添加1×10-3 mol/L的褪黑素或5×10-4mol/L的谷胱甘肽或1×10-3 mol/L的甜菜碱,能减少细胞氧化损伤,改善线粒体功能,降低细胞凋亡水平,从而提升卵母细胞的存活率。上述3种抗氧化剂均可提高斑马鱼卵母细胞冷冻保存的存活率,且三者的存活率较为接近。抗氧化相关指标显示,甜菜碱表现出最佳的抗氧化效果;线粒体功能相关指标显示,褪黑素对于卵母细胞线粒体的保护作用最为明显。综合来看,3种抗氧化剂可能通过不同的机制对斑马鱼卵母细胞的冷冻保存起到了改善作用。本研究揭示了褪黑素、谷胱甘肽、甜菜碱作为鱼类卵母细胞冷冻保护剂的可能性,为卵母细胞的冷冻保存提供了新的思路。
参考文献
[1]GUAN M,RAWSON D M,ZHANG T.Cryopreservation of zebrafish(Danio rerio) oocytes using improved controlled slow cooling protocols[J].Cryobiology,2008,56(3):204-208.
[2]ZHANG T,RAWSON D M,TOSTI L,et al.Cathepsin activities and membrane integrity of zebrafish(Danio rerio) oocytes after freezing to -196 ℃ using controlled slow cooling[J].Cryobiology,2008,56(2):138-143.
[3]MOUSSA M,舒娟,张雪洪,等.哺乳动物卵母细胞和胚胎冷冻保存研究进展:现存问题与未来展望[J].中国科学:生命科学,2014,44(7):663-675.
[4]陈松林.鱼类配子和胚胎冷冻保存研究进展及前景展望[J].水产学报,2002,26(2):161-168.
[5]TRAPPHOFF T,HEILIGENTAG M,SIMON J,et al.Improved cryotolerance and developmental potential of in vitro and in vivo matured mouse oocytes by supplementing with a glutathione donor prior to vitrification[J].Molecular Human Reproduction,2016,22(12):867-881.
[6]魏巧莉,房晓欢,曹慧,等.褪黑素对卵母细胞成熟和胚胎体外发育影响的研究进展[J].中国畜牧杂志,2017,53(9):4-7.
[7]ZHANG Z G,MU Y Q,DING D,et al.Melatonin improves the effect of cryopreservation on human oocytes by suppressing oxidative stress and maintaining the permeability of the oolemma[J].Journal of Pineal Research,2021,70(2):12707.
[8]吳大平.不同抗氧化剂对地中海水牛精液冷冻保存效果的影响研究[D].南宁:广西大学,2017.
[9]MOAWAD A R,TAN S L,TAKETO T.Beneficial effects of glutathione supplementation during vitrification of mouse oocytes at the germinal vesicle stage on their preimplantation development following maturation and fertilization in vitro[J].Cryobiology,2017,76:98-103.
[10]郜磊.两性离子分子甜菜碱在间充质干细胞冷冻保存中的应用研究[D].天津:天津大学,2020.
[11]BRITO D C C,DOMINGUES S F S,RODRIGUES A P R,et al.Betaine-loaded CaCO3 microparticles improve survival of vitrified feline preantral follicles through higher mitochondrial activity and decreased reactive oxygen species[J].Reproduction,Fertility,and Development,2020,32(5):531-537.
[12]ZHANG Y,LI W,MA Y S,et al.Improved development by melatonin treatment after vitrification of mouse metaphase II oocytes[J].Cryobiology,2016,73(3):335-342.
[13]VAN B J.Mitochondria as regulatory forces in oocytes,preimplantation embryos and stem cells[J].Reproductive Biomedicine Online,2008,16(4):553-569.
[14]方春钱.还原型谷胱甘肽和L-精氨酸防治糖尿病心脏损伤及其线粒体机制的研究[D].镇江:江苏大学,2010.
[15]WU Z Z,PAN B,QAZI I H,et al.Melatonin improves in vitro development of vitrified-warmed mouse germinal vesicle oocytes potentially via modulation of spindle assembly checkpoint-related genes[J].Cells,2019,8(9):1009.
[16]ZHU Q,DING D,YANG H,et al.Melatonin protects mitochondrial function and inhibits oxidative damage against the decline of human oocytes development caused by prolonged cryopreservation[J].Cells,2022,11(24):4018.
[17]SHIRZEYLI M H,EINI F,SHIRZEYLI F H,et al.Assessment of mitochondrial function and developmental potential of mouse oocytes after mitoquinone supplementation during vitrification[J].Journal of the American Association for Laboratory Animal Science,2021,60(4):388-395.
[18]FULDA S.Alternative cell death pathways and cell metabolism[J].International Journal of Cell Biology,2013,2013:463637.
[19]左錢飞,张海献,鲁鹏飞.线粒体损伤与检测方法研究进展[J].科学之友(B版),2009(6):5-6.
[20]DANIAL N N.BCL-2 family proteins:critical checkpoints of apoptotic cell death[J].Clinical Cancer Research:an Official Journal of the American Association for Cancer Research,2007,13(24):7254-7263.
Comparison of the effects of three antioxidants on the cryopreservation of zebrafish oocytes
HUANG Kejia , CAI Xinqing , GUO Bingyu , ZHANG Quangen3, ZHANG Junfang , HAN Bingshe
(1. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,
Ministry of Education,Shanghai Ocean University,Shanghai 201306,China;
2. National Demonstration Center for Experimental Fisheries
Science Education,Shanghai Ocean University,Shanghai 201306,China;
3. Shanghai Dianyuan Aquatic Seed Farm,Shanghai 201722,China)
Abstract: To investigate the effects of antioxidants on the cryopreservation of zebrafish oocytes,melatonin,glutathione and betaine were added to the basic cryoprotective solution in this study.The antioxidant capacity,mitochondrial function,expression of apoptosis-related genes and survival rate were tested.The results showed that the optimal concentration of the three antioxidants were melatonin 1×10-3 mol/L,glutathione 5×10-4 mol/L,and betaine 1×10-3 mol/L.ATP content and SDH activity were significantly increased in the three experimental groups(melatonin group,glutathione group and betaine group) supplemented with the optimal concentration of antioxidants,while ROS content was significantly decreased(P<0.05).The level of T-AOC in betaine and melatonin groups significantly increased(P<0.05).The expression of caspase3,caspase9 and bax genes in melatonin group significantly decreased,while the expression of bcl-2 significantly increased(P<0.05).The expression of caspase3 in glutathione group was significantly decreased,while the expression of bcl-2 was significantly increased.The expression of caspase9 and bax in betaine group was significantly decreased.The survival rate of oocytes in melatonin,glutathione and betaine groups increased by 10.13%,14.20% and 15.99%,respectively after 120 min vitro incubation.After 1,7,30,60 and 90 days of cryopreservation,the survival rate of oocytes in three experimental groups were significantly higher than that of the control group.After 90 days of cryopreservation,the survival rate was increased by 9.05%,7.34% and 6.68%,respectively.The results indicated that the addition of antioxidants melatonin,glutathione and betaine during zebrafish oocyte cryopreservation could protect mitochondrial function,reduce oxidative damage and cell apoptosis,and improve the quality of zebrafish oocytes.
Key words: cryopreservation; oocyte; zebrafish; antioxidant; melatonin; glutathione; betaine
