超声引导下微波消融联合贝伐珠单抗治疗晚期结肠癌伴肝转移的临床价值
2024-04-09韩小军郭道宁
韩小军 袁 理 郭道宁
结肠癌是常见的消化道肿瘤,近年来其发病率和死亡率均逐渐升高。据流行病学研究[1]统计,我国近十余年结肠癌发病和死亡平均年增长率约为4%。肝转移是导致结肠癌患者死亡的重要原因,约20%的结肠癌患者确诊时伴肝转移,约50%的结肠癌患者在病情进展过程中发生肝转移[2]。晚期结肠癌伴肝转移患者由于错失最佳手术治疗窗口期,多选择姑息治疗[3]。贝伐珠单抗在多种晚期癌症治疗中效果良好,通过竞争性抑制血管内皮生长因子,影响肿瘤细胞的增殖、迁移,延缓肿瘤生长和转移速度[4]。研究[5]证实贝伐珠单抗联合一线化疗方案可提高结肠癌晚期患者中位无进展生存时间和总生存时间。但全身化疗方案因受细胞毒性影响,难以达到肿瘤根治效果,临床应用受限[6]。微波消融技术创伤小,消融范围可达病灶边缘,在超声引导下应用对晚期结肠癌伴肝转移患者有一定的局部治疗效果,具有潜在的应用价值[7]。本研究应用超声引导下微波消融联合贝伐珠单抗治疗晚期结肠癌伴肝转移患者,旨在探讨其临床应用价值。
资料与方法
一、研究对象
选取2018年6月至2021年6月在我院就诊的102例晚期结肠癌伴肝转移患者,按随机数字表法分为观察组和对照组各51例。观察组中男29例,女22例,年龄40~67 岁,平均(53.24±6.37)岁,体质量45~72 kg,平均(58.41±6.83)kg;结肠癌发生部位:左半结肠29 例,右半结肠22 例;单发肝转移16 例,多发肝转移35 例(转移灶数目≤3个24例,>3个11例);转移灶最大径5~8 cm,平均(6.02±0.43)cm。对照组中男27 例,女24 例,年龄39~68 岁,平均(53.19±6.56)岁,体质量44~71 kg,平均(57.62±6.18)kg;结肠癌发生部位:左半结肠26 例,右半结肠25 例;单发肝转移18 例,多发肝转移33 例(转移灶数目≤3个21例,>3个12例);转移灶最大径5~7 cm,平均(5.86±0.71)cm。两组一般资料比较差异均无统计学意义。纳入标准:①经病理证实为晚期结肠癌伴肝转移[8];②肿瘤原发于结肠;③首次转移为肝转移;④无相关药物禁忌症。排除标准:①其他恶性肿瘤伴肝转移;②腺瘤性息肉或黑色素瘤;③多发肝转移者病变灶数目>8 个;④不适合行微波消融治疗;⑤凝血功能异常。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.仪器与试剂:使用GE Logiq E9、E11 彩色多普勒超声诊断仪,凸阵探头,频率2.5~6.5 MHz;KY-2000微波消融治疗仪(南京康友微波能应用研究所),工作频率2450 MHz。造影剂使用SonoVue(意大利Bracco公司),按说明书方法配制成混悬液备用。
2.治疗方法:对照组采用贝伐珠单抗联合常规化疗治疗,具体为:第1天,贝伐珠单抗(苏州盛迪亚生物医药有限公司,国药准字:S20210020)7.5 mg/kg,静脉滴注90 min;奥沙利铂(成都长青制药有限公司,国药准字:H20020648)130 mg/m2,静脉滴注2 h;卡培他滨(齐鲁制药有限公司,H20143365)1000 mg/m2,口服,每日2次。治疗2 周后间隔1 周再进入下一疗程。观察组在对照组基础上采用微波消融治疗,患者取仰卧位,术前通过超声定位转移灶,若常规超声显示效果不理想,可采用融合成像技术,利用人工腹水改善图像质量,获取病灶准确位置再行消融治疗(图1)。然后于患者全身麻醉下行超声引导下微波消融治疗,选择工作模式消融病变组织,直至超过病灶边缘0.5~1.0 cm。术后局部消毒并敷贴创面,即刻行超声造影确认转移灶完全消融(即门脉期、动脉期、延迟期均无增强)。两组均治疗4个疗程。
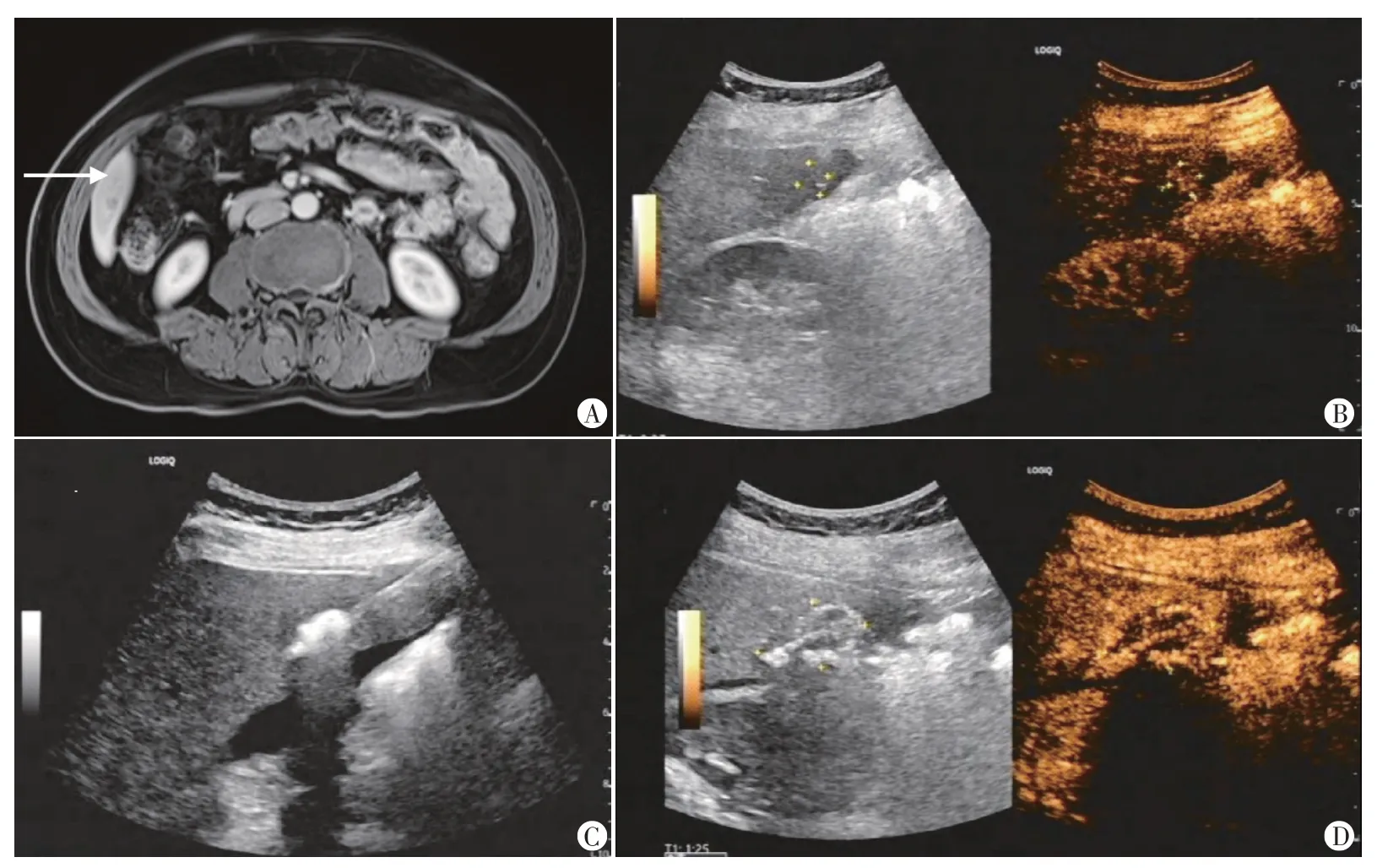
图1 人工腹水辅助消融示意图
3.观察内容:①疗效,其判定标准[9]为:转移灶完全消失判为完全缓解(CR);转移灶直径总和减小≥30%判为部分缓解(PR);转移灶直径总和增加≥20%或出现新的癌变部位判为疾病进展(PD);未出现新的转移灶,介于PR 与PD 之间判为疾病稳定(SD);比较两组疾病控制率(DCR)和客观缓解率(ORR),DCR=(CR 例数+PR 例数+SD 例数)/总例数×100%,ORR=(CR 例数+PR 例数)/总例数×100%。②免疫学指标:比较治疗前后两组CD3+、CD4+、CD8+及CD4+/CD8+的差异。③不良反应:比较两组胃肠道反应、食欲减退、疲劳乏力、贫血、骨髓抑制等发生情况。④预后情况:通过电话或门诊复查等方式进行随访,截止日期为2022 年12 月,以失访、复发、死亡为随访终点,记录两组无复发生存时间和总生存时间,采用Kaplan-Meier 生存曲线分析累积无复发生存率及累积总生存率。
三、统计学处理
应用SPSS 24.0 统计软件,计量资料以±s表示,采用t检验;计数资料以例或率表示,采用χ2检 验 或Fisher 确 切概率法。绘制Kaplan-Meier 生存曲线分析两组累积无复发生存率及累积总生存率,采用对数秩检验。P<0.05 为差异有统计学意义。
结 果
治疗后,观察组中33 例完全消融,余18 例消融不全,完全消融率为64.71%。见图2。
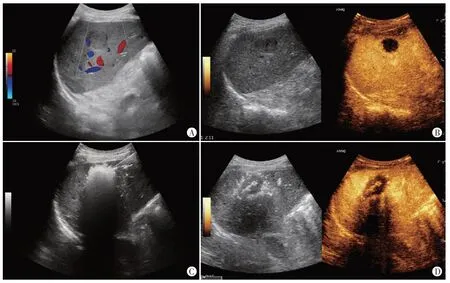
图2 结肠癌伴肝转移(男,53岁)超声引导下微波消融示意图
一、两组超声引导下微波消融后疗效比较
治疗后,观察组CR、PR、SD、PD 分别为7、14、16、14 例,ORR 为41.18%(21/51),DCR 为72.54%(37/51);对照组CR、PR、SD、PD 分别为2、9、14、26 例,ORR 为21.57%(11/51),DCR 为49.02%(25/51);两 组ORR 和DCR 比 较 差 异均有统计学意义(χ2=4.554、5.923,P=0.033、0.015)。观察组单发肝转移ORR、DCR 均高于对照组,差异均有统计学意义(均P<0.05);两组多发肝转移ORR、DCR 比较差异均无统计学意义。见表1。
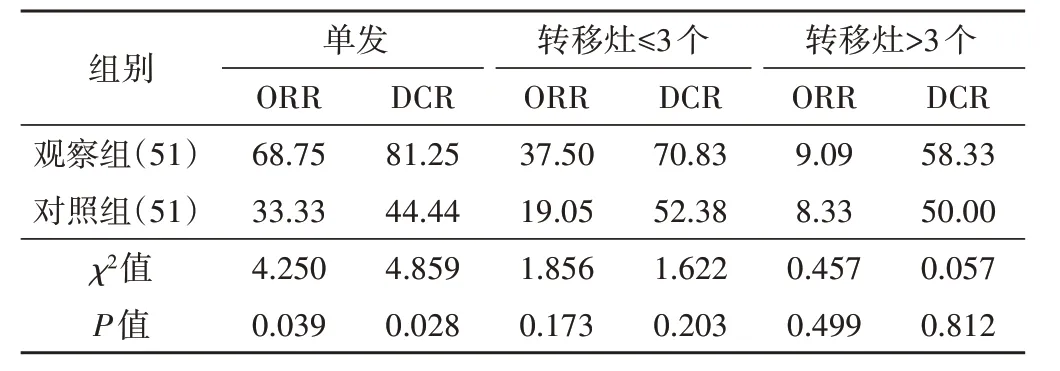
表1 两组不同数目肝转移微波消融后疗效比较 %
二、两组免疫学指标比较
治疗前两组免疫学指标比较差异均无统计学意义;治疗后两组CD3+、CD4+、CD8+均较治疗前下降,且观察组CD3+、CD4+、CD4+/CD8+均高于对照组,CD8+低于对照组,差异均有统计学意义(均P<0.05)。见表2。
表2 两组免疫学指标比较(±s)
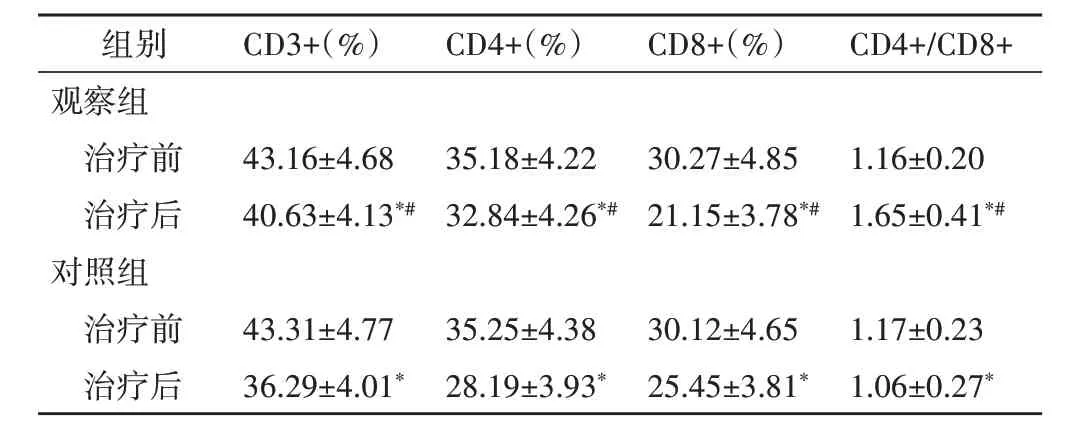
表2 两组免疫学指标比较(±s)
与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
组别观察组治疗前治疗后对照组治疗前治疗后CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+43.16±4.68 40.63±4.13*#35.18±4.22 32.84±4.26*#30.27±4.85 21.15±3.78*#1.16±0.20 1.65±0.41*#1.17±0.23 1.06±0.27*43.31±4.77 36.29±4.01*35.25±4.38 28.19±3.93*30.12±4.65 25.45±3.81*
三、两组不良反应比较
两组胃肠道反应、食欲减退、疲劳乏力等不良反应比较差异均无统计学意义。见表3。
表3 两组不良反应比较 例
四、两组预后情况比较
观察组随访3~41个月,累积无复发生存率及累积总生存率分别为78.77%、57.45%;对照组随访3~35 个月,累积无复发生存率及累积总生存率分别为49.32%、34.23%;两组比较差异均有统计学意义(χ2=10.086、4.536,P=0.001、0.033)。见图3。
图3 两组Kaplan-Meier生存曲线图
讨 论
文献[10]报道,全球每年新增约140 万例结肠癌患者,约有70万例结肠癌患者死亡,导致医疗负担较重。结肠癌是由于饮食习惯引发肠道菌群失衡紊乱,诱导抑癌基因下调和致癌基因表达,导致黏膜上皮细胞癌变的一类疾病。在结肠癌进展过程中,主要通过门静脉和肠系膜上下静脉等血运转移途径,以及浸润淋巴管等淋巴转移途径,实现肿瘤的侵袭转移[11]。结肠癌最常见的远处转移部位是肝脏,约50%的结肠癌患者会发生肝转移,这也是导致患者死亡的主要原因。晚期结肠癌伴肝转移患者因身体状况或其他原因,常选择化疗方案延长生存时间,但常规化疗可能由于药物对转移灶的特异性不足,对非病变部位产生细胞毒性,导致机体出现不良反应,进而影响患者生存时间[12]。近年研究[13]报道可使用微波消融改善晚期结肠癌伴肝转移患者的临床症状,通过增加局部热量使转移灶细胞凝固性坏死和凋亡来缩小病灶体积,为无法行手术切除的患者提供了新的治疗思路。本研究应用超声引导下微波消融联合贝伐珠单抗治疗晚期结肠癌伴肝转移患者,旨在探讨其临床应用价值。
本研究结果显示,观察组治疗后ORR、DCR 均高于对照组,差异均有统计学意义(均P<0.05),表明微波消融联合贝伐珠单抗治疗效果较好。分析原因为:超声引导下可以实时、准确地获取转移灶位置,通过高频电磁场直接作用于细胞中水分子等物质,利用其在电磁场中的运动特性,相互摩擦产生热量,局部短时间达到60℃左右高温,引发DNA 变性,使转移灶组织发生凝固性坏死,消除肿瘤细胞[14],与化疗联合发挥协调治疗作用。但本研究两组治疗后多发肝转移ORR、DCR 比较差异均无统计学意义,可能与原发病灶分期、肝转移灶大小等因素有关[15]。
免疫系统是机体抵御肿瘤和感染的重要屏障,患者免疫功能低下时,肿瘤进展加快,治疗后复发的风险更高[16]。CD3+为成熟淋巴细胞,CD4+为辅助T 细胞,两者均可反映抗肿瘤免疫能力;CD4+/CD8+为机体免疫调节的重要指标,可反映免疫损伤情况。本研究结果显示,治疗后观察组CD3+、CD4+、CD4+/CD8+均高于对照组,CD8+低于对照组,差异均有统计学意义(均P<0.05);提示超声引导下微波消融联合贝伐珠单抗可以明显缓解患者免疫功能抑制状态。分析原因为:术前应用超声造影评估转移灶大小、位置及与周围组织结构关系,通过微波消融短时间热效应快速消融肿瘤组织直至转移灶边缘,肿瘤坏死后碎片还能诱导正常细胞表达热休克蛋白,诱导T 细胞产生免疫反应增强抗原的表达,能够在一定程度上提升机体免疫系统抗肿瘤能力[17]。
为进一步明确超声引导下微波消融联合贝伐珠单抗治疗晚期结肠癌伴肝转移的临床价值,本研究对两组生存情况进行分析,结果显示观察组累积无复发生存率及累积总生存率均高于对照组,差异均有统计学意义(均P<0.05),与既往研究[18]结果一致,提示超声引导下微波消融联合贝伐珠单抗可以明显改善患者生存情况。分析原因为:单一化疗治疗时,虽然在药物作用下肿瘤血管生成被抑制,肿瘤因失去营养供应而停止生长,但并不能完全消除肿瘤细胞,复发风险较大;超声引导下微波消融可以直接对病灶肿瘤细胞进行清除,阻止肿瘤进展,降低复发风险,提高无复发生存率。另外,对于常规超声成像不理想的病例可以通过融合成像技术和人工腹水改善成像质量,其中人工腹水还实现了肝脏肿瘤部位与周围组织器官的隔离,进一步减小了微波消融对其他器官热损伤的风险。本研究两组胃肠道反应、食欲减退、疲劳乏力等不良反应比较差异均无统计学意义,提示微波消融联合贝伐珠单抗具有良好的安全性。
综上所述,超声引导下微波消融联合贝伐珠单抗治疗晚期结肠癌伴肝转移患者疗效显著,可缓解免疫功能抑制,改善生存情况,安全性良好,具有较好的临床应用价值。但本研究样本量较小,所得结果可能存在偏倚,后续研究将扩大样本量进一步分析。
