小檗碱在结直肠癌治疗中的作用机制研究进展
2024-04-09张明玥韦珊珊耿一婷胡文蔚
张明玥,夏 玮,韦珊珊,耿一婷,胡文蔚,
1.常州市第一人民医院,苏州大学第三附属医院肿瘤科,江苏 常州 213003
2.江苏省肿瘤免疫治疗工程技术研究中心,江苏 常州 213003
结直肠癌(colorectal cancer,CRC)是世界上第3 大常见的恶性肿瘤,癌症相关死亡率位居世界第2 位[1],手术、化疗、免疫和靶向治疗为常用的治疗手段,但存在肿瘤复发率高、患者生存质量低、治疗不良反应大及耐药等问题。因此,寻找新的抗肿瘤药物至关重要。近年来,植物化合物被证实可以延缓肿瘤生长,并具有与传统治疗的化学药物类似的作用机制[2],逐渐成为抗肿瘤治疗的手段之一。
小檗碱(berberine,C20H18NO4+)是一种从小檗科、毛茛科、芸香科等天然植物中提取的季胺型异喹啉类生物碱,含小檗碱类植物黄连的医学价值最早被记录在公元200 年的《神农本草经》,用于糖尿病、胃肠炎、多囊卵巢综合征等疾病治疗[3-4]。自1999年起[5],小檗碱对CRC 的抗肿瘤作用逐渐被确立,并在临床治疗中卓越的成绩,在天津医科大学附属天津总医院消化内镜中心的7 例患者中,以300 mg小檗碱每天3 次的服用方式使用6 个月后,取得了良好的肿瘤抑制效果[6]。另外,小檗碱的制备成本低廉、获取途径方便,具有良好的安全性和耐受性,有希望成为抑制CRC 进展的临床用药。
本文从细胞周期与增殖、上皮-间充质转化(epithelial mesenchymal transition,EMT)与迁移、自噬与凋亡、代谢与菌群、炎症与氧化等方面,总结小檗碱在CRC 中的抗肿瘤作用机制,为小檗碱的临床用药提供参考依据。
1 小檗碱抑制CRC 细胞周期与增殖
WNT 通路是调控细胞周期的主要通路之一,对于CRC 的发生和发展有重要意义,WNT 受体和配体结合、β-catenin 表达水平和β-catenin/ T 细胞因子(T cell factor,TCF)转录复合物的形成是级联反应的关键节点,小檗碱可通过多种途径抑制WNT 通路活性。在HCT116、RKO、DLD1 和Caco2 细胞系中,小檗碱通过调控葡萄糖代谢的形式,抑制固醇调节元件结合蛋白裂解激活蛋白(SREBP cleavage-activating protein,SCAP)/胆固醇调节元件结合蛋白1(sterol regulatory element binding protein-1)诱导的游离脂肪酸(free fatty acids,FFA)生成,并减少表面标记为CD9、CD63 和肿瘤易感基因101(tumor susceptibility gene 101,TSG101)的胞外小泡的产生和分泌,从而抑制WNT 通路[7-8]。针对WNT 通路下游β-catenin 相关的转录激活途径,在HT29 细胞系中,30 µmoL/L 小檗碱通过下调基因间长链非编码RNA(large intergenic noncoding RNA,lincRNA)表达以减少β-catenin 表达[9],并在一项处理浓度为10 µmoL/L 的研究中发现,小檗碱还通过抑制β-catenin 的核易位过程[10],以减少细胞核内βcatenin 表达;而在KM12C 细胞核内,12.5~25µmoL/L 小檗碱与视黄醇X 受体α(retinoid X receptor α,RXRα)特异性结合,不仅提高了RXRα的下游靶基因叉头框蛋白O3(forkhead box O3,FOXO3A)和环氧化酶-2(cyclooxygenase 2,COX2)等因子的转录活性,而且增强了RXRα 与β-catenin的结合;在此过程中,小檗碱还通过激活的RXRα途径和促进E3 泛素连接酶(Cbl proto-oncogene,c-Cbl)的核易位方式增强c-Cbl 的表达,导致βcatenin 与c-Cbl 的相互作用增强以促进β-catenin的降解[11];最终抑制了β-catenin/TCF 转录复合物的形成,导致下游细胞周期相关基因转录失活[11],诱导细胞周期阻滞。
其中,细胞周期蛋白D1(Cyclin D1)是细胞周期G1过渡至S 期的关键事件。小檗碱对Cyclin D1的调控,不仅通过抑制WNT/β-catenin 的信号通路,还通过影响其他通路作用以抑制Cyclin D1 表达。研究发现,在HCT116 和SW480 细胞系中,25~100 µmoL/L 小檗碱可以抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)/磷酸激酶B(protein kinase B,AKT)通路以抑制Cyclin D1 表达,具体表现为小檗碱通过直接与胰岛素样生长因子II mRNA 结合蛋白3(insulin like growth factor II mRNA binding protein 3,IGF2BP3)的Glu93、Trp94和Glu476 相互作用的方式,和增强三联基元21(tripartite motif containing 21,TRIM21)与IGF2BP3结合的方式以促进 IGF2BP3 降解,从而干预PI3K/AKT 通路[12];在SW480 细胞中,1~9 µmoL/L小檗碱可以抑制NOTCH 通路以上调蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTEN)蛋白,进而抑制PI3K/AKT 通路[13]。另外,在HT29 和HCT116 细胞系中,2.5~10 µmoL/L 小檗碱与M2型丙酮酸激酶(pyruvate kinase M2,PKM2)的I119和F244 结合并促进PKM2 泛素化,导致信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)的Y705 位点磷酸化减少,进而抑制Cyclin D1 表达[14]。近期也有研究指出,在HT29 和SW480 细胞系中,小檗碱通过下调音猬因子(sonic hedgehog,SHH)、补缀同源物1(patched homolog 1,PTCH1),上调融合同源物抑制因子(suppressor of fused homolog,SUFU)的表达以抑制旁分泌Hedgehog 通路,进而影响Cyclin D1 表达[15-17]。
小檗碱除了影响信号通路传导以抑制细胞增殖外,有研究在10~40 µmoL/L 小檗碱处理的HCT116和HT29 细胞系中发现,小檗碱不仅通过抑制βcatenin/TCF 下游的肥胖基因相关蛋白(fat mass and obesity-associated protein,FTO)启动子的转录激活,而且下调甲基转移酶样蛋白3(methyltransferase like 3,METTL3)和上调Wilms 肿瘤蛋白1 相关蛋白(Wilms’tumor 1 associating protein,WTAP)等因子以影响FTO m6A 甲基化,进而抑制细胞干性以影响细胞增殖[18]。在SW620 和HCT116、CT26 细胞系中分别发现,100 µmoL/L 和50 µmoL/L 小檗碱通过末端堆叠、凹槽或环结合模式、π-π 叠加的方式,分别与Kirsten 大鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene,KRAS)和C-髓细胞增生原癌基因(C-myelocytomatosis viral oncogene homolog,C-MYC)的启动子G-四联体结合,以降低其mRNA及蛋白表达[19-20]。而且在HCT116 细胞系中,10.54µmoL/L 小檗碱下调端粒酶逆转录酶(telomerase reverse tranase,TERT)mRNA 和端粒酶基因(telomerase RNA component,TERC)以缩短端粒长度[21],减少细胞DNA 复制及寿命(图1)。

图1 小檗碱抑制结直肠癌细胞的细胞周期和增殖Fig.1 Berberine inhibits cell cycle and proliferation of colorectal cancer cells
因此,小檗碱对CRC 细胞的增殖作用影响涉及多方面,主要抑制WNT/β-catenin、PI3K/AKT、PKM2/STAT3、Hedgehog 等通路以影响细胞周期相关转录因子表达,进而促进细胞周期阻滞,还可以通过抑制细胞干性、直接结合KRAS 和C-MYC 等原癌基因和影响端粒长度,抑制细胞增殖。
2 小檗碱抑制CRC 细胞EMT 与迁移
EMT 是指上皮细胞逐渐失去上皮表型,获得间质性细胞的特征,与细胞侵袭、迁移有关,是肿瘤进展和转移的关键机制。小檗碱可以上调E-钙黏附蛋白(epithelial cadherin,E-cadherin),下调波形蛋白(vimentin)以及α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)以抑制细胞EMT 进程,抑制基质金属蛋白酶 13 ( matrix metalloproteinases-13,MMP13)、表皮调节素(epiregulin,EREG)和黏蛋白16(mucin 6,MUC6)以抑制CRC 细胞迁移。
转化生长因子β(transforming growth factor β,TGF-β)/果蝇母本抗生存因子蛋白(small mother against decapentaplegic,Smad)是影响肿瘤细胞EMT过程的关键通路,在肿瘤早期呈现抑癌作用,在晚期反而会促进肿瘤发展。在肿瘤相关成纤维细胞CCD-18Co 培养基诱导的结肠上皮细胞HCoEpiCs中,25~100 µmoL/L 小檗碱下调TGF-β 受体Ⅰ(TGF-β receptor Ⅰ,TβRI)、TβRⅡmRNA 表达,抑制Smad2、Smad3、Smad4 表达水平及其磷酸化[22];而另有研究显示,在SW480 细胞培养基诱导的结肠上皮细胞HCoEpiCs 中,同样剂量的小檗碱上调了p ‐Smad3及Smad4 的表达,因此推测小檗碱介导的抗EMT 作用与Smad3、Smad4 无关[23];实验结果的差异考虑与细胞培养基有关,也表明小檗碱对TGF-β 通路的影响还需进一步研究,但目前结果均显示,小檗碱可以调控TGF-β 通路以抑制EMT。
小檗碱对肿瘤细胞迁移的影响还与其他蛋白调控有关,在HT29、HCT116 和HCT8 细胞系中,12.5µmoL/L 小檗碱通过上调早幼粒细胞白血病锌指蛋白(promyelocytic leukemia zinc finger,PLZF)表达,增加SCAP 泛素化,从而抑制SCAP/SREBP-1/脂肪酸合成酶(fatty acid synthase,FASN),进而抑制细胞迁移[24],可能与细胞膜骨架重塑有关。另外,在10 ng/ml TGF-β1 处理的鼠源性CRC 细胞中,105 µg 小檗碱可通过增加 DNA 甲基转移酶 1(DNA methyltransferase 1,DNMT1)、DNMT3A、DNMT3B和小分子核糖核酸152(micro RNA 152,miR-152)、miR-429、miR-29a 的表达,从而下调α-SMA 水平[25]。在HCA27 细胞中,30~100 µmoL/L 小檗碱可剂量依赖性下调EMT 相关的钙/钙调素依赖性蛋白激酶Ⅱ(Ca/calmodulin dependent protein kinase Ⅱ,CaMKⅡ)和细胞运动有关的四分子交联体 13(transient overexpression lysate of tetraspanin 13,TSPAN13)[26]。而在100~200 mg/kg 小檗碱处理4 周的荷瘤小鼠CRC 转移灶中发现,小檗碱可以与Hairy相关分解基因(Hairy/enhancer of split related with yrpw motif 2,HEY2)的HIS-99 基团形成氢键结合以下调HEY2 表达,并上调E-cadherin[27](图2)。

图2 小檗碱抑制结直肠癌细胞的EMT 过程和迁移Fig.2 Berberine inhibits EMT process and migration of colorectal cancer cells
因此,小檗碱对于细胞分化、迁移功能的影响,主要涉及TGF-β 和脂质代谢、DNA 复制等功能,还与转移灶中的HEY2 表达有关,具体调控机制有待深入探讨。
3 小檗碱促进CRC 细胞的凋亡与自噬
细胞自噬和凋亡之间存在错综复杂的关系,是细胞程序性死亡的重要方式。小檗碱可明显促进多种CRC 细胞系的凋亡及自噬增加,多体现在下调抗凋亡蛋白 B 细胞白血病/淋巴瘤-2(B cell lymphoma-2,Bcl-2)等表达,上调凋亡蛋白(Bcl-2-associated X,Bax)、多聚腺苷二磷酸核糖聚合酶[Poly (ADP-ribose) Polymerase,PARP]、活化的半胱氨酸的天冬氨酸蛋白水解酶-3(cleaved cysteinyl aspartate specific proteinase-3,c-Caspase-3)、c-Caspase-9,并增加3 型天然淋巴细胞Ⅱ(group 3 innate lymphoid cell Ⅱ,ILC3-Ⅱ)/ILC3-I 的值,促进自噬小体生成。
Bcl-2 蛋白家族的成员是内在线粒体凋亡途径的关键调节因子,与细胞凋亡密切相关。在HT29 和HCT116 细胞系中,小檗碱可以通过上调细胞质中长链非编码RNA 癌易感性候选基因2(long noncoding RNA cancer susceptibility candidate 2,lncRNA CASC2),增强lncRNA CASC2 与RNA 结合蛋白AU 结合因子1(AU rich element RNA binding factor 1,AUF1)结合以抑制AUF1与Bcl-2mRNA 的结合[28];并通过上调的lncRNA CASC2 以促进调味增强子同源物2(enhancer of zeste homolog,EZH2)表达,增加EZH2 与Bcl-2 启动子的结合[29],进而破坏Bcl-2 的翻译稳定性。在患者类器官模型、CCD-18Co 诱导的结肠上皮细胞HCoEpiCs 细胞和CRC患者的手术标本中分别证实,小檗碱也可能通过抑制PKM2/STAT3、TGF-β/Smad 信号通路,下调Bcl-2 表达[14,23,30]。针对Bcl-2 的下游蛋白Caspase 家族,在HCT116、CACO2 和HCT115 细胞系中,小檗碱可通过抑制miR-21[31]、上调miR-515-5p[32]、miR-429 和miR-497-5p[33],促进Caspase-3 的表达。另外,有研究在1~10 mg/kg 饲养4 周的HCT116 荷瘤小鼠中证实,小檗碱可以破坏线粒体释放细胞色素C(cytochrome C)[34],诱导Caspase-3、Caspase-9 上调。
热休克蛋白(heat shock protein,HSP)是存在于细胞内的重要分子伴侣蛋白,具有维持细胞内外环境稳态、调节细胞凋亡的作用。有研究在1~9µmoL/L 小檗碱处理的SW480 细胞和5~10 mg/kg小檗碱处理3 周的HCT116 荷瘤小鼠等实验中证明,小檗碱可抑制Hsp90、组蛋白去乙酰化酶(histone deacetylase,HDAC)、PI3K 和雷帕霉素机械靶蛋白(mechanistic target of rapamycin,mTOR)蛋白,以发挥其促凋亡能力[14,35]。另外,在HCT116、DLD1 和HepG2 细胞中,50~350 µmoL/L 小檗碱可通过上调转录激活因子6(recombinant activating transcription factor 6,ATF6)mRNA 水平、抑制Hsp 70 成员之一的葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)的泛素化,并且促进GRP78 与空泡分选蛋白34(vacuolar protein sorting 34,Vps34)的结合,促进细胞自噬[36];但是,也有研究表明,50~100 µmoL/L 小檗碱处理SW480 细胞系后,细胞膜及细胞内的GRP78 下调[37]。因此,在不同CRC细胞系中,小檗碱对GRP78 的影响暂无法统一,但均导致自噬能力增加(图3)。

图3 小檗碱促进结直肠癌细胞的凋亡和自噬Fig.3 Berberine promotes apoptosis and autophagy of colorectal cancer cells
因此,小檗碱可通过促进lncRNA CASC2 表达和抑制PKM2/STAT3、TGF-β/Smad、PI3K/mTOR 信号通路影响细胞凋亡和自噬,还涉及lncRNA、microRNA 和HSP 的调控。
4 小檗碱影响CRC 细胞代谢与肠道菌群
肠道代谢与菌群与肠道屏障、先天免疫和肠道修复功能息息相关,与饮食、运动、吸烟、饮酒、药物等环境因素有关,小檗碱可通过改善肿瘤细胞代谢和恢复肠道菌群以抑制CRC 进展。
缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是HIF-1 的氧调节亚基,具有强大的促血管生成作用并促进氧气向细胞运输,是糖酵解过程的关键蛋白。已有研究证实,在HCT116 细胞中,50 µmoL/L 小檗碱直接与HIF-1α 的G-四联体结合[19],并通过抑制mTOR 的磷酸化以抑制HIF-1α 蛋白的表达,进一步抑制葡萄糖转运蛋白1(glucose transporter 1,GLUT1)、乳酸脱氢酶A(lactate dehydrogenase A,LDHA)和己糖激酶2(hexokinase 2,HK2)mRNA 水平,导致细胞的葡萄糖摄取率降低[38];而且,有实验在6.25~25 mg/kg小檗碱处理3 周的HCT116 荷瘤小鼠中证实,小檗碱通过下调 HIF-1α、上调鸟氨酸脱羧酶抗酶(ornithine decarboxylase antizyme 1,OAZ1),进而降低肿瘤组织中D-乳酸的含量[39]。
小檗碱还通过其他途径参与葡萄糖代谢过程。有实验结合2.5~10 µmoL/L 小檗碱处理的HT29 和HCT116 细胞系、5~10 mg/kg 小檗碱喂养4 周的HT29 荷瘤小鼠证实,小檗碱通过改变PKM2 空间结构以抑制其表达,进而抑制乳酸、丙酮酸生成[14];在CACO2、LOVO 等细胞系中,20~40 µmoL/L 小檗碱也降低了柠檬酸合酶(citrate synthase,CS)、线粒体翻译延伸因子Tu(mitochondrial Tu translation elongation factor,TUFM)、线粒体核糖体蛋白L11(mitochondrial ribosomal protein L11,MRPL11)等蛋白的表达,调控三羧酸循环等系统[40-41];
脂质是构成细胞骨架的主要结构,也是功能信号传导和细胞活动的主要能量来源,脂质代谢紊乱可帮助肿瘤生长和发展。小檗碱除了通过调控HIF-1α 以抑制多胺类物质生成[39],在HT29、HCT116 和HCT8 细胞中,12.5 µmoL/L 小檗碱上调PLZF 泛素酶以促进SCAP 的降解[24];并在DLD1 和 Caco-2 细胞系中进一步验证,6.25µmoL/L 小檗碱可通过抑制SCAP 从内质网向高尔基体的易位,进而影响SREBP-1 与SCAP 的结合,以抑制SREBP-1 的激活和核易位[8];而且在HCT116 和RKO 细胞系中,2.5~5 µmoL/L 小檗碱可激活腺苷酸活化蛋白激酶(adenosine 5’monophosphate activated protein kinase,AMPK)的Thr172 位点和乙酰辅酶A 羧化酶(acetyl CoA carboxylase,ACC)的Ser79 位点磷酸化[7],从而抑制下游FASN 和ATP-柠檬酸裂解酶(ATP citrate lyase,ACL)等脂肪生成酶的表达,抑制FFA 和三酰甘油(triglyceride,TG)的生成。
菌群影响着肠道内营养物质吸收、免疫防御功能、肠上皮化生等方面,菌群失调通过毒性代谢物累积、诱导慢性炎症、抑制免疫等方面参与CRC 的发展。有实验通过基于微生物功能的PICRUSt 分析100 mg/kg 小檗碱处理HCT116 荷瘤小鼠粪便发现,小檗碱上调了糖代谢相关功能和短链脂肪酸(short chain fatty acid,SCFA)相关菌群的浓度[42-43]。表现为在门水平上,厚壁菌门和放线菌门的丰度恢复,以及拟杆菌门、变形菌门和疣微菌门的增生抑制,在属水平上,拟普雷沃氏菌属、黄曲霉属和颤杆菌克有关SCFA 生成的菌群,以及乳杆菌科等有益菌群的丰度恢复,和紫单胞菌科、杜氏乳杆菌、另枝菌属等潜在致病菌的增长抑制。有研究通过基于BugBase的表型分析8 mg/kg 小檗碱处理HT29 荷瘤小鼠粪便显示,小檗碱上调了革兰阴性菌、兼性菌、需氧菌的表达,并下调了革兰阳性菌、厌氧菌的水平[16,42-48](图4)。
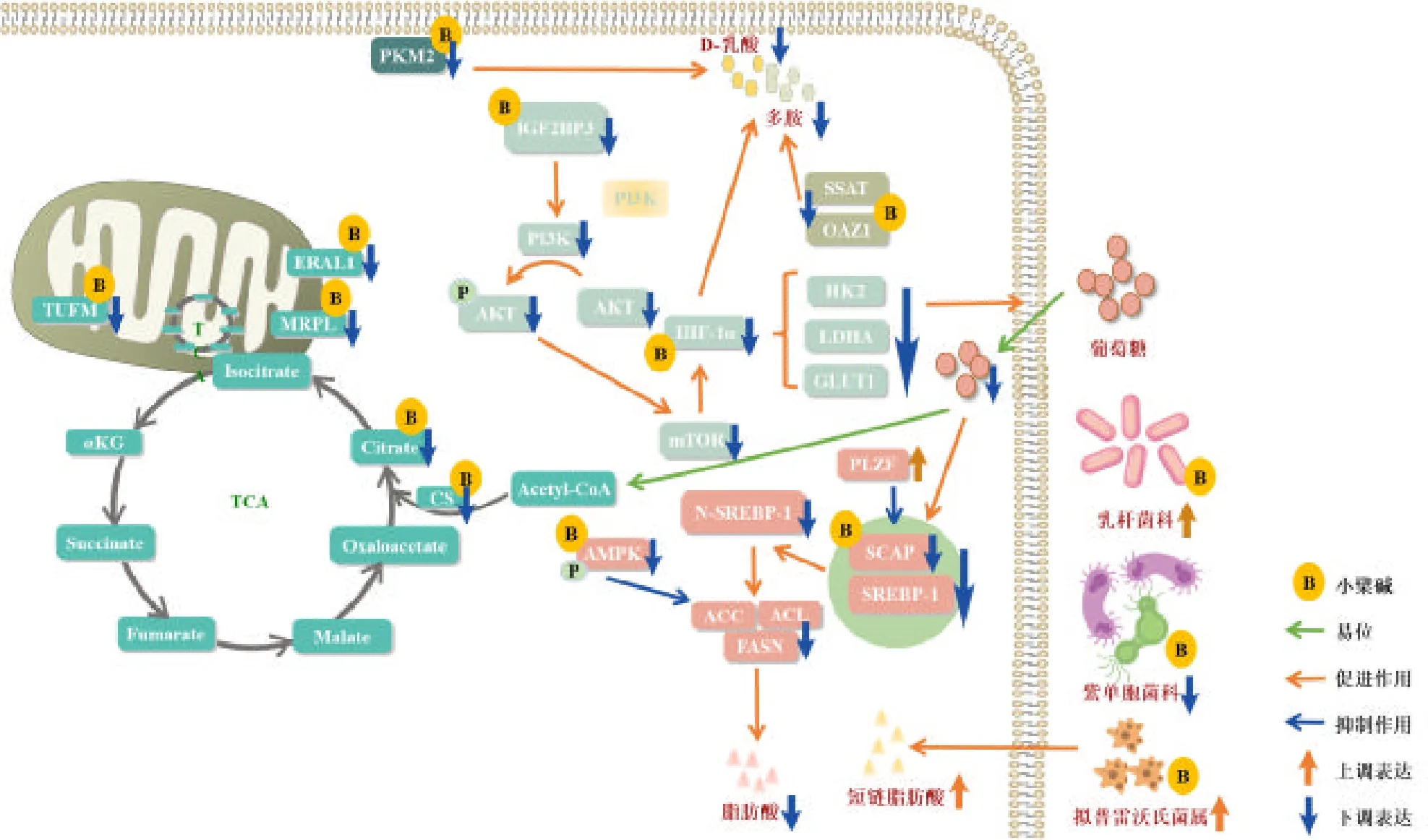
图4 小檗碱影响结直肠癌的细胞代谢和肠道菌群Fig.4 Berberine affects cell metabolism and intestinal flora in colorectal cancer
因此,小檗碱可以改善CRC 患者的细胞代谢和肠道菌群恢复,表现为抑制CRC 细胞的葡萄糖摄取、减少FFA、TG 生成、增加SCFA,但对于氨基酸代谢影响研究较少。而且,对于小檗碱对肠道菌群多样性的影响还没有统一意见,可能原因是实验数据不足,再或者是小檗碱在减少条件致病菌种类的同时,促进了益生菌群的丰富,导致的多样性变化差异,但均显示,小檗碱也可以通过恢复肠道菌群丰度,增加益生菌/致病菌的比例,促进肠道环境恢复。
5 小檗碱抑制细胞炎症与氧化
炎症反应是机体对刺激的自主防御反应并分泌炎症相关因子,可以促进机体修复和损伤修复,但当炎症长期存在时,会逐渐演变成慢性炎症并促进肿瘤形成。有研究在105~210 mg/kg 小檗碱处理2周的AOS/DSS 小鼠和100 mg/kg 小檗碱处理14 周的AOS/DSS 小鼠中证实,小檗碱在影响菌群丰度的同时,也抑制白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等转录因子表达[40],并在50 mg/kg 小檗碱处理的DSS 诱导ApcMin/+小鼠中进一步证明,小檗碱抑制c-Jun 氨基末端激酶(C-JunNterminal kinase,JNK)、STAT3、表皮生长因子受体(epidermal growth factor receptor,EGFR ) 和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化,并降低趋化因子配体 1 [chemokine (C-X-C Motif) ligand 1,Ccl1]、Ccl8 等炎症指标[46-49]。
氧化应激是指细胞受到刺激后的氧自由基与氧还原系统失衡,生成大量活性氧(reactive oxygen species,ROS),引起DNA 损伤。小檗碱对于氧化应激诱导的DNA 损伤恢复作用机制,通过不同的小鼠模型展示。在细胞培养基中加入多环芳烃B[a]P 后,可见5 µmoL/L 小檗碱降低ROS、TNFα和解耦蛋白2(uncoupling protein 2,UCP2)mRNA表达,破坏了三者间的相互影响,降低了肿瘤细胞团的形成[50]。在75 mg/kg 小檗碱处理10 周的1,2-二甲基肼(1,2-dimethylhydrazine,DMH)构建的DNA 甲基化小鼠中,小檗碱可下调髓过氧化物酶(myeloperoxidase,MPO)、COX 等氧化物酶类表达,并上调谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)等还原酶类表达,恢复DMH 对结肠黏膜造成的杯状细胞丢失、层状结构紊乱等损伤[51]。在腺病毒感染的偶氮甲烷/硫酸葡聚糖钠盐(azoxymethane/dextran sulfate,AOM/DSS)小鼠中,28 mg/kg 小檗碱处理5 周可以上调Dicer 表达并降低IL-6 表达,减轻肠道损伤[52]。
因此,小檗碱可以降低炎症趋化相关因子、提高抗氧化自由基清除能力,并修复DNA 损伤,以抑制CRC 进展,对于巨噬细胞等炎症细胞功能影响的研究还没有明确报道,未来有望以此为新的研究方向,深入认识小檗碱对于CRC 的抗炎作用。
6 结语与展望
既往的CRC 治疗方式往往以手术和西药治疗为主,中医药学作为是中国古代科学的瑰宝,至今已有数千年的历史,但由于理论体系不同于西医学,在临床的应用中受到限制。随着科学技术的发展,学者们也可以从分子层面解释中医药学的治疗机制,以期建立中西医结合防治肿瘤的治疗方式。
小檗碱治疗CRC 的作用涉及多种机制(表1),包括细胞周期、分化迁移、凋亡自噬、循环代谢、菌群调节、氧化应激等多方面,但这些研究大多针对小檗碱对肿瘤细胞活性的影响,而对病灶组织免疫细胞的影响作用尚且缺乏报道。目前已有研究发现,小檗碱在肺癌中可以抑制PD-L1 表达以活化T细胞[53],在黑色素瘤中可以调节巨噬细胞介导肿瘤细胞死亡[54]。未来,有望从免疫调节等方面,进一步探索小檗碱对CRC 患者的影响。
为了进一步提高小檗碱的抗肿瘤作用,学者们展开了对小檗碱的结构活性修饰研究,研究位点主要集中于C-8、C-9 和C-13 位置,并提出联合多位点修饰、修饰基团改进等方面拓宽发展空间,现已成功构建13-[CH2CO-Cys (Bzl)-OBzl]-小檗碱[55]、1,13-环化小檗碱[56]、季小檗碱-12-N,N-二甲胺氯[57]、9,13-二取代小檗碱[58]、3,9-二甲氧基-5,6-二氢异喹啉并[3,2-a]异喹啉-7-氯化铵[59],并在体内体外实验中得到验证,但这些结构修饰实验是否可以在临床治疗中获得类似效果,还需探讨。
现已提出小檗碱联合伊立替康、5-氟尿嘧啶等化疗治疗策略,可以有效减轻腹泻、便血等化疗副反应,并有可能改善化疗耐药性[12,58,60]。而小檗碱联合吴茱萸碱、低聚原花青素、穿心莲等其他植物化合物使用时,也可以产生明显的协同作用[7,61-64]。而近年来新起的靶向和免疫治疗受到了药物副反应和作用靶点的局限性,那么小檗碱是否可以联合靶向及免疫治疗,改善患者治疗环境,也是值得探讨的地方。
但是,小檗碱的水溶性差、生物利用度较低(在小肠内的吸收度0.5%,体循环内下降至0.35%)[65],影响肠道吸收效果,目前已提出联合纳米技术(聚合物基、磁性介孔二氧化硅基、石墨烯基等纳米颗粒载体)克服该缺点[66],改善小檗碱药物动力学,但在CRC 的应用研究较少,作用效能及安全性均需更多比对。而且,目前的大部分实验仅停留在体外细胞株和小鼠模型阶段,是否可以在广大患者身上取得普遍性疗效还尚未可知,因此,小檗碱的抗肿瘤作用迫切需要临床实际数据以进一步验证。
利益冲突所有作者均声明不存在利益冲突
