极端高温对截形叶螨体内海藻糖含量及海藻糖转运蛋白基因的影响
2024-04-09罗丽丹陈嘉明安琪刘磊孙勤哲刘欢王森山宋丽雯
罗丽丹,陈嘉明,安琪,刘磊,孙勤哲,刘欢,王森山,宋丽雯
甘肃农业大学植物保护学院/甘肃省农作物病虫害生物防治工程实验室,兰州 730070
0 引言
【研究意义】截形叶螨(Tetranychustruncatus)属蛛形纲(Arachnida)、蜱螨目(Arachnoidea)、叶螨科(Tetranyehidea)、叶螨属(Tetranychus)[1],其寄主广泛,在玉米、棉花、蔬菜等重要作物上危害严重,是我国北方大部分地区的一种重要害螨[2-4]。叶螨个体小、繁殖快、适应性强,且其在高温干旱环境下危害程度加重,给农业生产造成了巨大的经济损失。因此,寻求新的绿色防控策略迫在眉睫。【前人研究进展】随着全球气候变暖,夏季极端气温发生频次增加,田间温度持续升高,尤其在午时瞬时增温通常能达50 ℃[5],这对昆虫(或螨)适应高温环境提出了新的挑战。当昆虫遭遇高温时,通常会通过调节行为或生理生化活动来躲避或降低高温的伤害[6-7]。例如,它们会调节体内抗逆物质以减少高温胁迫产生的危害[8-10]。海藻糖是昆虫体内的主要血糖,占血淋巴中糖分的80%—90%[11]。其不仅在昆虫的生长发育过程中提供能量,也在抵御各种逆境中发挥着重要作用[12-13]。当外界环境或昆虫的营养状况发生变化时,昆虫可通过调节体内血淋巴中的海藻糖浓度来稳定蛋白质构象,保护自身免受逆境影响[14]。海藻糖主要合成部位在脂肪体中[15-16],其不能直接穿过细胞膜,主要依靠特定的海藻糖转运蛋白(trehalose transporter,Tret)在细胞间进行转运。而在较多研究中发现海藻糖转运蛋白Tret1 在海藻糖转运过程中起重要作用[17-19]。Tret1 通过调整昆虫体内海藻糖的分布来抵抗各种逆境,亦直接参与各种抗逆活动,其在昆虫响应环境胁迫中起着重要作用。例如低温能显著提高椭圆食粉螨(Aleuroglyphus ovatus)海藻糖转运蛋白含量,积累海藻糖,且在低温胁迫下,其两个AoTret1显著上调[20];在冈比亚按蚊(Anophelesgambiae)中,AgTret1的表达受干燥和高温的诱导,沉默AgTret1后可降低冈比亚按蚊血淋巴海藻糖水平,使其在干燥或炎热的环境中更易死亡[21]。同样,在高温胁迫下,小菜蛾(Plutella xylostella)体内的PxTret-1表达升高,PxTret-1被敲除后,其脂肪体中海藻糖难以运输至血淋巴中,因此在高温胁迫下,小菜蛾成虫的存活率降低[22]。可见Tret在调节机体应对各种逆境活动中具有重要作用。【本研究切入点】目前关于蛛形纲中Tret的报道较少,Tret1是否在截形叶螨耐受高温环境的胁迫中发挥重要作用尚不明确。【拟解决的关键问题】探究截形叶螨TtTret1-like和TtTret1编码蛋白的理化性质及其在抵抗高温中的功能,为寻找新型杀虫(螨)剂靶点和开发绿色农药提供理论依据。
1 材料与方法
试验于2023年2—10月在甘肃农业大学植物保护学院完成。
1.1 TtTret1-like 和TtTret1 蛋白序列和系统发育分析
基于截形叶螨三代全长转录组测序数据(已上传至NCBI Sequence Read Archive (SRA)数据库,登录号:SRR21659835—SRR21659850),获取两个海藻糖转运蛋白基因TtTret1-like和TtTret1的编码序列。
采用ExPASy(https://web.expasy.org/protparam/)预测TtTret1-like 和TtTret1 的理化性质;ProScale(http://web.expasy.org/protscale/)分析TtTret1-like 和TtTret1 的疏水性/亲水性;Conserved Domain Database(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和TMHMM2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测TtTret1-like 和TtTret1 的跨膜结构域和保守结构域;利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和SWISS-MODEL(http://swissmodel.expasy.org/)预测TtTret1-like 和TtTret1 的二级和三级结构。选取不同物种Tret1 的氨基酸序列,采用MEGA11.0 软件中的邻接法构建 TtTret1-like 和TtTret1 的系统发育树。
1.2 供试螨源
截形叶螨饲养于甘肃农业大学植物保护学院昆虫生态养虫室(温度24—26 ℃,相对湿度55%—65%,光周期16 h∶8 h(L∶D))的盆栽豇豆植株上。采用雌雄单系(一雌一雄)进行扩繁后,挑取龄期一致的卵(2 000 粒)、幼螨(1 000 头)、若螨(500 头)和雌成螨(200 头)于1.5 mL 无酶离心管中,液氮冷冻后,保存于-80 ℃冰箱中备用。
1.3 高温胁迫试验
高温胁迫试验在智能人工气候箱(QRGN-400-3,杭州琦胜电子科技有限公司,中国)内进行,挑取2—3 日龄截形叶螨雌成螨200 头于叶碟上[23],分别置于38、42、46、50 ℃下处理2 h,以25 ℃为对照,每处理设置4 个生物学重复。挑取高温胁迫后的成螨200头于1.5 mL 无酶离心管中,液氮冷冻后,保存于-80 ℃冰箱中备用。
1.4 海藻糖含量测定
采用匀浆法提取截形叶螨的血淋巴[24],参照微量法海藻糖含量试剂盒说明书(上海液质检测技术有限公司)进行海藻糖含量检测。
1.5 截形叶螨总RNA 的提取及cDNA 的合成
用Trizol 法提取不同发育阶段和不同处理下截形叶螨的总RNA,用微量分光光度计测定总RNA 的浓度,选取1.8<ODA260/A280<2.2 的样品,按照宝生物反转录试剂盒说明书进行反转录。转录后的cDNA 保存于-20 ℃冰箱中。
1.6 引物设计
用Primer 6.0 软件设计TtTret1-like和TtTret1的qRT-PCR 引物和dsRNA 引物,选用Actin和RPS18作为截形叶螨qRT-PCR 的内参基因,以dsGFP为对照,具体引物序列见表1。

表1 本研究使用的引物Table 1 Primers used in this study
1.7 TtTret1-like 和TtTret1 的表达分析
采用NovoStart SYBR qPCR SuperMix Plus 试剂盒(Novoprotein Scientific Inc,中国上海)进行检测,qRT-PCR 反应体系10 μL:0.5 µL cDNA 模板,5 µL 2×NovoStart®SYBR qPCR SuperMix Plus,0.5 µL 10 μmol·L-1Sense-Primer , 0.5 µL 10 μmol·L-1AntiSense-Primer,0.2 µL ROX Ⅱ,3.3 µL RNase Free Water。qRT-PCR 程序:(1)95 ℃ 2 min,接着(2)95 ℃ 15 s、60 ℃ 30 s 和95 ℃ 15 s 循环40 次,(3)60 ℃ 1 min、95 ℃ 15 s。每处理4 个模板。具体qRT-PCR 引物序列见表1。
1.8 RNAi
使用dsRNA 引物(表1),PCR 扩增TtTret1-like和TtTret1的目的片段,其在正义链和反义链中均含有T7 启动子区域。以回收的PCR 产物为模板进行连接转化,对转化成功的菌液进行质粒回收。然后使用TranscriptAid T7 高产转录试剂盒制备dsRNA 并纯化。最终的dsRNA 溶解在无酶水中,短暂离心后,使用分光光度计对dsRNA 进行浓度的测定,dsRNA 浓度稀释为1 400 ng·μL-1。
喂食截形叶螨目的基因的dsRNA[25],具体步骤如下:将豇豆叶片切成边长为1.5 cm 的正方形,60 ℃烘箱干燥脱水3 min 后,分别用50 µL 浓度为1 400 ng·μL-1的dsGFP、dsTtTret1-like和dsTtTret1处理叶片1—2 h。完全吸收后,将叶片放在制备好的叶碟上。挑取饥饿处理24 h 的3—5 日龄的70 头雌成螨至处理过的叶片上,每处理3 个重复。饲喂dsRNA 48 h 后,挑取存活的截形叶螨用于qRT-PCR 检测和海藻糖含量测定。并挑取存活的50 头叶螨于新鲜叶碟中,置于50 ℃下处理2 h,进行耐热性测试,每处理3 个重复。以dsGFP作为对照。处理后置于常温进行恢复,每隔12 h 观察并统计其死亡率。
1.9 数据统计与分析
采用Microsoft Excel 2016 统计数据,整理后的数据使用SPSS 23.0 软件进行单因素ANOVA 检验和独立样本t检验。Origin 2018 软件绘图。
2 结果
2.1 TtTret1-like 和TtTret1 生物信息学分析
TtTret1-like和TtTret1的CDS 全长分别为1 389和1 569 bp,分别编码463 和523 个氨基酸,预测蛋白分子量分别为50 189.03 和57 358.10 Da,等电点分别为8.87 和8.70。TtTret1-like 和TtTret1 均为碱性氨基酸和疏水性氨基酸且同属于不稳定蛋白。TtTret1- like 和TtTret1 蛋白均具有12 个跨膜区(图1-A),均具有MFS 超家族的典型结构域(图1-B)。此外,TtTret1-like 和TtTret1 蛋白的二级结构(图1-C)及三级结构(1-D)以螺旋和卷曲为主。
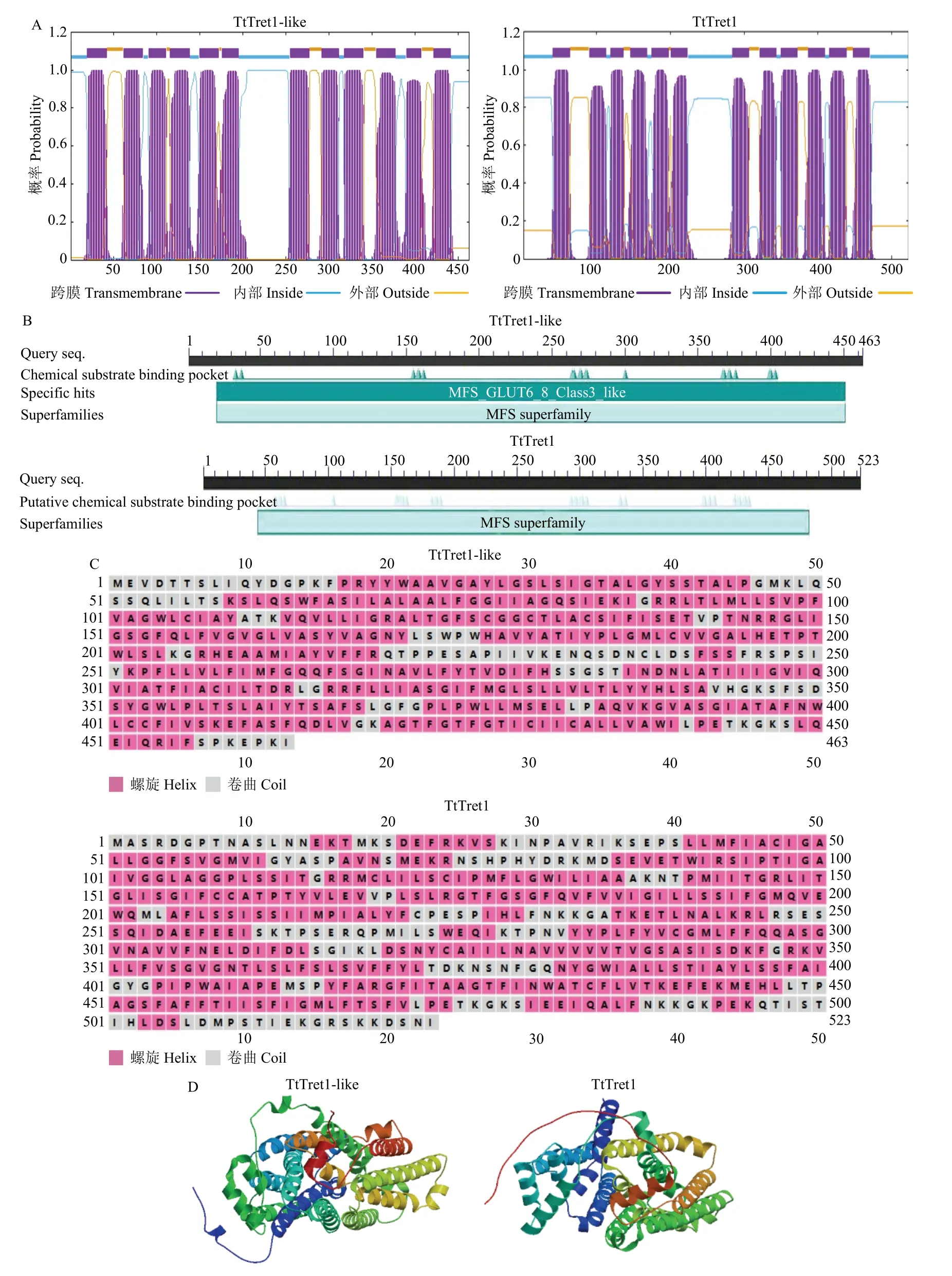
图1 TtTret1-like 和TtTret1 生物信息学分析Fig. 1 Bioinformatics analysis of TtTret1-like and TtTret1
2.2 TtTret1-like 和TtTret1 进化树分析
系统发育分析表明,截形叶螨TtTret1-like 和TtTret1 分别与同属于叶螨属的二斑叶螨TuTret1-like和TuTret1 亲缘关系较近(图2)。

图2 TtTret1-like 和TtTret1 系统发育分析Fig. 2 Phylogenetic analysis of TtTret1-like and TtTret1
2.3 截形叶螨不同发育阶段TtTret1-like 和TtTret1的表达模式
利用qRT-PCR 检测截形叶螨各发育阶段TtTret1-like和TtTret1的相对表达量(图3)。TtTret1-like和TtTret1在截形叶螨各发育阶段均有表达。在卵、幼螨和成螨期,TtTret1-like的表达量无显著差异,但均显著高于若螨期的表达量。TtTret1在幼螨期的表达量最高,其次是成螨期;卵期和若螨期的表达量无显著差异。
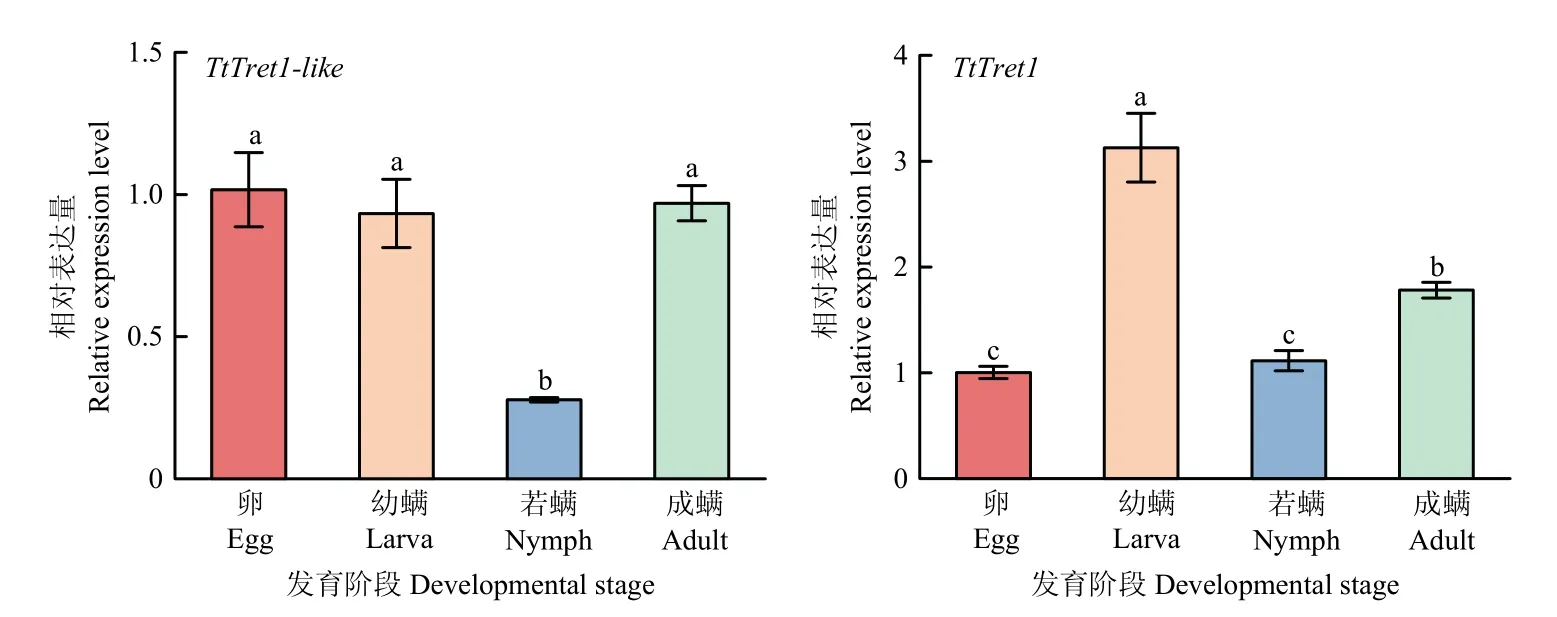
图3 TtTret1-like 和TtTret1 在截形叶螨不同发育阶段的相对表达量Fig. 3 Relative expression level of TtTret1-like and TtTret1 at different developmental stages of T. truncatus
2.4 高温对TtTret1-like 和TtTret1 表达的影响
由图4 可见,各处理组TtTret1-like的表达量均显著高于对照组(25 ℃),且随着温度升高呈上升趋势,在50 ℃表达量最高,为对照组的5.65 倍;TtTret1的表达量随温度的升高先上升后下降,直至趋于对照组水平,其在42 ℃达到最大值,为对照组的5.01 倍。该结果表明高温诱导了截形叶螨TtTret1-like和TtTret1的表达。
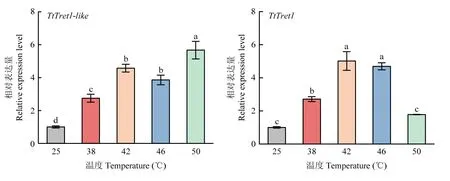
图4 不同高温下TtTret1-like 和TtTret1 的相对表达量Fig. 4 Relative expression level of TtTret1-like and TtTret1 at different high temperatures
2.5 高温对截形叶螨海藻糖含量的影响
海藻糖含量测定结果显示,各高温处理组的截形叶螨体内海藻糖含量均显著高于对照组(图5),其中38、46、50 ℃海藻糖含量最高,表明截形叶螨在应对高温胁迫时可能通过调控海藻糖含量来提高自身耐热性。
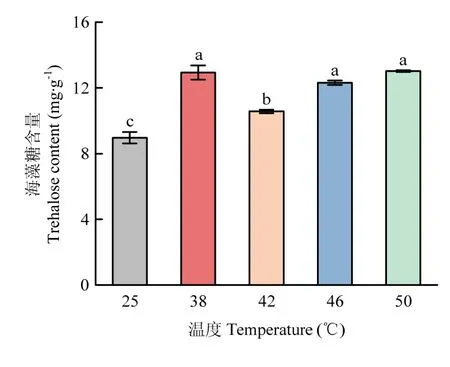
图5 不同高温下截形叶螨的海藻糖含量Fig. 5 Trehalose content of T. truncatus at different high temperatures
2.6 沉默TtTret1-like 和TtTret1 对截形叶螨海藻糖含量的影响
采用qRT-PCR 方法检测饲喂dsRNA 48 h 后TtTret1-like和TtTret1的相对表达量。与对照组dsGFP相比,TtTret1-like和TtTret1的相对表达量均极显著下调(P<0.01),沉默效率分别为78.2%、70.3%(图6-A、6-B),饲喂dsRNA 可有效降低截形叶螨靶标基因的表达。进一步检测了饲喂dsTtTret1-like和dsTtTret148 h 后截形叶螨成螨体内的海藻糖含量。与对照组dsGFP相比,干扰TtTret1-like和TtTret1后截形叶螨体内的海藻糖含量显著增加(图6-C),血淋巴的海藻糖含量显著降低(图6-D)。
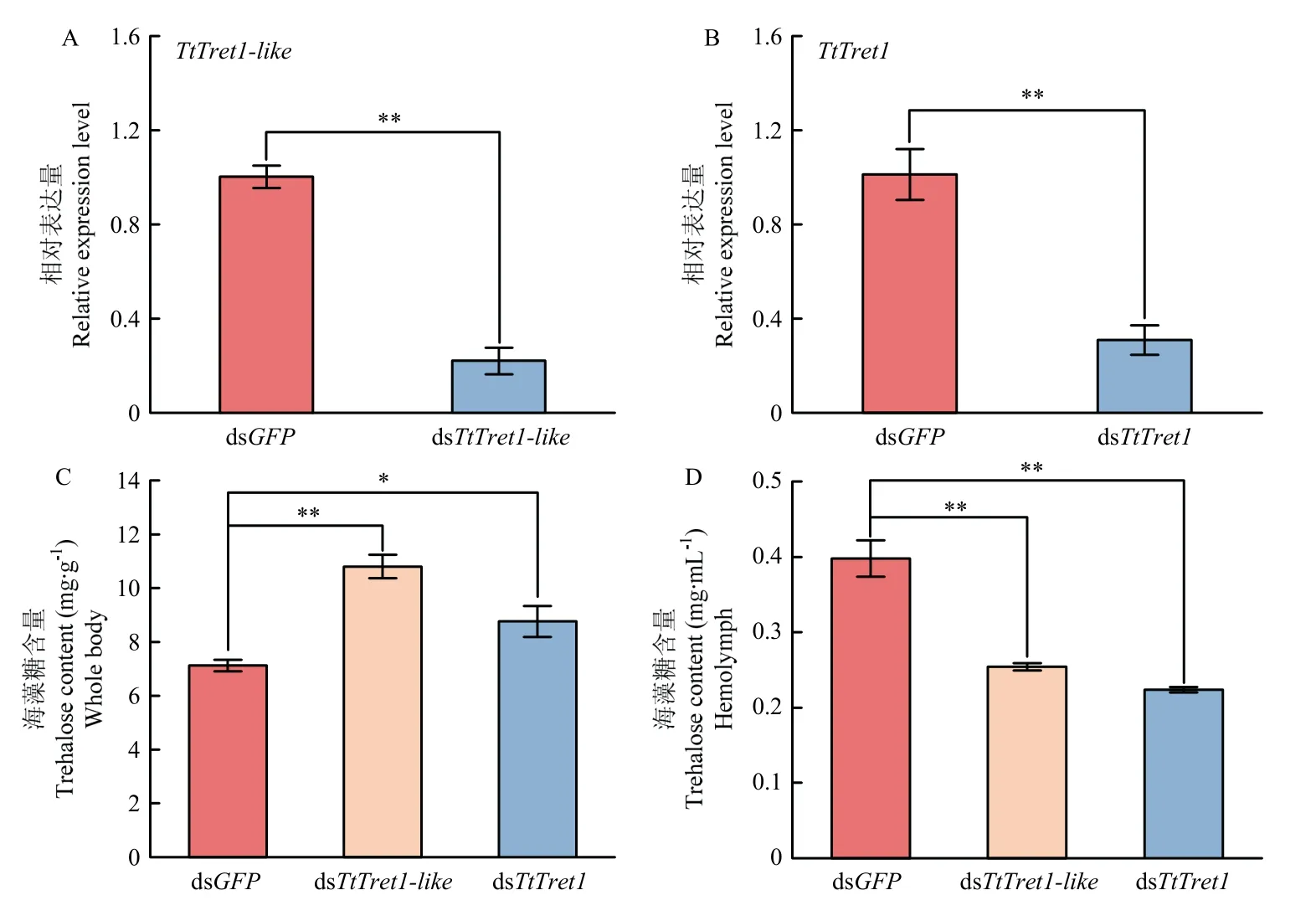
图6 干扰TtTret1-like 和TtTret1 对截形叶螨体内基因表达及海藻糖含量的影响Fig. 6 Effects of interference with TtTret1-like and TtTret1 on gene expression and trehalose content in T. truncatus
2.7 RNAi 对截形叶螨耐热性的影响
由图7 可知,将饲喂dsTtTret1-like和dsTtTret148 h 后的截形叶螨进行高温50 ℃暴露处理2 h,再置于室温,12 h 后,存活率分别为44%和78%,显著低于对照组dsGFP,96 h 后存活率分别为11%和46.67%。表明TtTret1-like和TtTret1在截形叶螨抵御高温胁迫中发挥了重要调节作用。

图7 50 ℃极端温度对沉默TtTret1-like 和TtTret1 后截形叶螨成螨生存的影响Fig. 7 Effects of 50 ℃ extreme temperature on the survival of T. truncatus adults after silencing TtTret1-like and TtTret1
3 讨论
3.1 TtTret1-like 和TtTret1 生物信息学分析
海藻糖转运蛋白是一种海藻糖特异性转运蛋白,在维持昆虫体内平衡和温度胁迫耐受方面发挥重要作用[26-27],其具有与大多数糖转运蛋白相似的理化性质。本研究通过生物信息学方法预测的TtTret1-like 和TtTret1 均属于MFS 超家族,它们的二级结构及三级结构主要为卷曲和螺旋结构[28]。同时,TtTret1-like 和TtTret1 具有12 个跨膜结构域,而大多数糖转运蛋白的典型结构具有12 个跨膜结构域。SAIER 研究发现,MFS 超家族成员蛋白多数具有12 个跨膜结构域,少数具有14 或24 个跨膜区[29];棉铃虫(Helicoverpa armigera)中的大多数糖转运体有10—12 个跨膜结构域[30]。这说明TtTret1-like 和TtTret1 与大多数糖转运蛋白结构相似。KIKAWADA 等研究也发现,Tret1 与葡萄糖转运蛋白(glucose transporter,Glut)家族之间保守氨基酸序列总体相似,推测Tret1 可能具有转运葡萄糖的功能。对嗜眠摇蚊(Polypedilumvanderplanki)的研究发现,PvTret1 不仅可以运输海藻糖,还可以运输葡萄糖类似物,因此推测Tret1 可能是Glut 超家族的新成员;但也有研究表明Tret 在底物选择和运输动力学方面与Glut 不同,Tret1 是否为Glut 超家族新成员还有待进一步研究[19,31]。
3.2 TtTret1-like 和TtTret1 在不同发育阶段的表达模式
海藻糖是昆虫体内一种主要的循环糖,在发育转变和应激恢复期间维持能量和葡萄糖稳态中发挥重要作用,其在昆虫体内的分布主要由海藻糖转运蛋白Tret 调节,是飞行肌肉、卵巢和睾丸等生殖组织的即时能量来源[16]。本研究发现,在截形叶螨不同发育阶段中均能检测到TtTret1-like和TtTret1的表达,说明TtTret1-like和Tret1在截形叶螨的生长发育及生殖中不可或缺。TtTret1-like和TtTret1在截形叶螨幼螨和成螨期均高表达,在若螨期低表达,推测活动性较差的幼螨及成螨更需要海藻糖作为能源来完成生长发育及生殖活动,因此作为重要中介的海藻糖转运蛋白基因表现出较高的表达量。与此类似的有,椭圆食粉螨AoTret1-1和AoTret1-2在卵期和成螨期高表达,在幼螨和若螨期低表达[20]。因此,对于能量需求较大的螨态,会通过调整自身的一系列行为来适应逆境,进而完成其生命活动[32]。此外,果蝇(Drosophila)的Tret1-1和Tret1-2在脂肪体和外周组织中表达,Tret1-1在大脑中高度表达,这对于果蝇在血脑屏障处输入富含能量的糖类至关重要[33-34]。在家蚕(Bombyxmori)中,Tret1在脂肪体、睾丸和肌肉中高度表达[31]。本试验仅研究了截形叶螨Tret1在不同发育阶段的表达模式,尚未对该螨各组织中Tret1的表达水平进行研究,后续有待于进一步开展。
3.3 截形叶螨海藻糖及TtTret1-like 和TtTret1 对高温的响应
海藻糖在抵抗高温方面的重要作用已得到广泛认可,如双斑长跗萤叶甲(Monoleptahieroglyphica)[35]、白蜡窄吉丁(Agrilusplanipennis)[36]、西伯利亚蝗(Gomphocerussibiricus)[8]在高温条件下会通过积累海藻糖来提高耐热性,以适应高温环境。Tret在长红猎蝽(Rhodniusprolixus)吸血后或饥饿状态下表达增加,表明其可能在血淋巴直接吸收或释放海藻糖中发挥作用[37];此外,该基因在嗜眠摇蚊需要能量时高表达,比如交配和环境压力(脱水、冷、热、湿或盐胁迫)下[19,31,38]。本研究中发现高温处理下截形叶螨体内TtTret1-like和TtTret1表达上调,推测截形叶螨需要足够的海藻糖来抵御外界高温,进而海藻糖转运蛋白基因也协同上调表达,表明TtTret1-like和TtTret1参与了应对高温胁迫的过程。
为了进一步研究TtTret1-like和TtTret1对极端高温的响应,本研究通过RNAi 技术沉默TtTret1-like和TtTret1后发现,截形叶螨体内的海藻糖含量显著上升,但血淋巴的海藻糖含量显著降低,截形叶螨对高温的耐受性降低,在高温中更易死亡。海藻糖的跨膜运输主要依赖于海藻糖转运蛋白,推测沉默TtTret1-like和TtTret1后海藻糖转运蛋白减少,导致在脂肪体中合成的海藻糖转运到血淋巴的过程受阻,进而降低了截形叶螨对高温的适应性。这与许多研究结果一致。沉默AgTret1后,冈比亚按蚊血淋巴中的海藻糖含量降低,在高温低湿环境中更易死亡[19]。敲除PxTret-1的突变体小菜蛾,其海藻糖含量整体升高,但血淋巴海藻糖含量降低,导致小菜蛾对温度的适应性降低[22]。此外,在大猿叶甲(Colaphellusbowringi)中,沉默CbTret1a提高了脂肪体中海藻糖含量,降低了一些应激相关基因的表达[39]。在褐飞虱(Nilaparvata lugens)中,沉默NlTret1-likeX1后,降低了褐飞虱体内所有海藻糖合成酶和海藻糖酶基因的表达,同时降低了海藻糖酶活性,从而引起褐飞虱体内海藻糖含量升高[40]。这些研究表明特异性转运海藻糖蛋白在昆虫的能量供应中具有重要作用,增强了昆虫对不利环境的适应能力。究其原因,可能是昆虫在不断取食的过程中,蔗糖可在肠道内水解成果糖和葡萄糖[41],随即葡萄糖通过葡萄糖转运体Glut 转运到脂肪体,并通过TPS/TPP 迅速合成海藻糖[15-16],而脂肪体合成的海藻糖需要依靠海藻糖转运蛋白转运到血淋巴和其他需要能量的组织中。这说明海藻糖转运蛋白Tret 在昆虫或螨应对高温环境中具有重要作用。
4 结论
TtTret1-like 和TtTret1 结构简单,二级结构以螺旋和卷曲为主,且均属于MFS 超家族,具有12 个跨膜结构域。TtTret1-like 和TtTret1 分别与同为叶螨属的二斑叶螨TuTret1-like 和TuTret1 的亲缘关系较近。高温使截形叶螨体内的海藻糖含量显著上升,诱导TtTret1-like和TtTret1上调表达,且当这两个基因的表达被抑制后,可明显降低截形叶螨的耐热性。研究结果可为研发新型杀螨剂的防控靶标提供理论依据。
