金霉素和土霉素对生物除磷中微生物EPS的影响
2024-04-08陶传奇奚姗姗何春华王金花张佳妹马牧野
陶传奇, 张 华*, 黄 健, 奚姗姗, 何春华,罗 涛, 王金花, 张佳妹, 马牧野
1. 安徽建筑大学环境与能源工程学院, 安徽 合肥 230601
2. 环境污染控制与废弃物资源化利用安徽省重点实验室, 安徽 合肥 230601
3. 安徽省生态文明研究院, 安徽 合肥 230601
引 言
目前, 抗生素种类繁多, 而四环素类的抗生素由于显著的抑菌效果而被广泛用于人类及养殖业和畜牧业[1]。 然而, 50%~80%的抗生素可以通过排泄物进入污水处理厂[2]。 其中, 四环素类抗生素即金霉素和土霉素在污水厂中检出率较高[3]。 金霉素和土霉素会影响活性污泥中微生物生存, 可能引起污水生物处理效果变差。 生物除磷是污水厂除磷的重要工艺。 在生物除磷过程中, 微生物胞外聚合物发挥着重要作用。 探究金霉素和土霉素对污水生物除磷中微生物胞外聚合物影响具有重要意义。
胞外聚合物(extracellular polymeric substances, EPS)是分布在微生物表面的高分子聚合物[4]。 微生物在面临外界环境不利影响, EPS可作为保护层抵御外界有害物质的侵害[5-6]。 EPS中主要成分是蛋白质和多糖, 约占70%~80%。 EPS组分及含量关系着活性污泥絮凝性能、 沉降性能[7-8]。 研究表明, 金霉素浓度的增加会刺激微生物EPS的合成, 而且金霉素与EPS结合形成EPS-CTC复合物, 阻碍物质传递[9]。 土霉素能有效抑制SBR系统中微生物蛋白质合成的过程, 导致EPS中蛋白质合成量下降[10]。 然而, 污水中抗生素往往都是混合存在的。 研究表明, 混合抗生素会引起微生物EPS中蛋白质和多糖的增加并引起污泥性能的恶化[11-12]。 目前, 在金霉素和土霉素对微生物EPS的研究中, 主要集中于金霉素和土霉素单独作用时对微生物EPS影响。 然而, 对于金霉素和土霉素混合污染物对生物除磷中微生物EPS的研究甚少, 混合污染物往往具有更复杂的影响, 因此, 探究金霉素和土霉素混合污染物对生物除磷的影响更具有意义。
本研究利用直接均分射线法设计3种不同浓度配比的金霉素和土霉素, 探究不同浓度金霉素、 土霉素和二者混合物对生物除磷中微生物EPS的蛋白质和多糖含量的影响, 并结合三维荧光光谱(3D-EEM)和傅里叶变换红外光谱(FTIR)分析EPS成分及主要官能团的变化, 为揭示金霉素和土霉素混合污染物对生物除磷中微生物EPS的影响机制提供理论依据。
1 实验部分
1.1 装置与运行条件
实验采用8个相同的圆柱形有机玻璃材质的SBR, 反应器供氧利用空气泵和反应器底部的微孔曝气盘实现。 通过玻璃转子流量计控制溶解氧为2.0~3.0 mg·L-1。 反应器壁厚0.5 cm, 高28 cm, 内径9 cm, 有效使用容积为1.8 L。 反应周期分6个阶段, 进水、 厌氧、 曝气、 沉淀、 出水、 闲置阶段。 采用间歇式厌氧/好氧交替运行方式, 反应器每天运行6个周期, 1个周期4 h, 进水30 min, 厌氧50 min, 好氧110 min, 沉淀30 min, 出水10 min, 闲置10 min。 每个反应器污泥浓度(MLSS)约为4 000 mg·L-1。
1.2 接种污泥与进水水质
实验接种的活性污泥取自合肥市望塘污水处理厂的氧化沟, 将接种污泥接入到18 L反应器进行驯化, 实验污泥驯化阶段出水COD、 MLSS和正磷酸盐稳定后视为驯化完成。 最后活性污泥转移至1.8 L反应器进行实验。
实验采用人工配水, 药剂包括CH3COONa·3H2O、 KH2PO4、 NH4Cl、 MgSO4、 C4H8N2S、 C10H16N2O8、 CaCl2·2H2O、 酵母膏、 蛋白胨; 微量元素包括FeCl3、 KI、 ZnSO4、 H3BO3、 CuSO4、 MnCl2、 Na2MOO4、 CoCl2·6H2O。
1.3 金霉素和土霉素储备液的配置
分别称取1 g金霉素和土霉素, 用去离子水充分溶解并定容至1 L棕色容量瓶进行避光保存, 放置于4 ℃冰箱储存待用。
1.4 EPS提取和分析方法
EPS提取采用热提取法[13]。 提取步骤: 取厌氧末端30 mL污泥混合液, 离心力2 000 g条件下离心15 min去上清液, 注入超纯水补充至原体积。 置于80 ℃恒温水浴锅中加热1 h后, 溶液冷却至室温。 在4 ℃, 离心力12 000 g条件下离心10 min, 取上清液用0.45 μm滤膜过滤, 将过滤后的EPS溶液置于4 ℃进行保存。 提取的EPS中蛋白质采用考马斯亮蓝, 多糖采用蒽酮-硫酸测定法。
1.5 3D-EEM分析
采用Hitachi F-7000荧光分光光度计对EPS的成分进行3D-EEM分析。 以氙灯为光源, 设定电压700 V, 三维荧光光谱扫描设定狭缝宽带λEx为5 nm,λEm为5 nm; 激发波长λEx为200~400 nm, 发射波长λEm为300~550 nm; 扫描速度为2 400 nm·min-1。 扫描的数据利用Matlab2020软件处理分析。
1.6 FTIR分析
为了定性分析EPS中化学官能团的变化, 将EPS提取液经过冷冻干燥后与光谱纯KBr按照质量比1∶100进行充分研磨、 压片, 压片成透明状后在红外光谱仪进行FTIR分析, 在400~4 000 cm-1波数范围内扫描, 分辨率为4 cm-1, 扫描的数据利用origin2018软件绘图。
1.7 不同浓度配比混合物设计
首先根据金霉素、 土霉素单独作用时的比吸磷率, 得到半最大效应浓度EC50, 再利用直接均分射线法[14]设计3种不同浓度配比(L1、 L2、 L3)的金霉素和土霉素混合物, 结果如图1和表1所示。 再根据稀释因子法[14]为每种配比设计8组金霉素和土霉素混合物, 结果如表2所示。
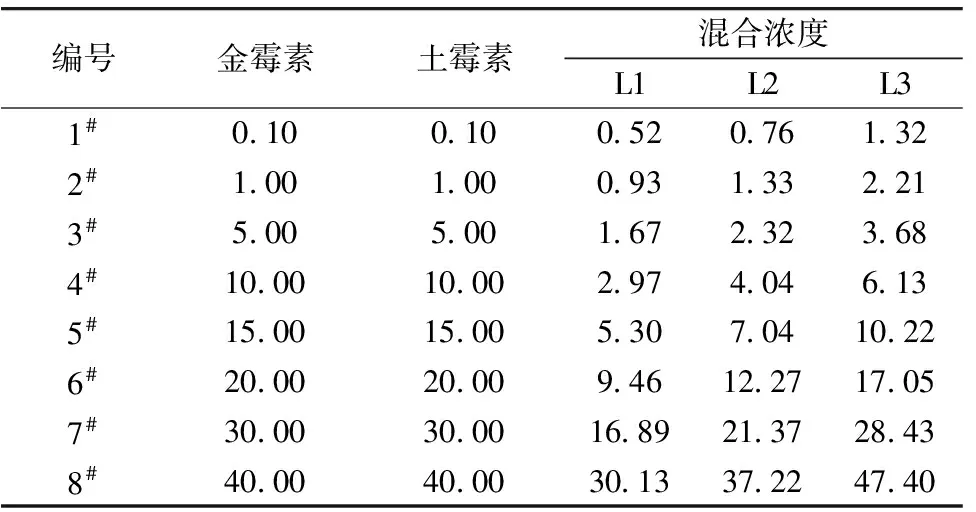
表2 8组金霉素和土霉素浓度组合 (mg·L-1)
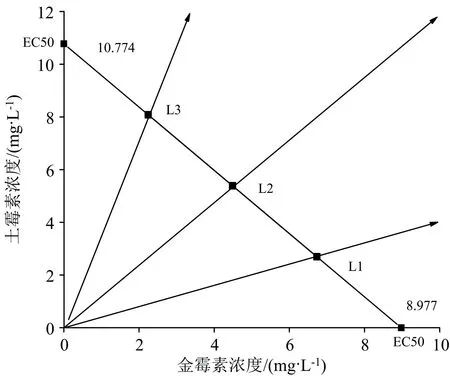
图1 直接均分射线法设计不同浓度配比混合物
2 结果与讨论
2.1 不同浓度金霉素、 土霉素及混合物对正磷酸盐去除的影响
不同浓度金霉素、 土霉素及3种配比的混合物对正磷酸盐去除的影响如图2所示。 由图2(a—e)可知, 随着作用时间的延长, 不同浓度金霉素、 土霉素及混合物作用下, 出水中正磷酸盐的浓度不断增加并逐渐趋于进水浓度。 这说明抗生素已经严重抑制聚磷菌除磷的过程。
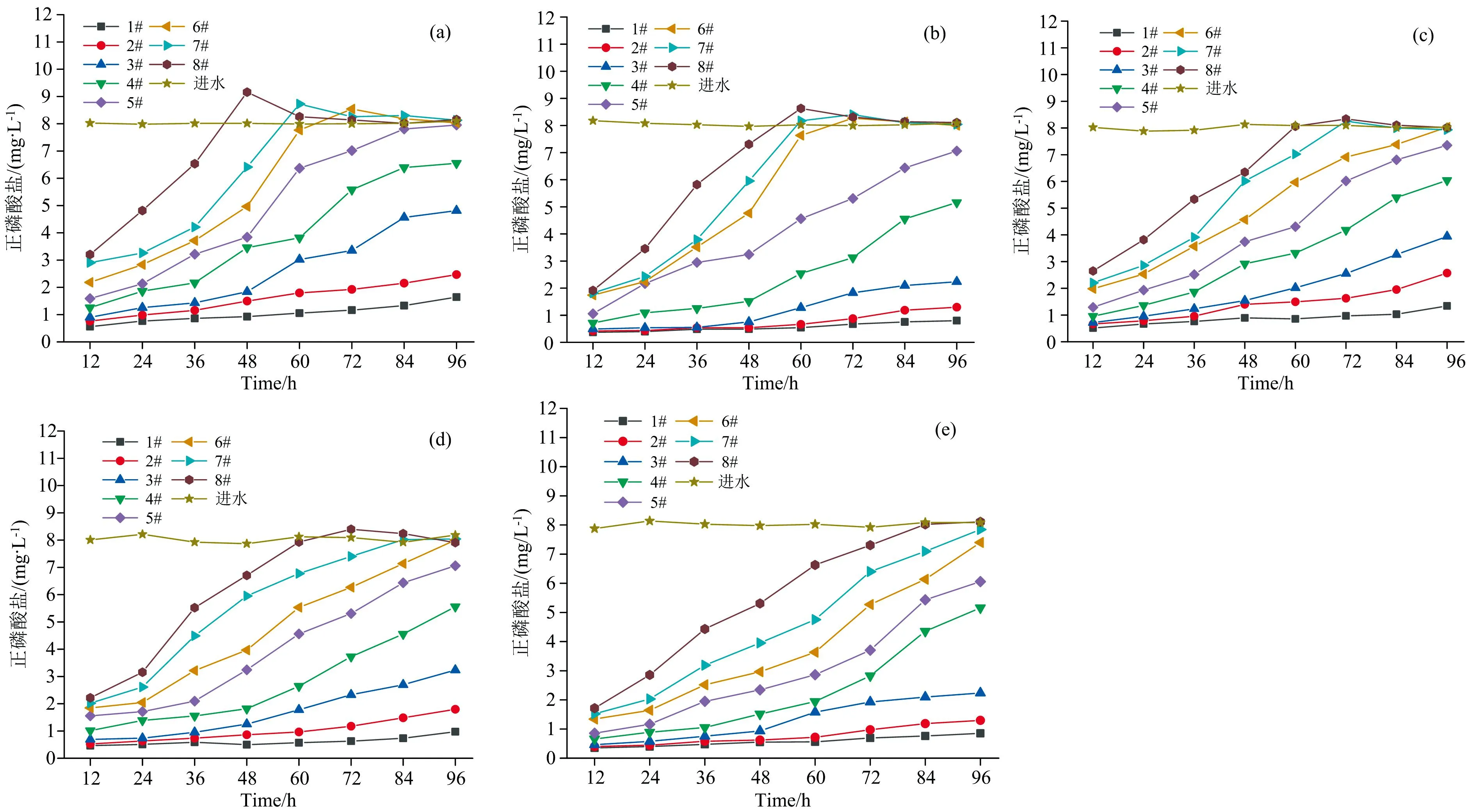
图2 不同浓度金霉素、 土霉素及3种配比混合物对正磷酸盐去除的影响
2.2 不同浓度金霉素、 土霉素及混合物对COD去除的影响
不同浓度金霉素、 土霉素及3种配比的混合物对COD去除的影响如图3所示。 图3(a—e)不同浓度金霉素、 土霉素及混合物随着作用时间的延长, 反应器COD出水浓度不断增加。 可见金霉素、 土霉素及混合物对COD去除产生较大影响, 抗生素浓度越高COD去除受到抑制越明显。
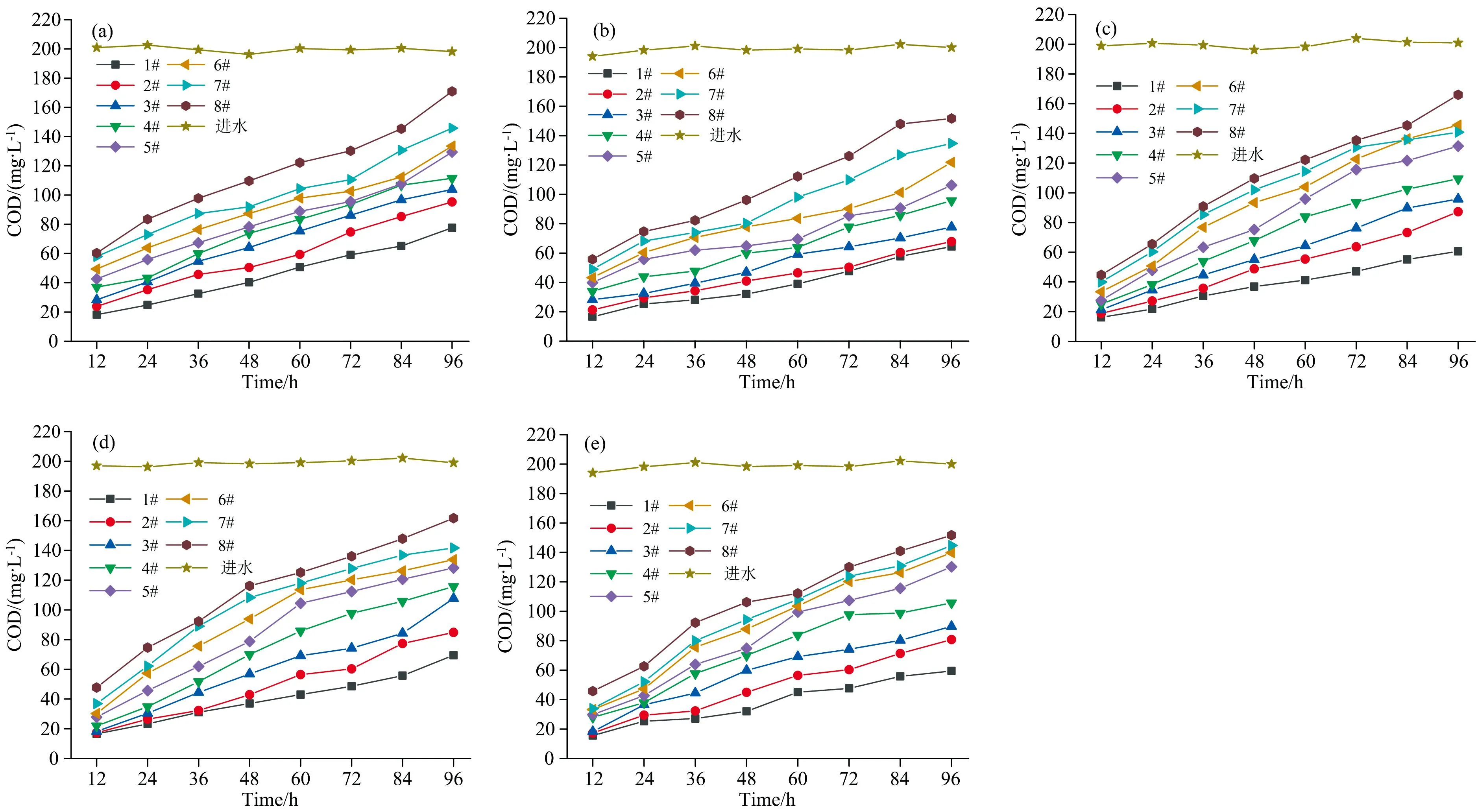
图3 不同浓度金霉素、 土霉素及3种配比混合物对COD去除的影响
2.3 不同浓度金霉素和土霉素对微生物EPS的影响
不同浓度金霉素和土霉素对微生物EPS中蛋白质和多糖含量的影响如图4所示。 由图4(a—d)可知, 随反应时间的延长, 蛋白质和多糖含量均呈现先上升后下降的趋势, 蛋白质、 多糖含量分别在36和48 h达到最大值, 同时蛋白质含量远高于多糖。 分析认为在反应初期, 金霉素、 土霉素的刺激下使生物除磷中微生物分泌EPS在微生物体表面形成保护层抵御有害的环境。 研究表明, 蛋白质是保护细胞的主要物质, 为防止细胞受到毒害, 细胞合成蛋白质的含量增加[15]。 也有研究发现, EPS表面具有大量带负电荷的基团和氢键、 范德华力能够与污染物结合形成复合物保护微生物[16]。

图4 不同浓度金霉素、 土霉素对EPS组分随时间变化情况
然而, 金霉素与土霉素均属于四环素类抗生素。 研究表明, 四环素类抗生素能与核糖体30S亚基中A的位置结合, 能够阻止胺基酰-tRNA与核糖体A位置联结, 导致了微生物合成蛋白质受阻[17]。 当金霉素、 土霉素的浓度增加至某临界值时, EPS表面结合位点被完全占据, 导致EPS结构遭到破坏, 抗生素进入细胞体内进而抑制微生物合成蛋白质。 因此, 随反应时间和浓度的增加EPS中蛋白质和多糖含量出现逐渐减少的现象, 从而引起生物除磷功能逐渐下降。 该实验结果与前人研究结果一致[18]。 可见EPS含量增加对于延缓生物除磷性能不断恶化具有重要作用。
2.4 不同浓度配比金霉素和土霉素混合物对微生物EPS影响
不同浓度配比金霉素和土霉素混合物对微生物EPS中蛋白质和多糖含量的影响如图5所示。 由图5(a—f)可知, 随着反应时间的增加, 3种不同浓度配比下微生物EPS中蛋白质和多糖含量均呈现先上升后下降的趋势。 这可能是微生物为了不受到金霉素和土霉素联合毒害的作用分泌产生更多的EPS在微生物体表面形成保护层, 导致蛋白质和多糖含量出现不同程度的增加。 该研究结果与李娟英等研究的纳米氧化锌和四环素对EPS的影响相似[19]。 然而, 随反应时间延长及浓度的增加, 金霉素和土霉素在EPS中逐渐积累, 微生物表面的EPS结构遭到破坏, 进而抑制蛋白质和多糖的合成, 导致蛋白质和多糖含量下降。

图5 不同浓度配比混合物对EPS组分随时间变化情况
2.5 3D-EEM分析
2.5.1 不同浓度金霉素和土霉素对微生物EPS的3D-EEM分析
不同浓度金霉素和土霉素对生物除磷中微生物EPS影响的3D-EEM如图6所示。 由图6可知, 不同浓度金霉素和土霉素作用下EPS的3D-EEM均出现了2种荧光区域类型, 即荧光峰A(类酪氨酸, Ex=220~230 nm, Em=280~380 nm)和荧光峰B(类色氨酸, Ex=270~290 nm, Em=280~380 nm), 这两类物质都属于类蛋白质物质[20]。 随金霉素、 土霉素浓度的增加类蛋白质物质荧光强度均出现先增强后减弱。 金霉素3#反应器和土霉素6#反应器又先后出现了第3、 4个荧光区域, 分别记作荧光峰C(类腐殖酸物质, Ex=320~370 nm, Em=380~450 nm)和荧光峰D(类富里酸物质, Ex=220~230 nm, Em=380~430 nm)[21]。 其中金霉素生物除磷反应器比土霉素反应器多了1种类富里酸荧光峰E(Ex=240~260 nm, Em=400~430 nm)。 类富里酸物质的荧光强度随金霉素浓度的增加不断增强, 说明金霉素和土霉素虽然归属于四环素类抗生素, 但是两者对生物除磷系统中的微生物EPS影响有所不同, 可能归属两者化学结构上不同。
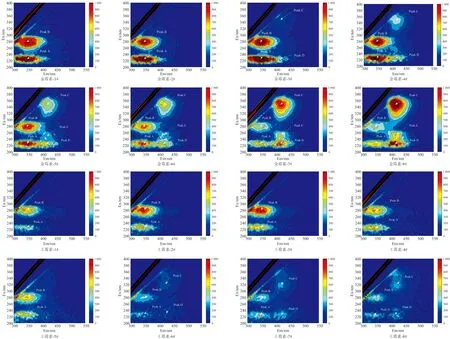
图6 不同浓度金霉素、 土霉素3D-EEM分析图
由以上分析, 当金霉素和土霉素浓度为0.1~5 mg·L-1时, 随着浓度的增加, 类酪氨酸和类色氨酸的荧光强度均呈现先增强后减弱的趋势。 分析认为低浓度金霉素、 土霉素的影响下, 微生物分泌更多的蛋白质与金霉素和土霉素结合以阻止毒害作用, 故酪氨酸峰和类色氨酸峰的荧光强度不断增强。 然而当金霉素和土霉素为10~40 mg·L-1, 随着浓度的增加, 类酪氨酸峰和类色氨酸峰的荧光强度逐渐减弱, 这表明微生物分泌蛋白质受到影响或者蛋白质与金霉素和土霉素结合导致的荧光淬灭, 因此类酪氨酸峰和类色氨酸峰荧光强度逐渐减弱。 在金霉素和土霉素的影响下产生新物质类腐殖酸和类富里酸, 并且荧光强度不断增强。 分析认为高浓度金霉素、 土霉素导致部分微生物死亡和微生物细胞破碎水解。 少部分微生物的内源性呼吸释放出有机物质, 导致类腐殖酸物质和类富里酸物质荧光强度逐渐增强[15]。 说明了在反应后期正磷酸盐出水浓度超过进水浓度的原因。 因此金霉素和土霉素浓度的增加会导致生物除磷系统中微生物EPS组分发生改变, 同时生物除磷效果也会受到影响。
2.5.2 不同浓度配比混合物3D-EEM分析
不同浓度配比混合物对生物除磷中微生物EPS影响的3D-EEM如图7各图所示。 由图7可知, 3种不同浓度配比混合物作用下, EPS中均出现了2种类蛋白质物质, 且随浓度的增加荧光强度先增强后减弱, 相比单独的金霉素和土霉素单独作用下, 类蛋白质物质荧光强度均较弱。 配比L1和L2还出现类腐殖酸物质和类富里酸物质, 其荧光强度也相对较弱, 说明金霉素小于土霉素占比时, 只引起微生物分泌2种类蛋白质物质出现。 可能两种抗生素之间具有拮抗作用, 减弱了对微生物的毒害作用[22]。

图7 不同浓度配比混合物3D-EEM分析
2.6 FTIR分析
不同浓度金霉素、 土霉素及其混合物对EPS的官能团影响的FTIR光谱图如图8(a—e)所示。 由图8可知, FTIR光谱图极为相似, 但是随金霉素、 土霉素及3种配比混合物浓度的增加使某些峰产生位移以及透过率逐渐增大, 这表明金霉素和土霉素与EPS某些官能团发生作用。
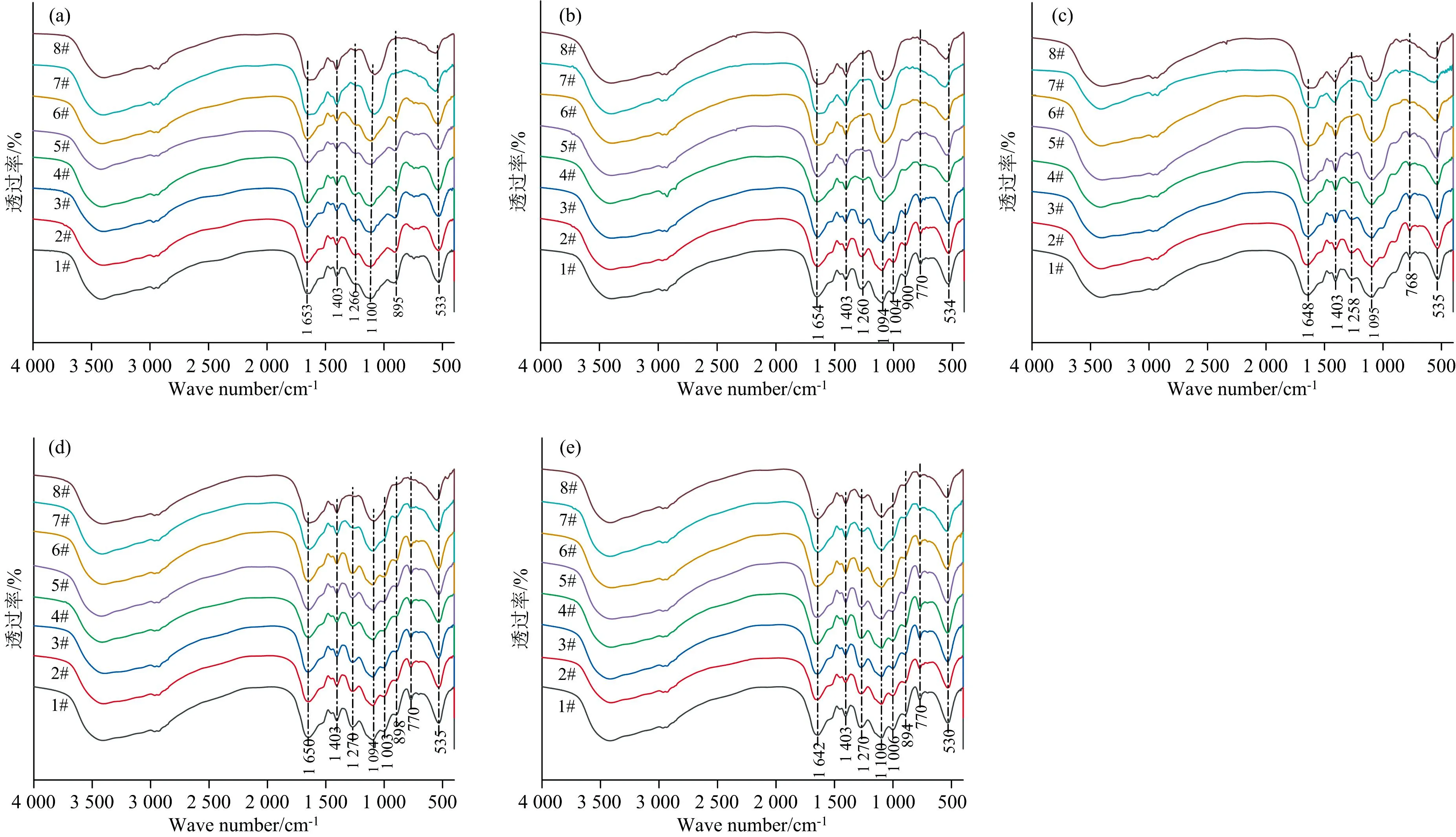
图8 不同浓度金霉素、 土霉素及3种配比混合物作用下EPS官能团的FTIR分析
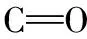
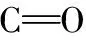
3 结 论
(1)金霉素、 土霉素及3种配比混合物对生物除磷效果和微生物EPS分泌产生影响。 随着浓度和反应时间增加,EPS中蛋白质和多糖含量呈现先上升后下降的趋势, EPS含量的增加延缓了除磷过程的恶化。

