小探头超声内镜在结直肠侧向发育型肿瘤浸润深度评估中的应用
2024-04-08李二峰张全卯
李二峰,张全卯
[山西省肿瘤医院(中国医学科学院肿瘤医院山西医院,山西医科大学附属肿瘤医院)内镜中心,山西 太原 030013]
结直肠侧向发育型肿瘤(laterally spreading tumor,LST)根据表面形态分为:颗粒型LST(granulartype LST,LST-G)和非颗粒型LST(non-granulartype LST,LST-NG),颗粒型又分为:结节混合型和颗粒均一型,非颗粒型分为:假凹陷型和扁平隆起型。目前,LST 多采用内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗,整块切除率高[1-3],但在LST存在黏膜下纤维化或黏膜下层浸润的情况下,ESD则无法达到治愈性切除。因此,治疗前评估LST黏膜下层是否浸润,是决定ESD治疗效果的重要环节。小探头超声内镜操作简单,将内镜送入消化道进行检查,可对LST 浸润层次进行判定。但是,小探头超声内镜检查的准确性仍存在争议。本研究对本中心收治的268处结直肠LST的内镜下特征、内镜结果和切除标本病理结果进行分析,以探讨小探头超声内镜评估结直肠LST黏膜下层浸润的准确性及其影响因素,旨在为临床提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2018年6月-2021年8月就诊于山西省肿瘤医院内镜中心拟行ESD 治疗的213 例结直肠LST患者(共268处病灶)的临床资料。
纳入标准:符合结直肠LST的诊断标准;同期无其他消化道恶性肿瘤相关治疗史;病历资料完整。排除标准:患有严重的心肺功能疾病,肠道清洁波士顿评分7分以下者。
1.2 设备
内镜主机为Olympus CV-290 型,肠镜为Olympus CF-H290 型,超声主机为Olympus EU-ME2型,小探头超声内镜为Olympus UM-DP12-25R型。
1.3 方法
小探头超声内镜检查均由同一位经验丰富的高年资内镜医师完成。收集患者的临床特征:性别、年龄和结直肠癌病史等。详细记录结直肠LST 的病变部位、病变直径和表面形态。采用水充盈法,对结直肠LST进行小探头超声内镜检查:反复冲洗,使病变处肠腔无粪渣和黏液,肠腔充分展开,超声探头与病变位置保持相对固定,超声图像能显示病变处肠壁的层次结构,判定黏膜下层是否侵犯。ESD治疗:用22 G注射针,于病变处肠壁黏膜下层注射亚甲蓝溶液,待病变完全抬举后,用Dual刀沿病变外周0.5 cm切开黏膜,随后在透明帽辅助下,沿黏膜下层推进式剥离,若显露大血管或出血较多时,以热活检钳电凝止血;待病变完整剥离后,用Dual 刀对创面止血。如病变直径 < 2.0 cm,则可行杂交ESD治疗,以提高切除效率。切除的标本用细针固定在标本板上,做好相应标记,用甲醛溶液固定后,送病理学检查。如果内镜观察病变考虑为恶性,术前活检病理结果为恶性,或超声内镜检查提示黏膜下层受侵等,则行外科手术。
1.4 观察指标
结直肠小探头超声内镜检查,肠壁分5 层结构,第一层高回声,对应黏膜表层;第二层低回声,对应黏膜肌层;第三层高回声,对应黏膜下层;第四层低回声,对应固有肌层;第五层高回声,对应浆膜层。超声内镜检查LST病变时,重点观察第三层连续性如何,如连续性好,则认为黏膜下层未浸润;如连续性差,则表示黏膜下层浸润。病变病理组织类型,根据切除标本的病理学检查结果为准。将病理结果中的黏膜下层是否浸润作为金标准,与治疗前小探头超声内镜检查黏膜下层的连续性进行对比,以判断小探头超声内镜评估结直肠LST黏膜下层是否浸润的准确性。
1.5 统计学方法
采用SPSS 29.0 统计软件分析数据。计数资料用处(%)表示,组间比较用χ2检验,多因素分析采用Logistic回归模型。P< 0.05为差异有统计学意义。
2 结果
2.1 病变基本特征
2.1.1 病变表面形态 颗粒均一型72 处,结节混合型56处,扁平隆起型90处,假凹陷型50处。病变大小方面,≥2.0cm172处,<2.0cm96处。术前活检110处,158处术前未活检。
2.1.2 病变部位 右半结肠54处,左半结肠70处,直肠144处。
2.1.3 ESD 切除大体标本病理形态 腺瘤161处,锯齿状病变78处,腺癌29处。
2.1.4 黏膜下层浸润情况 术前小探头超声内镜发现,黏膜下层浸润32 处,此32 处病变术后病理结果证实黏膜下层浸润20 处。另有6 处病变术后病理结果证实存在黏膜下层浸润,但术前小探头超声内镜检查未发现。小探头超声内镜评估结直肠LST黏膜下层浸润阳性预测值62.50%,阴性预测值97.46%,敏感度76.92%,特异度95.04%,准确率为93.28%。见表1。

表1 小探头超声内镜的检查效能 处Table 1 The examination efficiency of miniprobe ultrasonic endoscope n
2.2 影响小探头超声内镜评估结直肠LST 浸润深度准确性的单因素分析
小探头超声内镜评估判定准确250处,判定不准确18 处,判定准确组和判定不准确组病变直径、病变部位、术前是否活检和病理组织类型比较,差异均无统计学意义(P> 0.05);两组病变表面形态比较,差异有统计学意义(P=0.000)。见表2。结合病理学诊断结果,结节混合型病变6 处,存在黏膜下层浸润,小探头超声内镜检查未发现,其对病变浸润深度评估过低;而假凹陷型病变7处,小探头超声内镜检查发现黏膜下层浸润,但病理学结果未证实,其对病变浸润深度评估过高。

表2 影响小探头超声内镜评估结直肠LST浸润深度准确性的单因素分析 处(%)Table 2 Univariate analysis of factors affecting the accuracy of ultrasonic endoscope in detecting depth of invasion of colorectal LST n(%)
2.3 影响小探头超声内镜评估结直肠LST 浸润深度准确性的多因素分析
以小探头超声内镜是否能准确评估结直肠LST浸润深度为因变量(正确为1,不准确为2),病变表面形态作为自变量,进行多因素Logistic 回归分析,结果显示:病变表面形态是影响小探头超声内镜评估准确性的独立危险因素;结节混合型和假凹陷型病变是影响小探头超声内镜评估不准确的危险因素(=14.833,P=0.012;=14.488,P=0.014)。见表3。
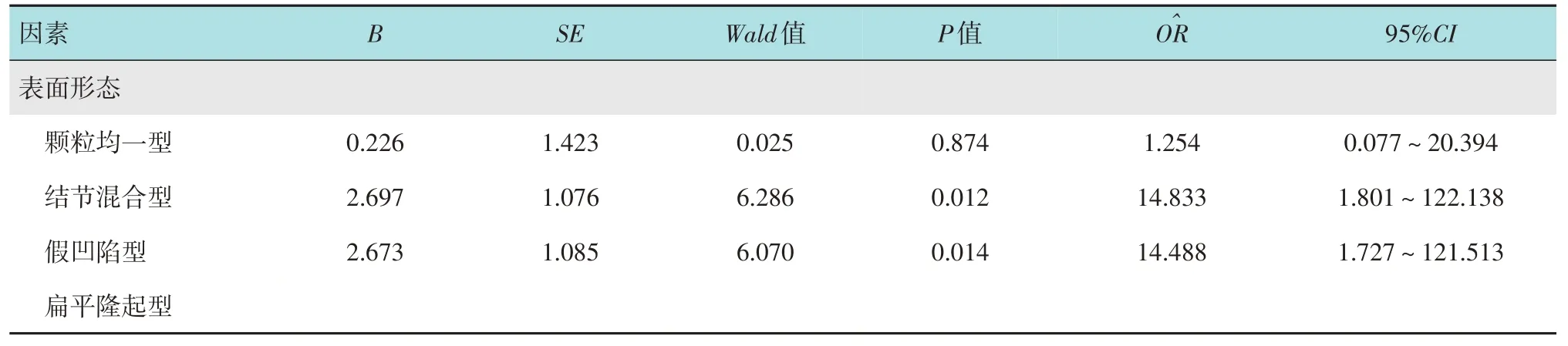
表3 影响小探头超声内镜评估结直肠LST浸润深度准确性的多因素Logistic分析Table 3 Multivariate Logistic analysis of factors affecting the accuracy of ultrasonic endoscope in detecting depth of invasion of colorectal LST
2.4 典型病例
扁平隆起型LST,EUS 显示黏膜层均匀增厚;颗粒均一型LST,EUS显示黏膜层不均匀增厚;结节混合型LST,EUS检查大结节处浸润层次判定过浅;假凹陷型LST,EUS 检查凹陷处浸润层次判定过深。见图1。
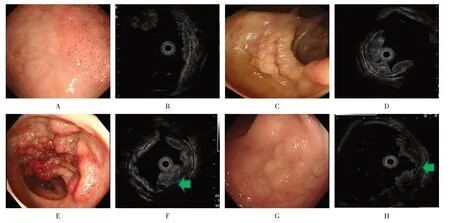
图1 典型病例Fig.1 Typical cases
3 讨论
结直肠LST 恶变率高,进展快[4],一经发现,需要积极治疗。准确判断LST的病理组织类型、浸润深度和恶性潜能,是正确选择治疗方式的重要前提。色素内镜和放大内镜等成像技术,可将病变染色后放大观察,通过病变表面形态和微血管结构,评估病变黏膜下浸润的形态学特征,但这项技术的应用,对内镜设备和操作者的要求较高,且学习曲线较长,在基层医院难以广泛开展。小探头超声内镜操作简单,操作者经短期培训即可掌握。目前,该技术已广泛应用于消化道早期肿瘤和黏膜下隆起型病变的诊断中。无论是染色放大技术,还是超声内镜检查,评估LST的重点仍是:病变是否癌变,以及黏膜下层是否受侵。有研究[5]表明,超声内镜检查的准确性与多种因素相关,如:病变大小、病变部位和病变形态等。陈新琦等[6]报道,直径较大的病变行超声内镜检查时,由于肿瘤性病变周围组织可同时出现炎性增生和纤维化等间质反应,可能会过度分期。KIM 等[7]也认为,环周病变行超声内镜检查,会低估病变浸润深度。本研究中,较大病变,特别是环周病变,确实会增加小探头超声内镜操作难度,如:要连续、完整地扫查病变,就必须对小探头的位置进行动态调整,使之能对病变的每个部分进行评估。尽管如此,本研究结果显示,病变大小并未对小探头超声内镜评估的准确性产生影响,可能与入组病变无过大直径和环周病变有关。
本研究中,病变部位和病变术前是否活检也未对小探头超声内镜评估的准确性产生影响。有研究[8]表明,位于直肠的LST,具有较高的癌变率,是由于该部位的LST以结节混合型和假凹陷型为主,且该部位肠腔大,血供丰富,LST 生长速度较快。有学者[9]指出,病变部位不会影响超声内镜检查的准确率,直肠蠕动功能较弱,肠壁位置相对固定,无论是行超声内镜检查,还是行ESD治疗,操作都会相对容易;而结肠由于肠道走行弯曲和肠道蠕动幅度大等因素,会影响肠腔注水,增加超声内镜检查难度,但在水充盈良好和肠腔充分舒展时,并不会影响超声内镜操作及其准确率。术前活检会在一定程度上明确病变病理组织类型,但无法排除病变较深位置与表面位置病理类型不一致的情况,而且活检后组织瘢痕化,会造成局部组织纤维化,影响ESD操作。因此,在色素内镜诊断部分为非肿瘤性的浅表型病变中,术前可不进行活检,以免增加ESD 的难度。本研究中,多因素Logistic 分析发现:病变部位和术前是否活检并未影响小探头超声内镜检查的准确率。
结节混合型和假凹陷型LST的癌变率和发生黏膜下层浸润的风险高于扁平隆起型和颗粒均一型LST[8,10]。因此,病变表面形态会影响超声内镜评估的准确性[11]。本研究发现,结节混合型和假凹陷型会影响小探头超声内镜评估的准确性。对于结节混合型病变,由于其表面结节大小不一,在大结节位置超声信号的衰减,会影响黏膜下层深部的成像。而假凹陷型病变,因其黏膜肌层较薄[12],行超声内镜检查时,超声信号的衰减会低于周围组织,且凹陷型病变深部常合并纤维增生[13],会降低超声内镜检查的准确率,存在过度分期现象[14]。
还有学者[15-16]认为,超声内镜评估的准确率与病变组织学分型有关,但这主要与未分化癌相关。未分化癌,特别是印戒细胞癌,大多存在微浸润灶,而超声内镜无法识别,容易出现判断过浅的情况。本研究中,多因素Logistic 分析未发现小探头超声内镜评估准确率与病变组织类型有关,可能与LST组织类型无未分化癌有一定关系。
综上所述,小探头超声内镜是评估结直肠LST浸润深度的有效方法,准确率较高。病变表面形态是影响小探头超声内镜评估准确率的危险因素。
