基于内置光纤/导光管反应器的微藻固碳减排研究
2024-04-08任柯欣张敬苗朱贤青
夏 奡 ,任柯欣 ,张敬苗 ,黄 云 ,朱贤青 ,朱 恂 ,廖 强
(1.重庆大学 低品位能源利用技术及系统教育部重点实验室, 重庆 400044;2.重庆大学 工程热物理研究所, 重庆 400044)
0 引 言
2021 年中国CO2排放量达到119 亿t,其中燃煤CO2排放量超57 亿t,约占总排放量的48.4%[1]。燃煤电厂排放的烟气中含有10%~20% 的CO2,是主要的碳排放源[2]。碳捕集利用与封存技术(CCUS)可有效减排烟气中的CO2,可为我国实现双碳目标作出重要贡献。目前碳捕集方法多样,如化学吸收、固体吸脱附、膜吸收分离等[3-4]。微藻生长周期短、适应能力强、分布广,固碳效率远超其他陆地植物。微藻固碳能够同时对CO2进行捕集与利用,实现碳减排并生产高附加值产品[5],极具发展潜力。
微藻细胞通过色素捕获光能进行光合作用,固定CO2生成有机物以供细胞自身生长利用[6]。目前,微藻的规模化培养常使用开放式跑道池反应器,其往往需要巨大的占地面积以使微藻获得充分光照[7]。而封闭式光生物反应器占地面积小,可为微藻提供稳定的生长环境,其微藻固碳效率显著高于开放式反应器[8]。KRUJATZ 等[9]和COLLESELLI 等[10]利用光学仿真软件量化反应器内光分布,发现外置光源仅有部分光能进入反应器内,且光照强度在藻液内快速衰减,使得远离光源区域形成暗区,即该区域内的微藻受光严重不足。因此,光传输是光生物反应器内微藻生长固碳的重要限制因素。通过增强光能输入可提高反应器内远离光源区域的光强,但过高的光能输入会使反应器内近光源区域光强过高,抑制微藻生长[11]。此外,改变反应器形状,扩大受光表面积、缩短光在藻液中的传输距离,可使反应器内更多区域的微藻接收到充足的光进行生长代谢[12-14]。但改变反应器形状会加大微藻培养工艺难度,且整体固碳效率提升有限。因此,在反应器内设置导光结构调节光分布,使更多区域的微藻接收到适宜生长固碳的光照非常重要。
导光管可灵活调节反应器内光分布,而光纤可集中传输光线且光损耗低,因此研究者们开展了大量相关研究。SUN 等[15]在反应器内加入空心导管,使远光区的藻细胞受到更多光照,发现微藻生物质产量可提高23%。RAHA 等[16]和AHANGAR 等[17]在反应器内部同时增添LED 灯条与镜面,进行光的发射与反射,微藻生物量分别提高30%、91%;但在培养过程中LED 灯条发热严重,藻液温度升高,导致微藻固碳效率降低。ALLIL 等[18]利用热绝缘体的光纤将太阳光集中导入藻液深处,减少反应器内部热量同时使微藻生物量提升了20%。为进一步增加光纤发光面积,WONDRACZEK 等[19]将光纤用砂纸轻度打磨后实现侧发光,反应器内光照区域可占总体积的50%,微藻生物量提高了93%;但处理后的光纤表面粗糙度增加,易被微藻附着,难以清洁,无法重复使用。因此,设计一种光利用率高、能耗小的封闭式光生物反应器对微藻高效固碳有重要意义。
本文选择由光纤将光集中传输至内置导光管向藻液发射,并通过设计阶梯型光纤结构、添加内置反光件优化反应器内的光分布。为探究内置光纤/导光管的发光效果,采用LightTools 软件对光纤/导光管发光情况进行仿真分析和优化,通过微藻培养实验验证了所设计的内置光纤/导光管反应器内的微藻固碳性能提升,为微藻固碳技术的发展提供理论依据与指导建议。
1 仿真与实验
1.1 微藻光生物反应器结构与实验设计
本研究采用购买自中国科学院武汉水生生物研究所的淡水普通小球藻Chlorella vulgarisFACHB-31,使用Modified BG 11 培养基[20]培养。
内置光纤/导光管的封闭式微藻光生物反应器整体结构如图1 所示,主要由塑料光纤、有机玻璃导光管与有机玻璃柱形培养腔室组成。柱形微藻培养腔室工作容积2.5 L,底部有气孔大小一致、分布均匀的气管。导光管直径20 mm,完全浸入藻液的发光段长度为140 mm,在保证良好透光性的同时防止藻液与光纤直接接触。管底放置表面贴有高光反射率镀铝反光膜的反光件(如图1 所示,完全反射的镜面底、半球型反射件、底∶高为1∶1 的锥形反光件、底∶高为1∶2 的锥形反光件、底∶高为1∶4 的锥形反光件)。光纤组由7 根直径为20 mm 的光纤组成,整体长度为800 mm。收集光的输入端面平整,输出光的末端为:平面结构光纤(光纤末端处于同平面,如图1a 所示)和阶梯型光纤(光纤中心的细光纤末端延长60 mm 形成直径12 mm 圆的第二层发射面,如图1f 所示)。

图1 内置光纤/导光管的封闭式微藻光生物反应器Fig.1 Microalgae photobioreactor with different built-in optical fiber/light guide tubes
为对比评估导光方式对光生物反应器内光分布及微藻培养性能的影响,设计了插入不含光纤的导光管且仅在顶部给光的对照组(Light guide photobioreactor,LG-PBR)、插入平底光纤/导光管的光生物反应器(Flat-bottom fiber photobioreactor,FF-PBR)和插入末端为两级阶梯结构光纤/导光管的光生物反应器(Stepped fiber photobioreactor,SF-PBR),如图2 所示。在3 种反应器内分别培养小球藻FACHB-31,培养条件为:微藻初始接种浓度0.1 g/L,温度(25±1)℃,通气量375 mL/L(通气比0.15 vvm,5% CO2),光能输入为1.6、3.3 或5.0 W/L(通过调节LED 灯功率控制单位体积藻液内光输入)。

图2 3 种光生物反应器示意Fig.2 Schematic of three types of photobioreactors
1.2 光纤/导光管仿真
采用LightTools 软件对单根内部含不同结构光纤与反光件的导光管进行光线追踪。根据实际光生物反应器结构,设定光纤为289 根直径为1 mm 的细光纤组合而成。外部有抛物线型反光杯,高60 mm,输入口直径20 mm,输出口直径为68 mm。材质设定:细光纤为塑料光纤,数值孔径NA 为0.5,芯层折射率1.49、包层折射率1.40;导光管为有机玻璃,折射率1.49;反光杯为铝,内表面全反射。根据实际情况,设朗伯型的圆柱形表面光源,波长为复合型白光,追踪的总光线数为五千万,接收面在导光管外侧,长160 mm、宽120 mm,8 991 个网格,峰值误差3.8%。
1.3 光纤/导光管侧发光效果实测
为确定不同结构的光纤与反光件组合后导光管的发光效果,同时验证仿真结果的可靠性,利用辐照计(SY-HYX,世亚科技,中国)测量导光管发光段侧面光强。以光纤末端为起始点1,之后每隔10 mm设立一点,一共14 个测量点,测量过程中每个点重复测3 次,取3 次平均值作为该点光强。
1.4 微藻生长固碳性能评价
微藻生物量采用称量法[21],从微藻光生物反应器内收集藻液,离心后放置在预先称量好重量的称量瓶中80 ℃下干燥24 h 后测定总重量,通过以下式计算获得微藻生物量:
式中:C为微藻生物量,g/L;V为抽取藻液体积,L;W1、W2为称量瓶净质量和称量瓶和干燥后的微藻总质量,g。
微藻平均固碳率为单位时间内单位体积微藻悬浮液固定的CO2量,计算公式[22]如下:

通过LICHTENTHALER[23]提出的色素测定方法测定微藻色素含量。将离心后的藻泥加入95%酒精,避光浸泡24 h 萃取微藻内色素,通过紫外可见分光光度计(Persee TU-1901,中国)在470、648.6、664.1 nm 三种波长下检测溶液中叶绿素a、叶绿素b、总类胡萝卜素的吸光度,代入公式可计算出藻细胞中3 种色素的含量。计算方程如下所示:
式中:Xa、Xb、X(x+c)为叶绿素a、叶绿素b 与总类胡萝卜素含量,μg/mL。
微藻悬浮液中色素质量分数α可用以下公式计算:

所有参数均重复测量了至少2 次,结果以均值±标准偏差的形式呈现。
2 实验结果与分析
2.1 光纤/导光管的光线仿真结果
由图3 可知,光纤将光线从光源处传递至末端,在导光管发光段20 mm 处达到峰值,之后侧面光强迅速减弱,其原因是光纤末端发射的光线具有一定的发散角,光在传播过程中不断向外扩散[25]。在0~20 mm 内,光纤内远离管壁的细光纤发射的光线抵达导光管壁面时,比靠近管壁的光纤的射出光线传播路径更长,距光线发射端更远,导光管侧面的光线密度随距离增加而上升,侧面光强在20 mm 附近达到最大值;在20~140 mm 区间随着光线继续传播,导光管侧面的光线密度逐渐下降,光强开始减小。仅插入平面结构光纤的导光管侧面发光范围有限,在导光管底部添加反光件可使发射角小的光线抵达导光管管底后,经反光件表面反射再射出导光管,从而加大了导光管底部的发光区域并提升了侧发光平均光强。对比图4a—图4e 可以发现,在导光管底部的锥形反光件比半球型反光件表面反射效果好,且随着圆锥高度增加,导光管底部光强增强区域变宽。当圆锥底∶高为1∶4 时,圆锥顶角尖锐,光强增强范围最大,但圆锥侧表面经反射射出的光线与管壁夹角小,使得导光管侧面光强增幅不明显。综合考虑光纤/导光管的侧发光区域与光强,最终选择底∶高为1∶2 的圆锥形反光件作为导光管底部的反光件。
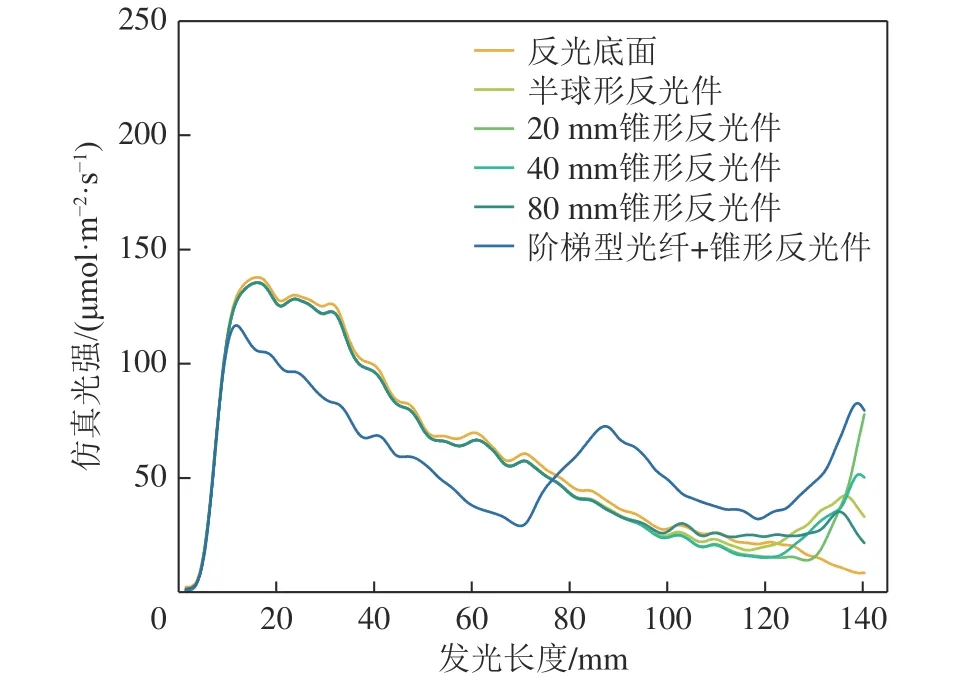
图3 不同光纤/导光管的侧面光强仿真结果Fig.3 Surface light intensity simulation results of different optical fiber/light guide tubes
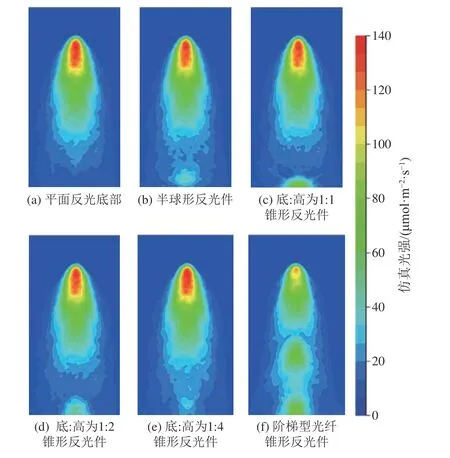
图4 不同光纤/导光管的光线仿真结果Fig.4 Ray-tracing simulation results of different optical fiber/light guide tubes
添加反光件后导光管底部光强在一定程度上得到提升,但因光线在近光源区域迅速向外射出,在60~140 mm 区间内导光管侧发光光强低于40 μmol/(m2·s),需进一步调节光纤结构以拓宽导光管侧面高光强区域(图3)。改变光纤末端结构,延长光纤中心的细光纤,呈现阶梯形状,可使传输的光被分为两部分从两级阶梯面向外发出(图4f)。由于第一级发光表面面积缩小,仿真结果显示在0~70 mm 范围内阶梯型光纤光强相比平面型强度减弱;但在70~140 mm 光强骤减范围内第二级阶梯表面发射光使导光管下端发光效果提升,进而使导光管侧发光光强分布更加均匀。
由图5 可以发现,使用不同形状光纤与锥形反光件的光纤/导光管侧面实际发光光强与仿真结果具有良好匹配性。导光管侧面发光光强与仿真结果变化趋势一致,但具体数值存在一定差异,该差异主要源于实际光纤光源与模型设计存在不同[9],实际光纤比模型内均匀排布的光纤更加紧密,细光纤之间内空隙更少,传输的光线损耗更少,导光管侧面的实际光强更高。对比分析不同结构的光纤/导光管可以发现,阶梯型光纤在0~70 mm 比平面型光纤的导光管侧发光光强低,在第一级阶梯面光强出现峰值后开始下降,经第二级阶梯面补光后光照强度回升,使得导光管整体发光效果更均匀。
2.2 不同反应器的微藻生长固碳性能
在输入光能相同情况条件下,FF-PBR 和SFPBR 中实际平均光强分别为57 μmol/(m2·s)和64 μmol/(m2·s),较对照组平均光强(18 μmol/(m2·s))分别提高了2.2 倍和2.6 倍,证实了所设计的阶梯型结构的光纤具有良好导光效果。光纤末端从平面改为阶梯型,使得导光管整体侧面光强标准差从45.7 μmol/(m2·s)降低为27.3 μmol/(m2·s),导光管侧面发光更加均匀。
在微藻培养过程中,藻液受气升力作用流动,而导光管改变反应器内流场,促进藻液循环速率[26]。由图6a 所示,在培养初期微藻浓度不高,光在反应器内传输良好,藻细胞可以获得充足光能,因此微藻迅速适应三种反应器内的培养条件,进入指数生长期,呈现相似的生长速率。但随着培养时间延长,三种反应器内微藻生物量差距持续增加,具有阶梯结构光纤的SF-PBR 在第7 天达到最高生物量(1.9 g/L),比FF-PBR(1.3 g/L)增长46.2%,比仅顶部给光的对照组LG-PBR(0.9 g/L)显著增加111.1%。三种反应器最终产出不同生物量的微藻的主要原因可能是内部光分布不同。对照组为顶部受光,一部分光直接射入藻液面,一部分光会通过导光管传输至到导光管底部,而导光管侧面发出的光光强较低。随着反应器内微藻生物量提升,此时光在藻液中衰减严重,光穿透深度减少,反应器内有效光区域缩减,微藻的生长受限[15]。而FF-PBR 与SF-PBR 通过光纤将光线集中射入反应器,反应器内部藻液受光表面积增加,有效光区域占比提升。FF-PBR 中光纤以平面结构插入导光管,靠近导光管底部、远离发光端面的区域侧发光强度低,随着微藻生物量的提升,光强衰减变快,对反应器深处藻细胞补光促进生长的效果变小。SF-PBR 的导光管侧表面光强相对均匀,侧发光效果远远超过其它两种结构,反应器内有效光区域更大。伴随底部曝气,微藻在藻液内循环流动,光量子与叶绿体碰撞时间增加,光利用率增加,CO2固定效率提升[27]。如图6a 和6b,微藻生物量与生长速率都有明显的提升,反应器的固碳效率与微藻生长速率正相关,所以SF-PBR 平均固碳效率显著高于其它两种反应器,达到500.3 mg/(L·d)。如图6c 所示,SFPBR 中藻细胞色素的质量百分比略低于其他两种反应器,可能是由于在培养初期,LG-PBR、FF-PBR 中光传输受限,藻细胞产生更多的叶绿素以捕获更多光。随着生物量增加,LG-PBR、FF-PBR 光衰现象更加严重,反应器内有效光区域总体积接近,总色素占比逐渐接近[28]。微藻迅速生长会消耗更多的营养物质,因此在SF-PBR 的培养基中 NO-3消耗更快(图6d)。
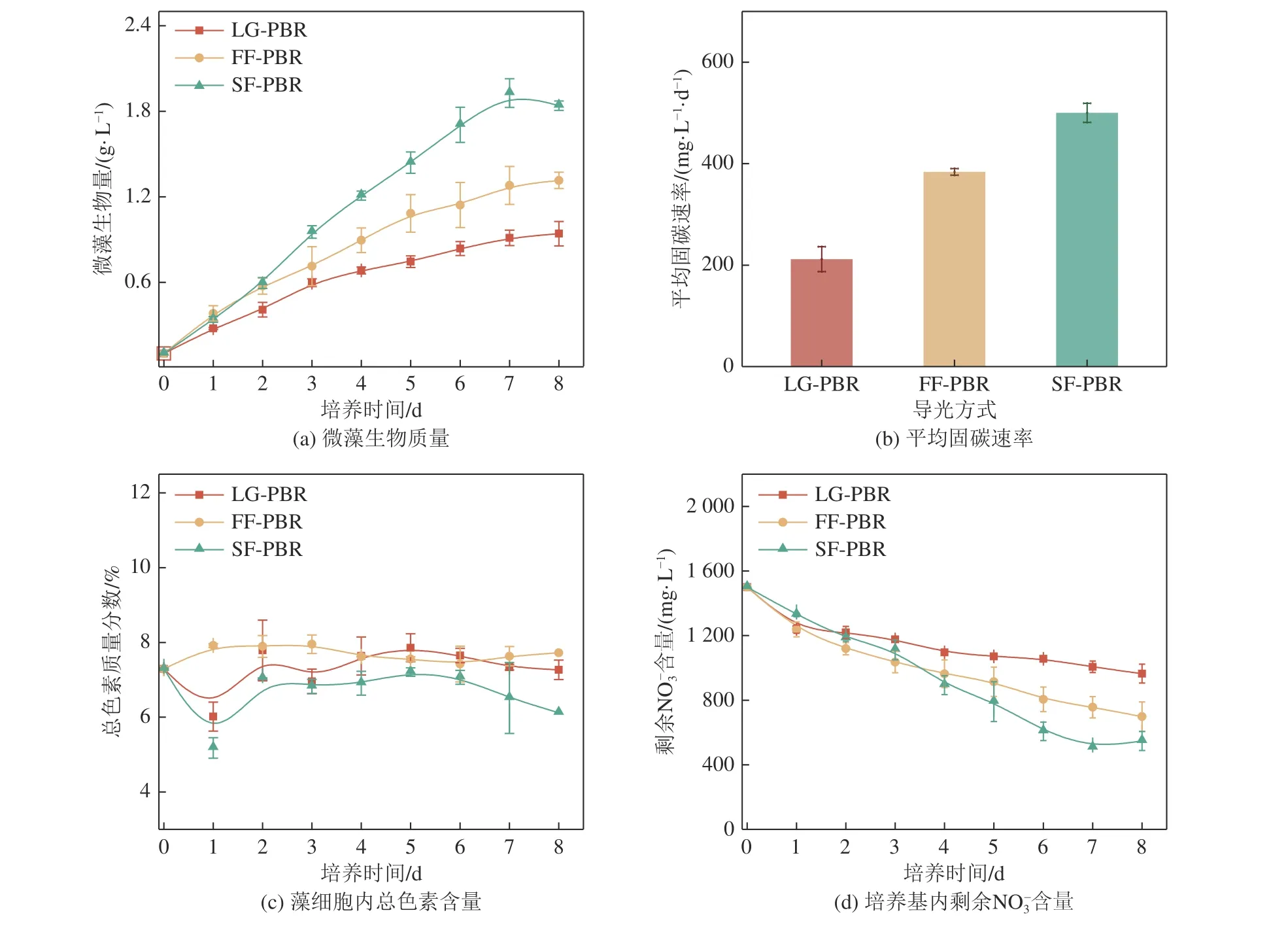
图6 不同导光方式对微藻生长的影响Fig.6 Effects of different light guiding methods on the growth of microalgae
2.3 不同光能输入对微藻培养固碳性能的影响
为促进微藻在SF-PBR 中高密度生长,提升该反应器的固碳能力,探索了不同输入光能条件下反应器内微藻的生长情况,以获得适宜微藻生长的光照强度。当输入光由1.7 W/L 提升至5.0 W/L 时,导光管第一阶梯面从52 μmol/(m2·s)增加到165 μmol/(m2·s),平均光强从32 μmol/(m2·s)增加到100 μmol/(m2·s),高于100 μmol/(m2·s)的区域占57.1%(图5b)。输入光能增加可提高光纤/导光管侧发光光强且不改变光强变化趋势,但管侧不同位置发光光强增加幅度不同,峰值光强增加幅度更大,光强方差从16.4 μmol/(m2·s)增至41.4 μmol/(m2·s),导光管整体发光均匀性略有下降。
如图7a 和7b 所示,微藻生物量与平均固碳速率和光强正向相关。伴随着光强增长,微藻生长速率提升,进而缩短生长周期[22]。输入光能为5.0 W/L时,光穿透深度增加,生物质光化学量子产率与碳循环加快,使得固碳效率显著上升[29];随着培养时间延长,生长速率变缓,培养周期结束时微藻生物量达到最大(2.8 g/L),平均固碳速率达608.3 mg/(L·d),比3.3 W/L 条件下的500.3 mg/(L·d)和1.7 W/L 条件下的273.4 mg/(L·d)平均固碳速率分别提升了21.6%和122.5%。SF-PBR 反应器中微藻生物质量比其他研究中的接受外部光的S 型光生物反应器提升196%[13],比内置LED 的光生物反应器提升9.1%[17]。由图7c 可以发现,藻细胞内总色素质量分数随着输入光能增大略微下降,这是因为反应器内光强高于100 μmol/(m2·s)的区域扩大,微藻可以获得较为充足的光照进行光合作用,所以细胞减少产生额外的叶绿素而增加合成碳固定酶[28]。同时,在较高输入光能条件下,微藻生长速率加快,培养基中的营养物质消耗速率更快。如图7d 所示,培养基中NO3-含量快速下降。输入光能为3.3 W/L 和5.0 W/L 条件下培养6 d 后,培养基内的 NO-3剩余量极少,造成培养基内氮缺乏,进而微藻会改变碳转化方向,同时分解自身叶绿素以维持生长[20]。因此,输入光能为3.3 W/L和5.0 W/L 条件下培养后期,微藻中色素质量分数显著下降(图7c)。

图7 不同输入光能对微藻生长的影响Fig.7 Effect of different input light energies on the growth of microalgae
3 结 论
1)利用LightTools 模拟光纤/导光管的侧面发光性能,获得的光学仿真结果与实际测量数据具有良好匹配性。导光管内阶梯型光纤与锥形反光件相互作用,使输入光分别从光纤的不同阶梯面发出,再由锥形反光件反射,光纤/导光管的整体发光范围扩宽、侧面平均光强提升,进而使微藻光生物反应器内光分布更加均匀。
2)在3 种光纤/导光管反应器中培养8 d 后,SFPBR 中的微藻生物量可达到1.9 g/L,比LG-PBR 高111.1%,FF-PBR 高46.2%,验证了阶梯型光纤/导光管可优化反应器内的光传输,为微藻提供更适宜的光照环境,促进微藻固碳过程,平均固碳效率可达500.3 mg/(L· d)。
3)当输入光能从1.7 W/L 提升至5.0 W/L 时,SFPBR 内导光管侧面平均光强由32 μmol/(m2·s)增加到100 μmol/(m2·s),培养的微藻生物量达2.8 g/L,培养期间固碳速率高达608.3 mg/(L· d),比对照组LGPBR 固碳速率提高1.9 倍。
