托法替布联合羟氯喹治疗难治性类风湿关节炎的临床观察 Δ
2024-04-08王明杰徐风金衡水市人民医院风湿免疫科河北衡水05000河北医科大学临床学院石家庄05007衡水市人民医院全科医学科河北衡水05000
王明杰 ,徐风金 ,张 艳 薛 燕 (.衡水市人民医院风湿免疫科,河北 衡水 05000;2.河北医科大学临床学院,石家庄 05007;.衡水市人民医院全科医学科,河北 衡水 05000)
类风湿关节炎(rheumatoid arthritis,RA)是一种病因不明的,以侵蚀性、对称性多关节炎为主要临床表现的慢性、全身性自身免疫性疾病,最终可导致关节畸形和功能丧失,在我国的患病率约为0.28%[1]。改善病情的抗风湿药(disease modifying anti-rheumatic drugs,DMARDs)是治疗RA 的首选药物,可通过控制炎症因子的形成来抑制炎症反应,延缓疾病进展[2]。有研究发现,仅有80%的RA 患者可连续应用DMARDs 至少6 个月,但达到临床缓解的比例却不足30%[3]。除临床医师及患者对疾病的认识不足、DMARDs 使用的剂量和时间不规范等原因外,有相当一部分的患者属于难治性RA。目前,对于难治性RA尚无统一定义。有学者认为,经传统DMARDs规范治疗至少6 个月或生物DMARDs 规范治疗至少3个月后,RA 病情仍未能达到临床缓解或病情仍处于中高度活动则称之为难治性RA[4]。
甲氨蝶呤与来氟米特均为DMARDs的慢作用药物,但两者的作用机制不同。甲氨蝶呤通过抑制细胞增殖发挥治疗作用,已成为治疗RA的标准药物,也被视为治疗中重度RA的首选DMARDs。来氟米特通过干扰免疫细胞激活的特定途径发挥治疗作用,可作为甲氨蝶呤无效或不耐受的替代选择[5]。托法替布是一种Janus激酶(Janus kinase,JAK)抑制剂,属于靶向DMARDs,可以通过抑制JAK磷酸化而实现对该信号转导通路的调节,从而起到调节免疫的作用[6]。该药适用于甲氨蝶呤疗效不足或对其无法耐受的中度至重度活动性RA 成年患者,可与甲氨蝶呤或来氟米特等其他非生物DMARDs联合使用[7]。羟氯喹属于4-氨基喹啉衍生物类抗疟药,可抑制炎症因子释放,是临床常用的非生物DMARDs[8]。多项研究表明,羟氯喹可以通过抑制信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)的活性而抑制炎症反应,对治疗RA等自身免疫性疾病具有积极作用[9―11]。为此,本研究基于托法替布和羟氯喹对JAK-STAT 信号通路的抑制作用,以甲氨蝶呤、来氟米特为对照药,观察了托法替布联合羟氯喹治疗难治性RA的疗效和安全性,旨在为难治性RA的临床治疗提供参考。
1 资料与方法
1.1 样本量评估方法
按照相关公式:n=2×[(α+β)σ/δ]2计算样本量,式中δ表示要求的区分度,σ表示总体标准差或其估计值,α、β分别表示对应的u值。规范治疗3个月后,A组患者的C-反应蛋白(C-reactive protein,CRP)比B组和C组患者多降低5 mg/L,同时结合难治性RA患者的实际情况,最终确定CRP 标准差约为20 mg/L,要求犯Ⅰ类错误的概率不超过5%,犯Ⅱ类错误的概率不超过10%,得到样本量评估公式:n=2×[(1.645+1.282)×20/4]2=14,故两组至少各需观察14例患者。
1.2 纳入与排除标准
本研究的纳入标准为:(1)符合美国风湿病学会(American College of Rheumatology,ACR)修订的RA分类标准和(或)欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)的RA 分类标准[12];(2)符合难治性RA的诊断标准[13]。
本研究的排除标准为:(1)合并严重肝功能损伤者(肝酶>3 倍正常值上限);(2)中重度贫血者[血红蛋白(hemoglobin,HB)<90 g/L];(3)结核、肝炎病史者;(4)恶性肿瘤病史者;(5)慢性/复发性感染和(或)严重感染者;(6)合并传染病者;(7)哺乳期或妊娠期妇女;(8)备孕女性及男性;(9)年龄<18岁者。
1.3 研究对象
选取2021年1月1日至2022年1月1日衡水市人民医院风湿免疫科收治的难治性RA 患者120 例,按照简单随机分配方法分为A组、B组和C组,每组40例。3组患者的性别、年龄、体重指数(body mass index,BMI)等资料比较,差异均无统计学意义(P>0.05),具有可比性,如表1所示。本研究方案经医院医学伦理委员会批准,文件编号:2020-1-034。所有患者均签署了知情同意书。
表1 3组患者的一般资料
1.4 用药方法
A 组患者给予枸橼酸托法替布片[南京正大天晴制药有限公司,国药准字H20203348,规格5 mg(按C16H20N6O 计)]5 mg,每日2 次,口服+硫酸羟氯喹片(上海上药中西制药有限公司,国药准字H19990264,规格0.2 g)0.4 g,每日2 次,口服。B 组患者给予枸橼酸托法替布片(用法用量同A 组)+甲氨蝶呤片(上海上药信谊药厂有限公司,国药准字H31020644,规格2.5 mg)10 mg,每周1 次,口服。C 组患者给予枸橼酸托法替布片(用法用量同A组)+来氟米特片(苏州长征-欣凯制药有限公司,国药准字H20000550,规格10 mg)20 mg,每日1次,口服。3 组患者均连续用药6 个月。用药后出现以下情况时需立即停药:(1)胃肠道穿孔风险(如胃溃疡、憩室炎等);(2)中重度贫血(HB<90 g/L 或HB 降幅>2 g/dL);(3)淋巴细胞绝对计数及中性粒细胞计数<500个/mm3;(4)肝酶>3倍正常值上限;(5)肌酐升高超过基线值的50%;(6)结核菌感染及带状疱疹病毒感染。
1.5 观察指标
1.5.1 临床疗效
采用ACR制定的《ACR疾病缓解标准》评价临床疗效。该标准评价的指标包括关节压痛数(tender joint count,TJC)、关节肿胀数(swollen joint count,SJC)、疼痛视觉模拟评分(visual analogue scale,VAS)、患者对目前疾病总体状况评价、医师对患者的总体状况评分、健康评估问卷调查(health assessment questionnaire,HAQ)、急性炎症反应物[CRP或红细胞沉降率(erythrocyte sedimentation rate,ESR)]。其中,TJC、SJC 改善20%以及其他5 个指标中至少有3 项改善20%评为ACR20,改善50%和70%分别评为ACR50和ACR70[14]。
1.5.2 关节活动度
分别于治疗前和治疗1、3、6个月时采用疾病活动度评分28(disease activity score 28,DAS28)评价患者的关节活动度。该评分项目包括人体28个关节的TJC、SJC、ESR 及患者自身评估,计算公式为DAS28=0.56×其中,t28表示TJC,sw28表示SJC,GH DAS28表示患者对目前疾病总体状况评价(评分0~100)。DAS28≤2.6分表示疾病缓解,2.6 分<DAS28≤3.2 分表示疾病轻度活动,3.2 分<DAS28≤5.1 分表示疾病中度活动,DAS28>5.1分表示疾病重度活动[15]。
1.5.3 生化、免疫和血清细胞因子指标
分别于治疗前和治疗1、3、6个月时收集患者空腹静脉血,检测生化指标(ESR、CRP)、免疫指标[类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸多肽(cyclic peptide containing citrulline,CCP)抗体]和血清细胞因子[白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)]水平。
1.5.4 Sharp评分
分别于治疗前和治疗6 个月时采用Sharp 评分评价患者的手腕部骨破坏情况。该评分标准包括——(1)骨侵蚀:①无骨侵蚀为0 分;②广泛骨侵蚀和丢失为5 分;③介于两者之间为1~4分。(2)关节腔变窄:①无狭窄为0 分;②局部狭窄为1 分;③弥漫狭窄且面积<50%为2分;④弥漫狭窄且面积>50%为3分;⑤强直为4分。以(1)+(2)的评分作为Sharp评分,分数越高表示手腕部骨破坏越严重[16]。
1.5.5 不良反应发生情况
记录患者的不良反应发生情况,包括头晕、恶心呕吐、腹泻、皮疹、白细胞减少、肝功能异常等。
1.6 统计学方法
采用SPSS 22.0软件对数据进行统计分析。不符合正态分布的计量资料以M(P25,P75)表示,采用非参数检验;符合正态分布的计量资料以±s表示,采用配对样本t检验、单因素方差分析及连续测量的方差分析;计数资料采用率或%表示,采用χ2检验。检验水准α=0.05。
2 结果
2.1 3组患者的临床疗效比较
治疗后,A 组ACR50、ACR70 患者比例均显著高于B、C 组(P<0.05),3 组间ACR20 患者比例以及B、C 组间ACR50、ACR70 患者比例比较,差异均无统计学意义(P>0.05)。结果见表2。
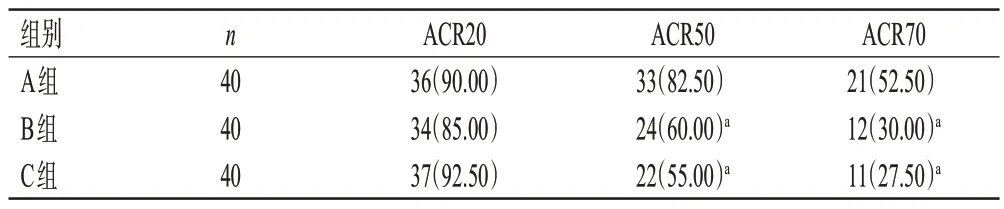
表2 3组患者的临床疗效比较[例(%)]
2.2 3组患者治疗前后的关节活动度比较
治疗前,3 组患者的DAS28 评分比较,差异无统计学意义(P>0.05)。治疗后,3组患者的DAS28评分均显著低于同组治疗前(P<0.05),且随治疗时间延长逐渐降低;治疗6个月时A组患者的DAS28评分显著低于B、C组(P<0.05);治疗1、3个月时,3组患者的DAS28评分及治疗6个月时B、C组的DAS28评分比较,差异均无统计学意义(P>0.05)。结果见表3。
表3 3组患者治疗前后的关节活动度比较(±s,分)
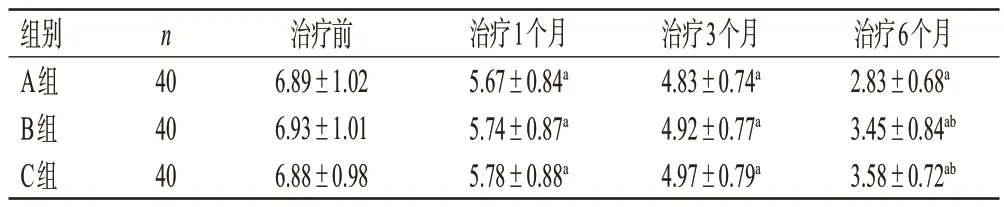
表3 3组患者治疗前后的关节活动度比较(±s,分)
a:与同组治疗前比较,P<0.05;b:与A组同期比较,P<0.05。
组别A组B组C组n 40 40 40治疗前6.89±1.02 6.93±1.01 6.88±0.98治疗1个月5.67±0.84a 5.74±0.87a 5.78±0.88a治疗3个月4.83±0.74a 4.92±0.77a 4.97±0.79a治疗6个月2.83±0.68a 3.45±0.84ab 3.58±0.72ab
2.3 3组患者治疗前后生化、免疫和血清细胞因子指标比较
治疗前,3组患者的生化、免疫和血清细胞因子指标比较,差异均无统计学意义(P>0.05)。治疗后,3 组患者的生化、免疫和血清细胞因子指标均显著低于同组治疗前(P<0.05),且随治疗时间延长逐渐降低;A 组患者治疗3 个月的CRP、ESR、IL-6、TNF-α 水平,治疗6 个月的RF、抗CCP 抗体、IL-6、TNF-α 水平均显著低于B、C组(P<0.05);B、C组的上述指标及治疗1个月时3组患者的生化、免疫和血清细胞因子指标比较,差异均无统计学意义(P>0.05)。结果见表4。
表4 3组患者治疗前后生化、免疫和血清细胞因子指标比较(±s)
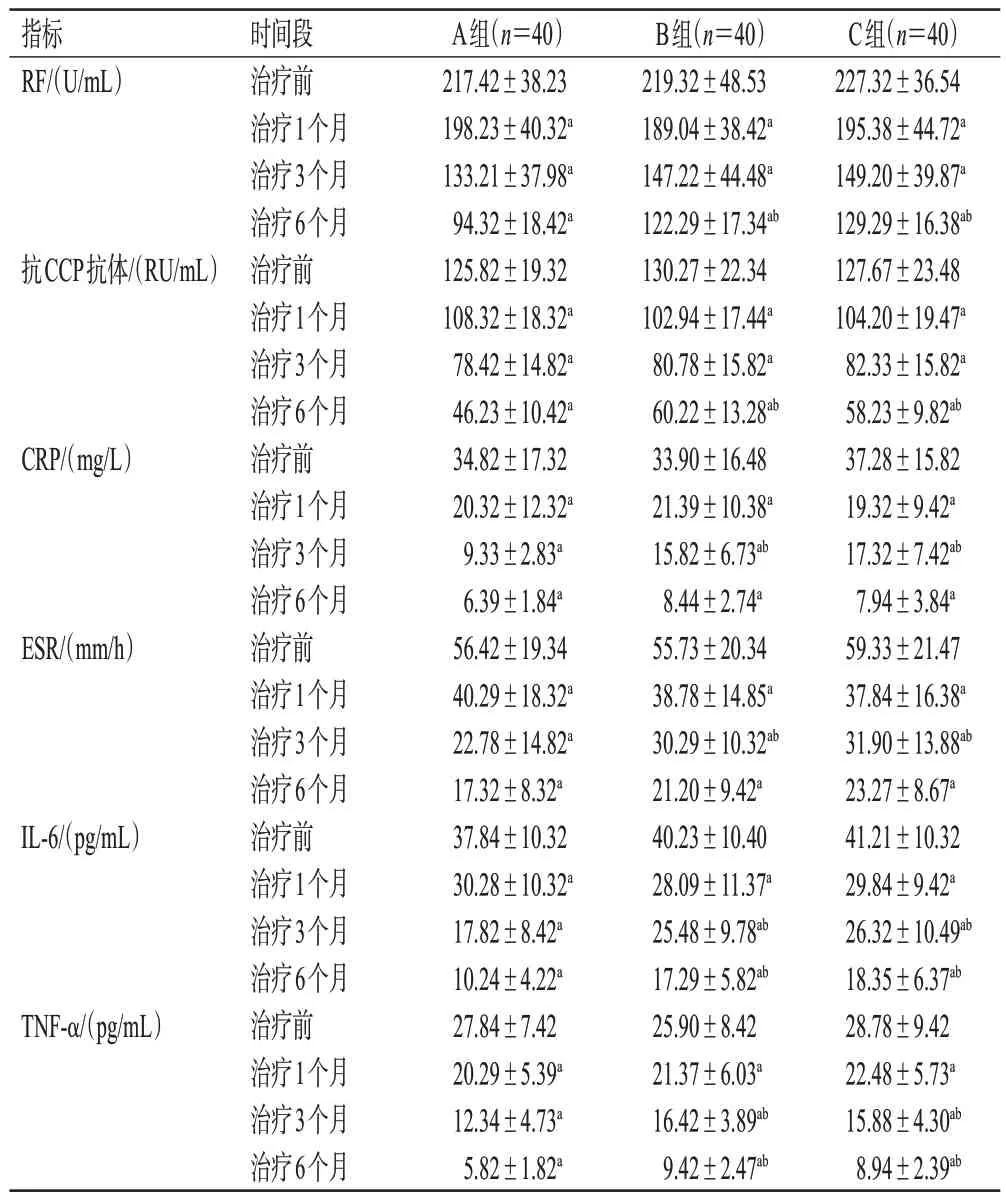
表4 3组患者治疗前后生化、免疫和血清细胞因子指标比较(±s)
a:与同组治疗前比较,P<0.05;b:与A组同期比较,P<0.05。
指标RF/(U/mL)抗CCP抗体/(RU/mL)CRP/(mg/L)ESR/(mm/h)IL-6/(pg/mL)TNF-α/(pg/mL)时间段治疗前治疗1个月治疗3个月治疗6个月治疗前治疗1个月治疗3个月治疗6个月治疗前治疗1个月治疗3个月治疗6个月治疗前治疗1个月治疗3个月治疗6个月治疗前治疗1个月治疗3个月治疗6个月治疗前治疗1个月治疗3个月治疗6个月A组(n=40)217.42±38.23 198.23±40.32a 133.21±37.98a 94.32±18.42a 125.82±19.32 108.32±18.32a 78.42±14.82a 46.23±10.42a 34.82±17.32 20.32±12.32a 9.33±2.83a 6.39±1.84a 56.42±19.34 40.29±18.32a 22.78±14.82a 17.32±8.32a 37.84±10.32 30.28±10.32a 17.82±8.42a 10.24±4.22a 27.84±7.42 20.29±5.39a 12.34±4.73a 5.82±1.82a B组(n=40)219.32±48.53 189.04±38.42a 147.22±44.48a 122.29±17.34ab 130.27±22.34 102.94±17.44a 80.78±15.82a 60.22±13.28ab 33.90±16.48 21.39±10.38a 15.82±6.73ab 8.44±2.74a 55.73±20.34 38.78±14.85a 30.29±10.32ab 21.20±9.42a 40.23±10.40 28.09±11.37a 25.48±9.78ab 17.29±5.82ab 25.90±8.42 21.37±6.03a 16.42±3.89ab 9.42±2.47ab C组(n=40)227.32±36.54 195.38±44.72a 149.20±39.87a 129.29±16.38ab 127.67±23.48 104.20±19.47a 82.33±15.82a 58.23±9.82ab 37.28±15.82 19.32±9.42a 17.32±7.42ab 7.94±3.84a 59.33±21.47 37.84±16.38a 31.90±13.88ab 23.27±8.67a 41.21±10.32 29.84±9.42a 26.32±10.49ab 18.35±6.37ab 28.78±9.42 22.48±5.73a 15.88±4.30ab 8.94±2.39ab
2.4 3组患者治疗前后的Sharp评分比较
治疗前,3 组患者的Sharp 评分比较,差异均无统计学意义(P>0.05)。治疗6 个月时,3 组患者的Sharp 评分均显著低于同组治疗前,且A组显著低于B、C组(P<0.05),而B、C 组比较差异无统计学意义(P>0.05)。结果见表5。
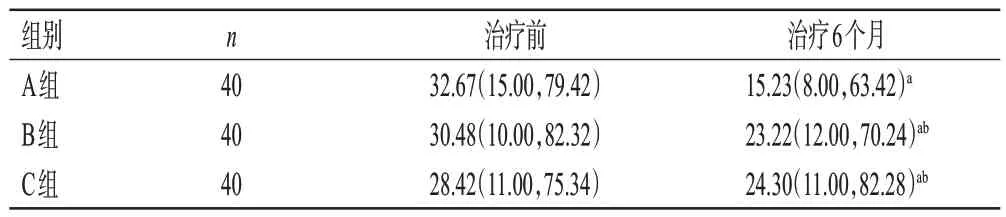
表5 3组患者治疗前后Sharp评分比较[M(P25,P75),分]
2.5 3组患者不良反应发生率比较
3组患者的腹泻、恶心呕吐、白细胞减少、皮疹、肝肾功能异常及头晕发生率比较,差异均无统计学意义(P>0.05)。结果见表6。
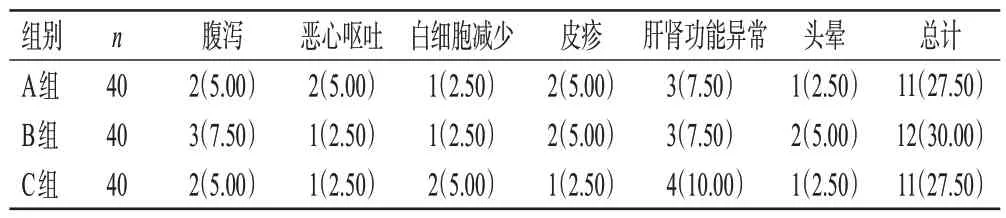
表6 3组患者不良反应发生率比较[例(%)]
3 讨论
RA与多种免疫细胞及炎症细胞的异常功能表达密切相关[17]。因此RA 的治疗以抑制炎症及免疫反应为主,辅以解热镇痛药物及靶向药物。对于难治性RA 尚无有效的治疗方案。有学者认为,在原有DMARDs 治疗基础上增加另一种或多种DMARDs(如来氟米特、柳氮磺吡啶、羟氯喹等)能缓解难治性RA的症状[18―19]。但长期使用多种药物会给患者带来一定的不良作用,如胃肠道反应、肝肾功能异常等,影响患者的生活质量。
托法替布可通过竞争性结合JAK1 和JAK3 的作用位点,阻断JAK-STAT信号通路,发挥阻断炎症及免疫效应的作用,从而缓解RA 的症状[20]。托法替布与三磷酸腺苷(adenosine triphosphate,ATP)在结构上具有高度的相似性,可以竞争性抑制JAK 的ATP 结合位点,阻断JAK 的磷酸化及下游STAT 的磷酸化,从而阻断JAKSTAT 的级联放大反应[21]。托法替布还可调控B 淋巴细胞的功能,抑制自身抗体的产生[22]。一项Ⅱ期临床试验结果显示,使用托法替布单药治疗6 个月后,患者达到ACR20 及ACR70 的比例均高于甲氨蝶呤单药组,同时这种临床获益基本可以维持较长时间,且总体Sharp 评分明显下降[23]。尽管托法替布在活动性RA上取得了显著效果,但其用于难治性RA 鲜有报道。羟氯喹为临床常用的非生物DMARDs,对抑制免疫反应具有一定的效果,在RA、系统性红斑狼疮等免疫性疾病中应用广泛。随着研究的深入,有学者发现了羟氯喹在其他方面的作用机制,如Lyu等[10]研究揭示了羟氯喹可通过JAK-STAT信号通路发挥抗肿瘤效应。Varma 等[9]研究显示,羟氯喹可以抑制小胶质细胞、星形胶质细胞等细胞内的STAT3 活性,与老年痴呆的发病羟氯喹存在一定的关联。这提示羟氯喹可能会对JAK-STAT信号通路发挥一定的调控作用。
本研究结果显示,A 组的ACR50、ACR70 患者比例均显著高于B、C组,这提示托法替布联合羟氯喹的总体疗效较好。治疗后,3组患者的DAS28评分、Sharp评分以及生化、免疫、血清细胞因子指标均显著低于同组治疗前,随治疗时间延长逐渐降低,且A组患者治疗6个月时的DAS28 评分、Sharp 评分、RF、抗CCP 抗体、IL-6、TNF-α水平均显著低于B、C组,这提示托法替布联合羟氯喹可显著降低炎症细胞水平,改善疾病严重程度。3组患者的腹泻、恶心呕吐、白细胞减少、皮疹及肝肾功能异常及头晕发生率比较,差异无统计学意义,这提示托法替布联合羟氯喹的安全性良好。
综上所述,托法替布联合羟氯喹治疗难治性RA 的疗效和安全性均较好。由于本研究纳入的样本量较少、观察时间较短,故所得结论有待后续研究进一步证实。
