拟南芥35S∶NAS2载体构建和转基因株系的筛选
2024-03-31王婷婷曹树青贾亚峰陈逸凡樊婷婷
王婷婷, 曹树青, 吴 席, 贾亚峰, 陈逸凡, 樊婷婷
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
铁是植物生长发育所必需的元素,参与植物生长的全过程。铁也是人们最早发现的植物微量元素,早在1843年发现生长在石灰性土壤上的葡萄叶片失绿症与缺铁有关,后经植物学家研究,将铁确定为植物生长的必需微量元素。土壤中的铁含量丰富,但可利用的铁含量是有限的[1]。铁在土壤中的溶解度特别低,以离子形式游离地存在于土壤中,很难与其他物质结合,因此导致植物能从土壤中吸收和利用的铁非常少[2]。在许多干旱、半干旱地区的石灰性土壤上广泛存在植物缺铁问题[3]。虽然植物根部吸收铁的机制已有大量的研究,但对植物感知缺铁机理的了解较少[4]。植物生长需要最佳水平的铁,铁用于能量生产、许多酶促过程,并且对于细胞代谢都是必不可少的[5]。植物缺铁会导致生长发育受限,引发植物缺铁性黄化病出现,可食用植物是人类一大饮食来源,植物的铁缺乏也会损害人类的健康[6]。
因此,运用植物转基因技术对植物品系进行改良优化显得格外重要。在之前的研究中发现,BZIP44和NAS2基因均参与到拟南芥的铁稳态中,BZIP44功能缺失突变体对缺铁表现敏感,NAS2功能缺失突变体对缺铁表现也敏感,且BZIP44功能缺失突变体在缺铁胁迫下NAS2基因表达紊乱,但这2个基因在植物的铁稳态中的遗传关系尚不清楚,为了进一步研究这2个基因对于调节铁稳态的机制,本文分别构建35S∶NAS2/WT和35S∶NAS2/bzip44转基因植株,为后续研究的开展奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
植物是哥伦比亚(col) 遗传背景的野生型(wild type,WT)拟南芥(Arabidopsisthaliana);T-DNA插入突变体bzip44-1(SALK-084241)从美国拟南芥种质资源中心获得,由合肥工业大学植物分子生物学实验室繁殖所得;载体构建所用质粒pART27,大肠杆菌DH5α,农杆菌GV3101。
1.1.2 主要试剂
Plasmid miniprep Kit (TIANGEN),T4-DNA Ligase(NEB),限制性内切酶KpnⅠ(NEB),HinDⅢ (NEB),PrimeSTAR HS DNA Polymerase (TaKaRa),2×San Taq PCR Mix(Sangon Biotech),DNA loading buffer,异丙醇,无水乙醇,氯仿,SDS,Tris-HCl,RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific)等。
1.2 方法
1.2.1 拟南芥无菌苗的培养
配制MS固体培养基,称取MS、琼脂和蔗糖,待溶解后调节其pH值至 5.8,封上封口膜后用高压灭菌锅121 ℃、101 kPa高压蒸汽灭菌20 min,灭菌后得到无菌固体培养基,并将其倒入同样灭菌后的培养皿中。用0.1% 氯化汞对种子杀菌消毒后,将种子均匀点在培养基上。4 ℃冰箱中春化2 d,在22 ℃、16 h光照时长的培养箱中竖直培养 14 d。
1.2.2 拟南芥RNA的提取及反转录
实验前将研钵洗净烘干后,用锡箔纸包好,置于180 ℃烘箱烘4 h,待冷却至室温后再放到-20 ℃冰柜预冷。将样品置于预冷的研钵中,加液氮研磨,组织充分研碎后,加入1 mLTrizol溶液,继续研磨至完全融化。室温放置5 min,使样品充分裂解。离心机4 ℃、12 000 r/min离心10 min,取上清液静置5 min。加入0.2 mL氯仿,剧烈震荡晃动15 s后,室温放置5 min。离心机4 ℃、12 000 r/min离心15 min,吸取500 μL含总RNA的上层无色液体至新的离心管中。加入0.5 mL异丙醇,颠倒混匀后于室温下放置沉淀10 min。离心机4 ℃、12 000 r/min离心10 min,弃上清。加入1 mL用DEPC水配制的75%乙醇溶液,颠倒混匀。离心机4 ℃、7 500 r/min离心5 min,弃上清。待RNA晾干后加入20 μL DEPC水溶解,检测纯度及浓度,-20 ℃冰箱保存。
将检测好纯度和浓度的总RNA,根据Thermo Scientific公司提供的RevertAid First Strand cDNA Synthesis Kit反转录试剂盒说明书反转合成cDNA。反应总体系为20 μL,在冰上进行操作,产物置于-20 ℃冰箱保存。
1.2.3 拟南芥DNA的提取
取出于培养皿中培养的拟南芥,置于预冷的研钵中,加入液氮研磨至粉碎后,加入400 μL SDS DNA提取液继续研磨,待充分研磨后转移至离心管中,12 000 r/min、4 ℃离心10 min后,取上清液200 μL于另一新的离心管中,再加入200 μL异丙醇,12 000 r/min离心10 min,离心后弃去管中的上清液,加入800 μL体积分数为70%的乙醇,12 000 r/min离心5 min。离心后去上清,将沉淀置于通风橱15 min,待乙醇蒸发后,加入30 μL的无菌双蒸水,获得DNA溶液,置于-20 ℃冷冻保存。
1.2.4NAS2的CDS区域基因片段的克隆
利用Oligo 7.0软件设计以下引物进行NAS2的CDS区域基因片段克隆。上游引物FP为:
3’-GAGAACACGGGGGACGGTACCATGGCT
TGCGAAAACAACCTC-5’;
下游引物RP为:
5’-GGGGAAATTCGAGCTAAGCTTTTACTCGA
TGGCACTATACTCCTCG-3’。
以野生型拟南芥RNA反转录的cDNA为扩增模板进行克隆。
1.2.5 大肠杆菌和农杆菌的转化
从-80 ℃冰箱中取出存储的大肠杆菌DH5α感受态细胞,放置于冰上自然溶解。吸取 5 μL连接产物加入到感受态细胞中,吹打混匀,冰上放置30 min,在42 ℃金属浴中热激 60 s,再放置于冰上冷激 2 min。在热激和冷激后的感受态中加入无抗性的600 μL LB 液体培养基,放在 37 ℃恒温摇床中低速振荡培养1~2 h。待培养完成后,涂布于加有壮观霉素的LB固体培养基上。平板倒置在37 ℃恒温培养箱中培养过夜。次日挑取培养基上的单菌落,接种于加入壮观霉素的LB液体培养基中,振荡培养6 h后进行聚合酶链式反应(polymerase chain reaction,PCR)鉴定,选取阳性克隆进行测序,并对结果分析比对,正确后得到具有重组质粒的大肠杆菌菌株。
取出存储于-80 ℃冰箱中的农杆菌感受态细胞(GV3101),置于冰上解冻。取2 μL重组质粒加入到感受态细胞中,混匀,吸取至已预冷的1 cm电击杯中,在电转仪中电击后迅速加入600 μL无抗性的LB 液体培养基,28 ℃摇床培养2~3 h,涂布于同时添加有壮观霉素和庆大霉素的固体LB培养基上,置于28 ℃培养箱中培养2 d。培养皿上挑取单菌落接种于添加有壮观霉素和庆大霉素的液体培养基中,28 ℃摇床培养至指数增长期,然后进行PCR鉴定。
1.2.6 浸花侵染法获得转基因拟南芥
将阳性农杆菌接种于添加有壮观霉素和庆大霉素的液体培养基中,振荡培养至A600为1.2~1.4,离心去上清,用侵染缓冲液重悬至溶液A600为0.8~1.2,最后加入一定量的表面活性剂SilwettL-77 混匀,侵染花序,黑暗处理12 h。第1次侵染后隔8 d,进行第2次侵染。
1.2.7 转基因阳性植株的鉴定
将获得的拟南芥种子置于含有卡那霉素的MS固体培养基中进行抗性筛选,培养箱培养7 d,将具有根且子叶颜色嫩绿的幼苗移栽至土质培养基中,再提取DNA,经PCR鉴定正确后,即获得转基因阳性植株。
2 结果与分析
2.1 NAS2的CDS区域的克隆结果
为了确定NAS2基因在拟南芥突变体bzip44响应缺铁胁迫中的作用,本文构建35S∶NAS2/bzip44载体。以拟南芥野生型的cDNA作为模板,采用PCR技术扩增片段,得到NAS2的CDS区域,且片段大小与NAS2的实际大小963 bp一致,如图1所示。图1中,M代表Marker,下同。
2.2 目的片段和质粒双酶切
使用KpnⅠ、HindⅢ 2种限制性内切酶对NAS2的CDS区域以及pART27质粒进行酶切,如图2所示,得到具有相同黏性末端的片段和质粒,且片段大小与NAS2的实际大一致,质粒大小与pART27质粒的实际大小一致。
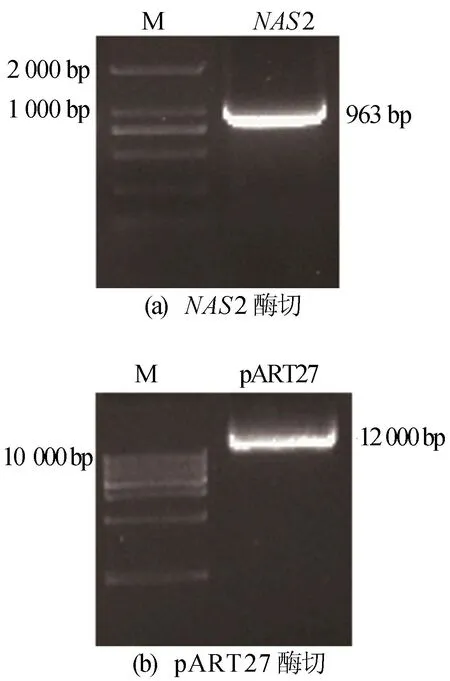
图2 NAS2和pART27的双酶切
2.3 连接和大肠杆菌转化后阳性克隆鉴定
用T4连接酶将酶切后的目的片段和质粒在16 ℃的条件下进行过夜连接,得到的连接产物采用热激法转入大肠杆菌DH5α感受态中,将菌涂布于加有壮观霉素的固体培养基中培养过夜,挑取单克隆菌落置于加有壮观霉素的液体培养基中振荡培养至菌液浑浊。将得到的单克隆菌液进行PCR鉴定,如图3所示,选择2号菌送去测序,经测序后选择测序正确的2号菌液进行后续实验。图3中,1~7号表示在培养基中随机挑取的大肠杆菌单克隆菌落培养的菌液。
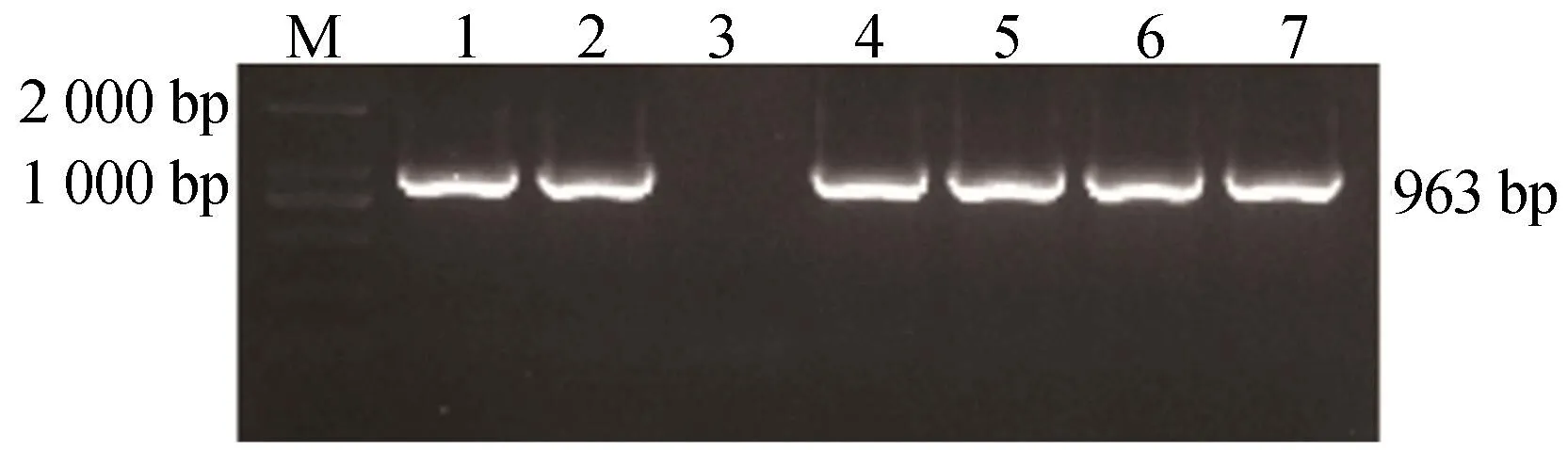
图3 大肠杆菌PCR鉴定结果
2.4 农杆菌转化分析
将重组质粒用电击转化法转入GV3101农杆菌感受态中,鉴定结果如图4所示,选取3号菌进行扩大培养。图4中,1~7号表示在培养基中随机挑取的农杆菌单克隆菌落培养的菌液。
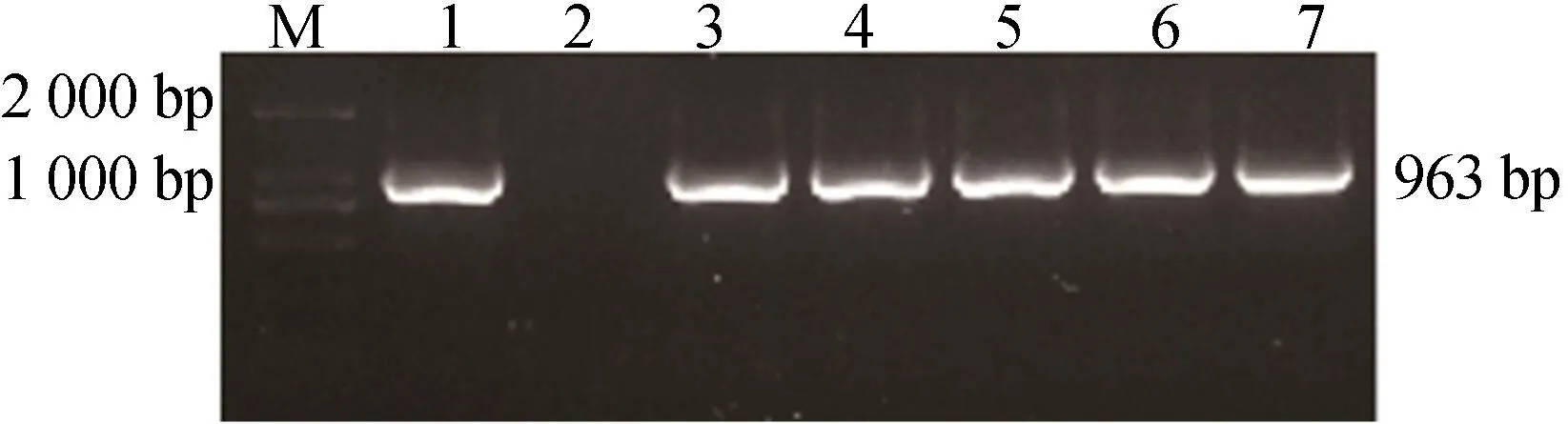
图4 农杆菌PCR鉴定结果
2.5 拟南芥bzip44突变体鉴定及花序侵染分析
为了确保实验的成功,需要鉴定被侵染的拟南芥株系是否为纯合的bzip44突变体植株,分别用bzip44的FP和RP以及SALK BP和bzip44的RP进行鉴定,用bzip44的FP和RP鉴定,如图5a所示,1~6号没有条带,野生型有大小为1 500 bp的条带,说明被检测的拟南芥株系中没有BZIP44基因,用SALK BP和bzip44的RP鉴定,如图5b所示。图5中,1~7号表示土培的bzip44纯合体植株。
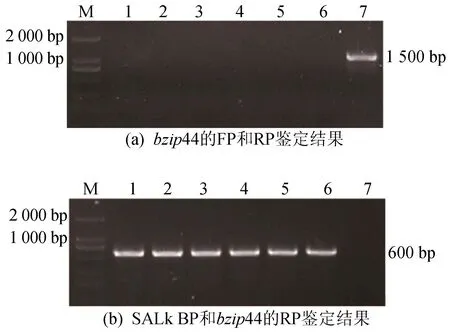
图5 bzip44突变体鉴定结果
由图5b可知,野生型没有条带,但1~6号有大小为600 bp的条带,说明SALK BP有插入到拟南芥的这些株系中,因此1~6号都为纯合体。接着采用浸花浸染法分别侵染野生型(WT)拟南芥和bzip44突变体植株,反复侵染3遍得到侵染后的种子。
2.6 转基因植株的抗性筛选分析
将侵染后收到的种子撒在加有卡那霉素的1/2 MS固体培养基中,得到的阳性植株如图6所示。

图6 阳性植株筛选结果
2.7 转基因阳性植株的鉴定结果分析
提取阳性植株的DNA进行鉴定,结果如图7所示。
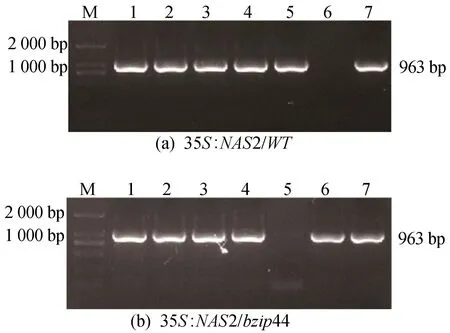
图7 阳性植株鉴定图
图7中,1~7号表示抗性筛选出的疑似阳性植株,且片段大小与NAS2的实际大小一致,根据鉴定结果选择1号植株作为阳性35S∶NAS2/WT植株,并选择1号植株作为阳性35S∶NAS2/bzip44植株,进一步通过抗性分离纯合得到阳性植株。
2.8 纯合体筛选结果分析
将鉴定正确的阳性植株进行土培繁殖,每一代植株都采用抗性分离比筛选,如图8所示,在第3代得到纯合的35S∶NAS2/WT和35S∶NAS2/bzip44植株。

图8 转基因植株的抗性分离比
3 讨 论
土壤缺铁问题在全球都很普遍,大约有1/3的可耕种土壤存在缺铁问题[7]。与此同时,土壤缺铁问题带来的副作用也会接踵而至,如植物缺铁性黄化病、缺铁严重时还会出现叶片灰白的现象等,甚至会危及到人类的健康[8],因此解决土壤缺铁引发的植物缺铁问题至关重要。
本研究涉及到的转录因子为bZIP家族中的BZIP44基因,bZIP转录因子是所有真核生物都具有的转录因子[9]。有报道称bZIP转录因子在植物干旱胁迫响应中起着重要的调节作用,并在水稻中发现了一种新型的干旱胁迫相关bZIP转录因子OsbZIP62,该基因参与ABA信号通路,通过调控胁迫相关基因的表达正向调控水稻的耐旱性[10]。
本研究所用种子从拟南芥种子资源中心获得,分别为拟南芥哥伦比亚背景的野生型和BZIP44基因功能缺失型突变体。前期研究结果显示,BZIP44基因参与植物对缺铁胁迫的响应,且其可以通过调控NAS2基因的表达参与植物对缺铁胁迫的响应,为了进一步研究基因NAS2和BZIP44在拟南芥缺铁胁迫响应中的遗传关系,通过基因工程技术构建35S∶NAS2重组载体,分别将其转入野生型拟南芥和BZIP44基因功能缺失型突变体中,从而获得35S∶NAS2/WT及35S∶NAS2/bzip44转基因植株。本文为研究NAS2基因和BZIP44基因在植物体中响应缺铁胁迫的遗传关系奠定了良好的基础。
