新型酸响应聚集型金纳米粒子制备与光热性能
2024-03-31孙天赐肖正昊王慧庆
汪 翔, 孙天赐, 肖正昊, 王慧庆
(合肥工业大学 化学与化工学院,安徽 合肥 230009)
0 引 言
近红外光热治疗肿瘤是将有光热转换功能的纳米材料注射聚集于肿瘤组织,在外部近红外光源的照射下材料将光能转化为热能来杀死癌细胞的治疗方法[1]。近红外光拥有穿透组织深度深、衰减弱和对组织损伤小等优点[2]。此外,近红外光还能实现对肿瘤区域照射,达到最大限度地减少副作用的效果[3]。金、银、铂、钯等贵金属材料是目前近红外治疗研究最多的材料之一。其中金纳米粒子(gold nanoparticles,Au NPs)因其生物条件下稳定性好,使其成为研究最多的光热传导材料[4],也是有前途的肿瘤光热治疗剂[5]。其光热治疗效果与尺寸有关,只有尺寸大于50 nm的金纳米粒子才有强烈的近红外吸收。但与大颗粒相比,小尺寸金纳米粒子在血液中停留时间更长,更容易进入肿瘤组织。为了解决上述矛盾,目前已开发许多将金纳米粒子组装成新型功能材料技术[6],例如通过肿瘤局部微环境刺激响应(氧化还原响应[7]、pH响应[8]或特异性酶[9])诱导该粒子聚集引起越来越多的研发兴趣。
与正常组织相比较,肿瘤部位呈酸性微环境。本文合成了pH响应性原酸酯亲水链,并将其修饰到金纳米粒子表面,制备新型酸性响应聚集型金纳米粒子材料。在中性环境下金纳米粒子稳定分散,而在酸性环境下,原酸酯键断裂、亲水链解离、疏水基团暴露,引起金纳米粒子的聚集,并呈更大尺寸团簇,以提升金纳米对近红外的吸收能力。对比研究了这种酸敏感修饰和传统无响应性修饰的金纳米粒子的光热效率。本文方法可以拓展到其他肿瘤光热治疗纳米材料上,为提高肿瘤光热治疗效果提供新策略。
1 实验部分
1.1 实验原料
原甲酸三甲酯、3-氨基-1,2-丙二醇、三氟乙酸乙酯、对甲苯磺酸一水合物、聚乙二醇单甲醚、氯金酸、溴代异丁酰溴均购自阿拉丁生化科技股份有限公司;碳酸氢钠、氯化钠、硼氢化钠均购自国药集团化学试剂有限公司。
化学结构采用安捷伦VNMR S600型核磁共振氢谱仪(proton nuclear magnetic resonance,1H NMR)进行测试;样品形貌结构采用日本JEM-2100F型场发射透射电子显微镜(field emlssion transmission electron microscope,FETEM)分析。
1.2 实验过程
1.2.1 pH敏感原酸酯亲水链的合成
pH敏感原酸酯亲水链的合成是根据文献[10]的方法稍加改动, 具体过程如图1所示。

图1 原酸酯亲水链的合成过程示意图
在氮气保护下,向120 mL 3-氨基-1,2-丙二醇(18.80 g, 0.21 mol)的DCM溶液中滴加三氟乙酸乙酯(34.30 g, 0.24 mol),反应4 h,蒸发溶剂,残液溶解于200 mL乙酸乙酯中用饱和KHSO4和NaCl洗涤,经MgSO4干燥获得产物P1。
将P1 (13.50 g,72.15 mmol)与原甲酸三甲酯(34.89 g,0.33 mol)溶解于110 mL DCM后,加入微量对甲苯磺酸(p-TSA),室温下反应6 h,除去溶剂后溶于250 mL乙酸乙酯中,用饱和碳酸氢钠和盐水依次洗涤,用MgSO4干燥获得产物P2。
将上述P2(3 g,13 mmol)溶于30 ml甲苯,加入PEG-OH (16.3 g, 3.2 mmoL),p-TSA (0.025 g, 0.13 mmol),吡啶(0.13 mL, 1.5 mmol), 110 ℃回流过夜,冷却到室温后与过量冷乙醚混合,过滤,真空干燥获得产物P3。
将P3(6.0 g, 1.0 mmol)溶解于30 mL THF,在0 ℃下逐滴加入30 mL 4% NaOH水溶液,常温下反应过夜,蒸发除去THF后用DCM萃取,用K2CO3干燥后过滤、浓缩,得到产物P4。
将P4 (3 g,0.6 mmol)和三乙胺(200 mg,2 mmol)在溶于25 mL DCM中,0 ℃条件下逐滴加入溴乙酰溴(0.37 g,1.8 mmol)后反应4 h,反应产物过滤后用CHCl3萃取剩余有机溶液,并用无水K2CO3干燥后浓缩得到P5。
将P5(2.3 g,0.1 mmol)和硫代乙酸钾(45.7 mg,0.4 mmol)溶于20 mL DMF,反应24 h后过滤、浓缩、干燥得到P6。
将P6(2.3 g,0.1 mmol)溶于6 mL DMF为溶剂, 在避光条件下加入3 mL哌啶进行切断反应,反应24 h后,过滤、浓缩、干燥得到末端为巯基的原酸酯亲水链P7(POE-SH)。
1.2.2 POE-Au NPs和PEG-Au NPs的制备
用去离子水将2.5 mL HAuCl4溶液(2.2 mg/mL) 稀释至50 mL,在强力磁搅拌下加热至沸腾。随后将2 mL 1%柠檬酸钠溶液快速加入混合物中,继续煮沸直到溶液变为酒红色获得 Au NPs。将1 mL Au NPs与5 mL PEG-SH (1 mg/mL)或POE-SH (1 mg/mL)在 37 ℃以150 r/min搅拌速度下孵育8 h以上,获得PEG-Au NPs或POE-Au NPs。合成过程如图2所示。
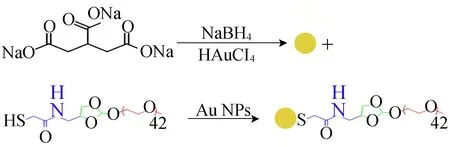
图2 POE-Au NPs的合成
1.2.3 光热性能测试
取上述 1 mL POE-Au NPs和PEG-Au NPs溶液置于石英皿粒度池中,并将溶液pH值调整为5.5左右,静置1 h后,用近红外 808 nm 激光器,并以2 W/cm2的功率分别照射,用红外热成像仪器实时监测溶液的温度,每隔 30 s 记录1次相应温度。
1.2.4 细胞安全性测试
新型金纳米材料的生物安全性采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法[11]评估。将人脐静脉内皮细胞 (HUVECs)以5×104个/孔接种于含有细胞培养基的96孔板中,孵化24 h后,加入不同浓度的PEG-Au NPs和 POE-Au NPs后共培养24 h。用PBS洗涤3次后在每个孔板中加入50 μL MTT(1 mg/mL),继续培养4 h。去除上清液后加入100 μLDMSO摇匀,用Elx800分光光度酶标仪(BioTek,USA)测定570 nm处的吸光值,计算相对细胞活性。
2 结果与讨论
2.1 pH敏感原酸酯亲水链的1H NMR谱图
本文设计合成的新型pH敏感原酸酯亲水链合成过程中系列产物的1H NMR谱图如图3所示。

图3 新型原酸酯亲水链合成系列产物的1HNMR谱图
P1的1H NMR谱图如图3a所示,由图3a可知:δ=9.24×10-6为仲胺的质子峰;δ=4.87×10-6、4.62×10-6为2个羟基质子峰;δ=3.62×10-6为次甲基吸收峰;δ在3.04×10-6~3.34×10-6间为2个亚甲基吸收峰。
P2的1H NMR谱图如图3b所示,由图3b可知:δ在5.60×10-6~5.64×10-6间为五元环上原酸酯特征吸收峰;δ在4.29×10-6~4.36×10-6间为五元环上次甲基吸收峰;δ在3.59×10-6~4.04×10-6间为五元环外亚甲基吸收峰;δ在3.36×10-6~3.54×10-6间为五元环上亚甲基吸收峰;δ在3.16×10-6~3.24×10-6间为甲基吸收峰。
P3的1H NMR谱图如图3c所示,由图3c可知:δ=8.16×10-6为仲胺质子峰,δ在5.84×10-6~5.92×10-6间为五元环上原酸酯特征峰,表明五元环未被破坏;δ在3.52×10-6~3.78×10-6间为五元环外OCH2CH2O—质子峰,表明成功接上PEG链段。
P4的1H NMR谱图如图3d所示,由图3d可知:δ在5.84×10-6~5.87×10-6间为五元环上原酸酯特征峰;δ在3.49×10-6~3.69×10-6间为五元环外OCH2CH2O—的质子峰。
P5的1HNMR谱图如图3e所示,由图3e可知,δ=4.15×10-6为溴乙酰溴亚甲基峰,δ在5.89×10-6~5.97×10-6间为原酸酯特征峰。P6的1H NMR谱图如图3f所示,由图3f可知,δ=5.82×10-6原酸酯的特征峰仍然存在,δ=2.3×10-6为羰基处的甲基峰。P7的1HNMR谱图如图3g所示,由图3g可知,δ=5.82×10-6原酸酯特征峰保留,δ=2.3×10-6处的甲基峰消失,证明目标原酸酯亲水链的成功制备。
2.2 金纳米的形貌与pH响应性
用TEM观察PEG-Au NPs和 POE-Au NPs 2种金纳米粒子在不同pH值下的形貌和尺寸,如图4所示。
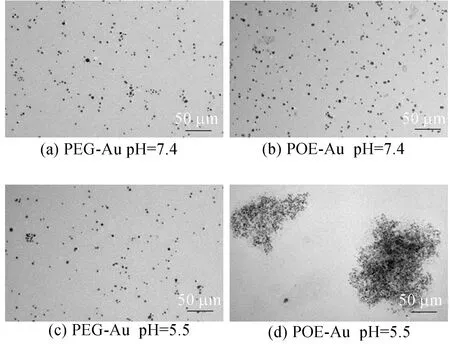
图4 不同pH值条件下PEG-Au和 POE-Au 的TEM照片
由图4可知, pH=7.4时PEG-Au NPs和POE-Au NPs金纳米粒子呈单分散的球形,尺寸在5 nm左右;而置于模拟肿瘤酸性(pH=5.5)微环境下1 h后,观察到PEG-Au NPs形态未发生改变(图4c),POE-Au NPs聚集成几百纳米的团簇,其原理如图5所示。在酸性条件下,金纳米表面修饰链从原酸酯键处断裂、亲水链段被切断,使得疏水性基团暴露出来,金纳米体从而聚集成更大尺寸的金纳米团簇。

图5 POE-Au NPs酸响应聚集示意图
2.3 酸性下金纳米粒子的光热效应
将PEG-Au NPs和 POE-Au NPs 2种金纳米水溶液(200 μg/mL)调节pH=5.5,1 h后用808 nm激光照射(辐照剂量2 W/cm2),并记录照射时间与光热转化后的溶液升温和降温结果,如图6所示。从图6可以看出,在相同质量浓度、相同激光功率下,随着照射时间延长PEG-Au NPs和 POE-Au NPs均发生升温现象,在照射15 min后PEG-Au NPs水溶液温度升到峰值50.5 ℃,而POE-Au NPs水溶液温度能达58.7 ℃,根据公式[11]计算出光热转换效率从47.6% 提高到了58.8%。从而证实经原酸酯亲水链修饰后的金纳米粒子因酸响应性聚集对近红外区的吸收能力更强,表现出更加优异的光热性能。
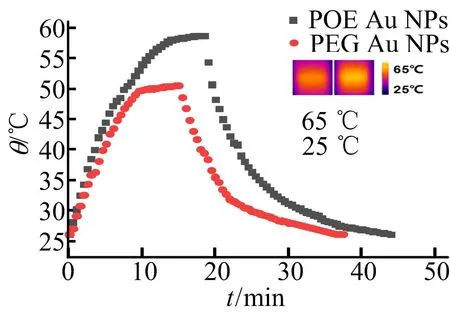
图6 POE-Au NPs与PEG-Au NPs水溶液的升降温曲线
2.4 生物安全性分析
本文进一步用MTT法评估了新型酸响应性金纳米材料的细胞安全性。将不同质量浓度(0、50、100、150、200 μg/mL)的PEG-Au NPs和 POE-Au NPs 2种金纳米粒子与HUVECs细胞共培养时的细胞活性如图7所示。
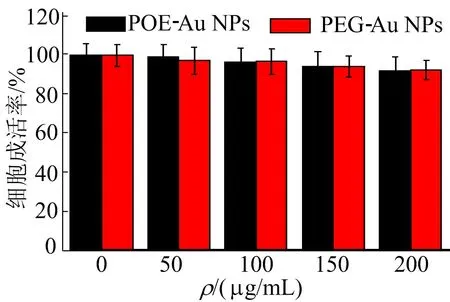
图7 PEG-Au NPs和 POE-Au NPs的细胞毒性
由图7可知,当金纳米粒子的质量浓度高达200 μg/mL时,PEG-Au NPs和 POE-Au NPs 2种金纳米粒子的相对细胞活性仍然高于92%,表明2种金纳米粒子均具有很高的细胞安全性。
3 结 论
本文合成了一种表面修饰了含酸敏感原酸酯基亲水链的金纳米粒子POE-Au NPs。TEM显示,POE-Au NPs在pH=5.5条件下会因表面原酸酯键断裂、亲水链的解离、疏水基团暴露而从5 nm单分散体聚集成几百纳米的团簇。光热效果测试表明,酸响应聚集后的POE-Au NPs显示出比单分散性PEG-Au NPs更高的光热转换效率,此外细胞安全性评估结果证实POE-Au NPs具有良好的生物安全性。这种新型酸响应聚集性金纳米粒子的设计制备为开发高效抗肿瘤光热治疗材料提供了新策略。
