碳量子点的制备、环境应用和生物毒性
2024-03-28盛优莹王贺飞胡小婕高彦征南京农业大学资源与环境科学学院江苏南京20095吉林大学地下水资源与环境教育部重点实验室吉林长春002沈阳环境科学研究院辽宁沈阳067
盛优莹,王贺飞,2*,苏 燕,沈 可,胡小婕,高彦征(.南京农业大学资源与环境科学学院,江苏 南京 20095;2.吉林大学,地下水资源与环境教育部重点实验室,吉林 长春 002;.沈阳环境科学研究院,辽宁 沈阳 067)
碳量子点(CQDs),又称为碳点或碳纳米点,是一种零维碳纳米材料,尺寸小于10nm,由超细、分散、准球形的碳纳米颗粒组成,具有良好的荧光性能[1].CQDs 的层间距通常约为0.34nm,这与石墨的晶面间距相一致[2].现有的合成CQDs 以碳为基本骨架,表面上具有丰富的含氧基团,如羧基和羟基,并且这些基团的分布不均匀[3].
CQDs 的发现最早可以追溯到2004 年,Xu 等[4]在电泳纯化过程中通过电弧放电制备单壁碳纳米管的时候,意外得到了荧光碳纳米颗粒.与传统半导体量子点相比,CQDs 的最大优点是低细胞毒性,高生物相容性及很好的环境友好性[5].除此之外,CQDs还具有良好的水溶性和光学性质,其制备成本较低,前驱体来源十分广泛,西兰花[6]、竹叶[7]、毛发[8]、甘蔗渣[9]、橙皮[6]等都是良好的制备原料.这些优良性质使得CQDs 广泛应用于荧光检测[10]、污染物降解[11]、电化学传感器[12]等环境领域.此外,与其他的纳米材料相似,CQDs 在生产、存储、运输、使用、回收等过程中将不可避免地泄露到环境中,造成一定的毒性.明确其生物毒性对于正确理解和评估CQDs 的环境风险,制定合理的回收处理对策具有重要意义.本文着重介绍了CQDs 的制备方法,探讨了不同方法的优缺点,同时对CQDs 在环境领域的应用及其生物毒性进行了综述,以期为选择合适的CQDs 制备方法、提高产率等提供技术参考,为CQDs 在环境领域的应用提供方法支持.
1 CQDs 的制备
自CQDs 被发现以来,CQDs 的制备方法被广泛报道,研究人员仍在不断探索简便、低成本、尺寸可控、高产量与高质量的制备方法,如何基于用途精准控制合成CQDs 的粒径是当前亟需突破的难点.目前CQDs 的制备方法主要包含两类:自上而下法和自下而上法.自上而下的合成法是通过物理和化学方法裂解或破坏富碳材料的结构,随后纯化将尺寸控制在2~10nm,从而得到可有效发光的CQDs;自下而上的合成法是在原子或分子尺度上对碳材料的结构和性能进行设计和裁剪,最终得到CQDs 的方法,这种方法通常是以有机小分子或芳香小分子为前体,在适当的条件下进行热解或碳化反应,从而形成具有所需尺寸和性质的CQDs[13](图1).自上而下法通常包括:电弧放电法、电化学法、化学氧化法、激光蚀刻法和机械球磨法等.自下而上法通常有:微波合成法、水热/溶剂热合成法、模板合成法、热解合成法和反胶束法等(图2).
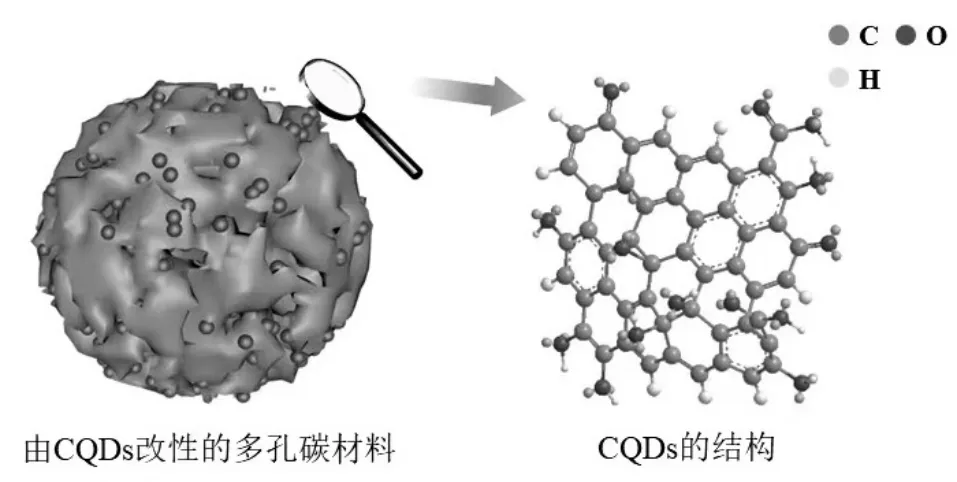
图1 CQDs 的结构Fig.1 Structure of CQDs
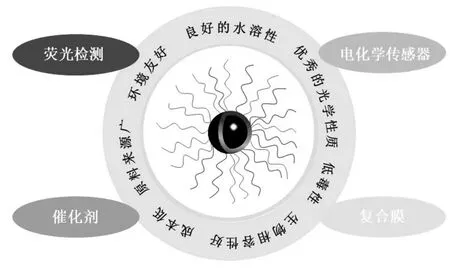
图2 CQDs 的优点及其在环境领域应用Fig.2 Advantages of CQDs and their applications in environmental field
1.1 自上而下法
1.1.1 电弧放电法 电弧放电法是最早的CQDs制备方法.将原料颗粒放置在由阴阳两极组成的反应室中,施加高电压以产生弧放电,电弧的高温和高能量会将原料颗粒加热至极高温度,使其发生热解和炭化反应,以此制成CQDs.2021 年,Chao 等[14]利用水中电弧放电制备CQDs,得到的CQDs 尺寸分布在1~5nm 范围内,量子产率为16%,并且制得的CQDs可用于评估培养细胞的活力.电弧放电法适用于不同种类的生物质原料,并且制得的CQDs 具有较好的荧光特性,但该方法耗能较高,分离纯化过程较为复杂,难以应用于工业化生产.
1.1.2 电化学法 电化学法是一种制备CQDs 的常用方法.在这个过程中,石墨等碳基材料通常被用作工作电极,并在调节电压和电流的过程中发生氧化还原反应,从而将大块碳基材料剥离形成细小的碳纳米颗粒,即CQDs. Kang 等[15]以石墨棒为阴极和阳极,NaOH/EtOH 为电解液,控制电流为 10~200mA/cm2,制得了颗粒尺寸可控、具有稳定和较强荧光效应的CQDs,量子产率约为12%.同时,用酸电解液作为对照试验,结果表明碱性环境是形成CQDs的关键因素.Li 等[16]采用不同的无机溶液为电解质,以石墨棒为前驱体制备CQDs,结果发现在硝酸溶液中剥离的CQDs 平均尺寸更大,为3.15nm,形貌也更易于区分.电化学法制备工艺成本低、操作简便,是一种绿色的CQDs 合成方法.
1.1.3 化学氧化法 化学氧化法是将CQDs 前驱体与硝酸、过硫酸铵等氧化剂混合在一起,在适当的温度和反应时间下反应,制备CQDs 的方法.Boruah等[17]以废弃生物质甘蔗渣、芋头皮和大蒜皮为前体材料,将样品置于300℃的惰性气体中碳化,并利用30%的过氧化氢对氧化处理碳化样品,最终制得CQDs,结果表明三种生物质材料的量子产率芋头皮(26.20%)>大蒜皮(13.80%)>甘蔗渣(4.45%).Dong等[18]以活性炭为碳源,硝酸为氧化剂,用化学氧化法制得了尺寸在3~4nm、表面羟基丰富的CQDs,量子产率>10%.可见,活性炭制备CQDs 具有低成本、高收率、制备方便的优势.然而,化学氧化法常需用到强氧化性或强腐蚀性的反应物,制备过程有一定的安全隐患,对反应条件的要求较高.
1.1.4 激光蚀刻法 激光蚀刻法利用激光束照射含碳前驱体,从前驱体中剥落出碳纳米颗粒,接着将碳纳米颗粒进一步纯化从而得到CQDs.相对于其他方法,激光蚀刻法具有耗时少、操作简单等优点,在激光烧蚀过程中,激光束聚焦在原材料上,通过局部的高温和高压作用,可将原材料直接切割成纳米颗粒,避免了杂质的引入[13].2006 年,Sun 等[19]首次利用该方法成功制备出了CQDs,在900℃、75kPa 的氩气流中,他们将石墨粉和水泥混合而成的碳前驱体携带水蒸气进行激光烧蚀,并将所得样品置于硝酸水溶液中回流12h,最终制得CQDs,量子产率为4%~10%.快速、高效、高量子产率是CQDs 制备的重要目标,于是Cui 等[20]采用分束器将单束激光分成双束,这不仅缩短了激光烧蚀时间,还提高了烧蚀产量;更重要的是,通过双束脉冲激光烧蚀法获得的CQDs 比单束脉冲激光烧蚀法获得的CQDs 更加均匀,且量子产率高达35.4%.
1.2 自下而上法
1.2.1 微波合成法 微波合成法因其简单、省时的优点越来越受到人们的关注,其基本原理是利用微波辐射来驱动碳源的炭化反应,并通过控制微波辐射功率、温度等反应条件实现CQDs 的生产.2009年,Zhu 等[21]将不同量的聚乙二醇(PEG-200)和糖类物质(葡萄糖、果糖等)加入蒸馏水中,形成透明溶液,然后将溶液放入500W 的微波炉中加热2~10min,随着时间的推移,溶液由无色变为黄色,最后变为深棕色,预示着首次成功利用微波合成法制得CQDs.如图3 所示,Hu 等[10]将1g 干橙皮粉末与10mL 乙二醇混合,用900W 的微波炉加热1min 后,溶液由橙黄色变为褐色,表明CQDs 的形成.

图3 微波合成法制备CQDs 流程[6]Fig.3 Microwave synthesis process for preparation of CQDs
1.2.2 水热/溶剂热合成法 水热/溶剂热合成法是制备CQDs 十分常见的一种方法,在高温高压的条件下,于适当的溶剂中使用聚合物或碳源进行炭化反应,便可形成CQDs. Jagannathan 等[22]以玉米芯为原料,通过水热合成法制得白色荧光CQDs,量子产率为53.46%,该CQDs 的光致发光强度对Pb2+、Cu2+、Fe3+和Cr3+等金属离子表现出良好的传感特性.Zhou 等[23]以等量的柠檬酸和谷胱甘肽为前驱体,通过溶剂热合成法在200℃的温度下加热10min,制得平均尺寸为3nm、量子产率为80.3%的CQDs.
1.2.3 模板合成法 模板合成法主要包括两个步骤:(1)将合适的介孔模板或者硅球作为支撑材料,在其中煅烧生长CQDs;(2)通过蚀刻的方式去除支架材料,最终得到纯净的CQDs[24].Zong等[25]以N-十六烷胺作为表面活性剂,以四乙氧基硅烷(TEOS)作为前体,以氨作为催化剂制备了介孔二氧化硅球体,并将其作为模板材料.此后,将介孔二氧化硅球体浸渍于复合盐和柠檬酸的混合溶液中,在300℃下高温热解2h,利用氢氧化钠刻蚀去除介孔二氧化硅支撑体,得到尺寸在1.5~2.5nm、量子产率为23%的亲水性CQDs.2013年,Yang等[26]首次利用软-硬模板合成法分别采用1,3,5-三甲基苯(TMB)、二胺苯(DAB)、芘(PY)和菲啰啉(PHA)4 种不同的前驱体作为碳源,利用共聚物Pluronic P123 作为软模板和有序介孔二氧化硅(OMS)SBA-15 作为硬模板制备可调控尺寸、组成和结晶度的CQDs.该方法有利于制备出尺寸分布均匀的CQDs,但是制备过程较为复杂,且刻蚀模板的过程可能会有残余,为后续CQDs 的提纯带来不便.
2 CQDs 在环境领域的应用
2.1 污染物检测
2.1.1 CQDs 的光学性质 CQDs 一般具有光学吸收特征.不同方法合成的CQDs 吸收波长不同,但通常在200~400nm 的紫外光区有一个或多个吸收峰.该吸收带是由 CQDs 中 C=C 键的 π-π*跃迁(200~260nm 光吸收带)或C=O/C=N 键的n−π*跃迁(280~350nm 光吸收带)所致.此外,表面基团的种类和含量、π 共轭结构域的大小、碳核中氧/氮含量的变化等因素也会影响CQDs 的光学吸收特性.
传统的有机荧光染料存在使用寿命短、光稳定性差等问题,CQDs 作为一种新兴的纳米材料,因其独特的结构和优异的荧光性能,逐渐成为荧光检测领域的研究热点.CQDs 的荧光(即光致发光)特性是指其结构中的电子在一定光源辐射条件下跃迁到激发态,处于激发态的电子不稳定,会再次跃迁到低轨道状态并释放出可见光(图4).CQDs 的荧光机制仍未完全阐明,获得较广泛认可的主要有两类机制[27].一种机制认为CQDs 的光致发光效应是由其结构中相互隔离芳香结构(sp2)的共轭p 轨道电子的带隙跃迁引起的.第二类荧光机制认为CQDs 的荧光特性源于其表面的sp2和sp3杂化碳和其他功能化缺陷位点, sp2杂化结构的缺陷位点诱导其表面产生能量陷阱,通过表面修饰后即可产生荧光发射特性.多样化的表面缺陷赋予CQDs 较宽的荧光发射谱,其中可见光光谱的蓝色和绿色区域最为普遍.因此,CQDs 荧光性能受粒径大小、含氧量的多少、溶剂的种类以及介质pH 值大小等因素的影响.此外,CQDs 的荧光特性具有独特的激发光依赖性(可调谐性),即其发射光的波长和强度会随着激发光波长的改变而发生变化.当激发光波长增加时,CQDs 的发射光波长会发生红移;在最佳的激发波长之前,发射光的强度会随着激发光波长增加而不断增加;但是随着激发光波长增加,发射光的强度会逐渐减弱(图4(a)和(b)).

图4 CQDs 的荧光性能[58-59]Fig.4 The fluorescence performance of CQDs
2.1.2 荧光检测 重金属的持续积累和污染会对自然环境造成严重危害,影响土壤、水体和大气的环境质量.及时监测环境中重金属含量对制定相应的环境保护措施,减少对生态系统及人体健康风险有重要意义.重金属离子对溶液中CQDs 的静电吸附、配位等作用均会影响CQDs 的荧光性能,进而实现污染物检测目的.目前CQDs 对Cu2+、Hg2+、Ag+、Cr3+、Fe3+、Mn2+等重金属离子的检测都有较高的灵敏度.以Hg2+检测为例,Gao 等[28]使用柠檬酸分别与1,2-乙二胺和N-(b-氨乙基)-g-氨丙基反应,合成量子产率为65.5%的CQD-1 与量子产率为55.4%的CQD-2,以探究不同金属离子对CQD-1 和CQD-2的荧光猝灭程度,评价CQD-1 和CQD-2 对Hg2+的选择性.如图5 所示,在水溶液和活细胞中加入20μmol/L 的Hg2+后,CQD-1 的荧光强度迅速猝灭80%,CQD-2 的荧光强度猝灭55%,观察1h 后均保持稳定;在所有测试的金属离子中,Hg2+对CQD-1 和CQD-2 的荧光猝灭作用最大.Tang 等[29]通过酒糟的简单热处理,合成了在光激发下可以发出锐利红光的碳量子点(R-CQDs),在420nm 的固定激发波长下,随着Cr3+浓度从0 增加到80μmol/L,R-CQDs 的荧光发射强度(或峰值振幅)逐渐减小,当Cr3+加入到含有R-CQDs 的乙醇溶液中时,可以观察到R-CQDs 的荧光发射猝灭效果(图6).
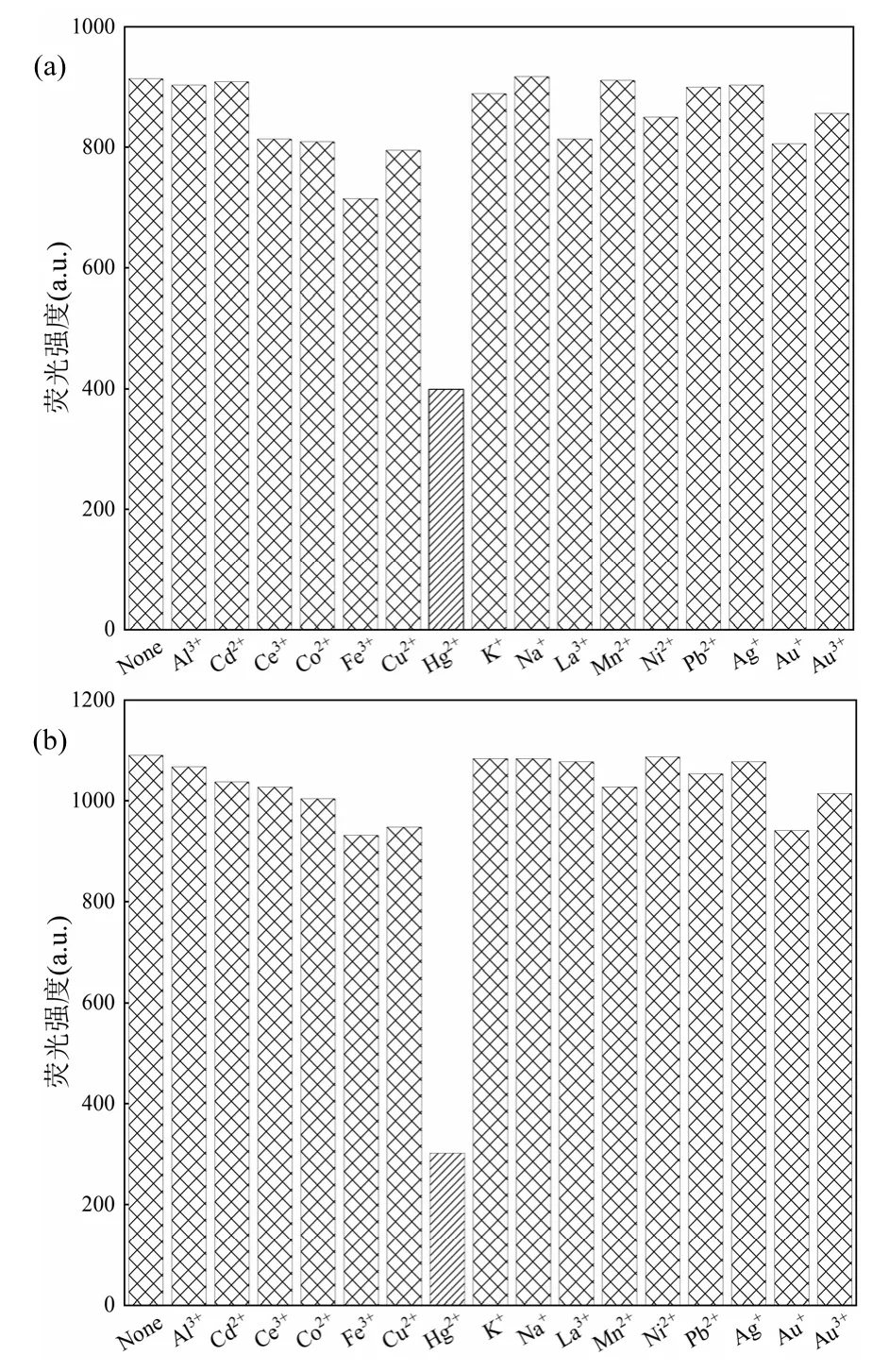
图5 Hg2+对CQD-1 和CQD-2 的荧光猝灭作用[28]Fig.5 The fluorescence quenching effect of Hg2+ on CQD-1and CQD-2
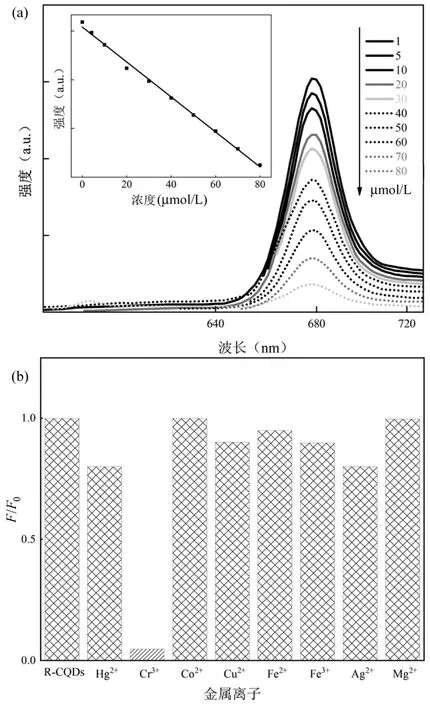
图6 R-CQDs 的相对发光强度及荧光光谱[29]Fig.6 Relative luminescence intensity and fluorescence spectra of R-CQDs
除了被直接应用于荧光检测,CQDs 还可与有机污染物结合,改变CQDs 结构及荧光强度,实现对这些物质的检测.CQDs 检测有机污染物的原理主要包括以下几个方面:(1)静电吸附作用,CQDs 和许多有机污染物表面通常带有一定的电荷,CQDs 可以通过静电吸附作用,将有机污染物吸附在CQDs 表面;(2)π-π 堆积作用,CQDs 具有类似于有机分子的碳骨架结构,可以通过π-π 堆积作用与含有芳香环的有机污染物发生相互作用,这种作用可以增强有机污染物的吸附和检测效果;(3)荧光共振能量转移,当CQDs 与有机污染物接近时,它们之间可能发生荧光共振能量转移,会导致CQDs 的荧光被猝灭或减弱,从而可用来检测有机污染物的存在;(4)反应活性,CQDs 具有较高的反应活性,可以与某些有机污染物发生化学反应.同时,反应可能会改变CQDs 的表面性质、能带结构等,导致荧光强度的变化,从而实现有机污染物的检测.李义梅等[30]以L-酪氨酸为氮供体,以淀粉为碳源,通过一步水热法制备了氮掺杂碳量子点(N-CQDs),当四环素浓度在 1.6~16μmol/L 范围和6~100μmol/L 范围内时,其与NCQDs 的荧光猝灭的强度呈现较好的线性关系,检出限为0.45μmol/L,依此构建了N-CQDs 荧光探针测定四环素的方法.李美玉等[31]以5-氨基-1H-四氮唑和聚乙二醇(400)为前驱体合成了NADESs,再通过一步溶剂热法以无水乙醇为溶剂成功制备出富氮碳量子点5-ATZ/PEG400N-CQDs,在环烷酸浓度0.03~0.09mol/L 范围内,5-ATZ/PEG400N-CQDs 的荧光淬灭率与环烷酸浓度呈线性关系,拟合度R2=0.971.实验还利用三维荧光进一步确定了5-ATZ/PEG400N-CQDs 与环烷酸废水作用后的荧光中心和荧光强度的变化,推测出环烷酸与5-ATZ/PEG400N-CQDs 表面的功能基团发生了化学反应,从而导致5-ATZ/PEG400N-CQDs 的荧光性能发生了改变.
2.1.3 电化学传感器 CQDs 表面有着丰富活泼的官能团,具有良好的导电能力,可以促进电极与液面的电子转移发生以形成电信号,因此常被应用于电化学传感器中.
刘明威等[32]以壳聚糖为交联剂,在玻碳电极(GCE)表面固定羧基化石墨相氮化碳(C-g-C3N4)和CQDs,制得CQDs/C-g-C3N4/GCE,电极活化后,将林可霉素(LIN)的适配体(Apt-DNA)和二茂铁标记的DNA(Fc-DNA)修饰至电极表面,构建形成了新型的电化学发光适体传感界面.传感器对LIN 具有良好的特异性识别能力,应用于牛奶LIN 的检测,线性检测范围为 0.10ng/mL~100.00μg/mL,检出限为0.03ng/mL.Feng 等[33]以木聚糖基碳量子点为绿色原位还原剂,制备了 CQDs 覆盖的金纳米颗粒(Au@CQDs),以导电性好的MXene 为固定基体,形成具有良好导电性和电催化性能的Au@CQDs-MXene 纳米复合材料,将其负载在玻璃碳电极上,成功制备了一种用于亚硝酸盐监测的电化学传感器,在最优条件下,该传感器的线性检测范围为 1~3200μmol/L,检出限为0.078μmol/L,该传感器可用于自来水和咸菜中亚硝酸盐含量的检测.Jahanbakhshi等[34]通过水热合成法,以木薯粉为前驱体合成CQDs,接着将纯水加入CQDs 和硝酸银混合溶液中,利用紫外光照射将银纳米颗粒(AgNPs)嵌入CQDs表面,最后将AgNPs/CQDs 纳米杂化物浇铸在玻璃碳电极上,制成安培法过氧化氢(H2O2)传感器,在最佳条件下,传感器的H2O2检测线性范围为0.2~27.0μmol/L,检出限约为80nmol/L.
2.2 环境污染物的去除
2.2.1 光催化剂 光催化剂能够利用光能激发反应过程中的电子和空穴,从而引发一系列氧化还原反应,有效降解有害物质.制备低成本、无毒、高效的光催化剂对于环境污染物的降解至关重要.因其高比表面积和表面含氧官能团的存在,CQDs 在污染物吸附和光催化反应中具有广泛的应用潜能,能够显著强化污染物的光降解过程[35].
负载CQDs 后,TiO2能增强对污染物的吸附能力,拓宽其在可见光范围内的光响应能力,并促进光生电子与空穴的分离,对甲基蓝、罗丹明B、甲基橙等多种有机污染物均有良好的光催化降解能力,利用少量的能量即可将有机物分解为H2O 和CO2[36].梁慧琴等[37]利用混酸回流法制备了一种发黄蓝光的CQDs,然后采用一步水热法将CQDs 负载于TiO2制备了复合光催化剂,实验结果表明,与纯TiO2相比,用CQDs 改性的TiO2对苯酚的去除率可提高60%.Ke 等[38]利用水热合成法制成了具有明显转换性能的CQDs,接着通过溶胶-凝胶法成功制备了CQDs修饰的TiO2光催化剂.在可见光照射下,120min 内,CQDs-TiO2复合光催化剂降解亚甲基蓝的效率高达90%,是纯TiO2的3.6 倍.2.2.2 复合膜 复合膜是由多种材料组成的层状结构,具有特定的物理、化学和生物特性.复合膜上的表面活性部分可以吸附环境污染物,如重金属离子、有机物质,这种吸附作用可以有效地去除污染物,并防止其再次释放到环境中.
Mabborang 等[39]利用电纺法合成了CQDs-聚丙烯腈/聚己内酯纳米复合膜,用于吸附重金属离子Cu2+,该复合膜随接触时间、吸附容量的增加,在63.45mg/g处达到最大吸附效率90.74%.以啤酒废料,即糟粕和废酵母为碳源,利用水热合成法制备氮掺杂的CQDs,接着将其包埋在聚乙烯醇基质中,测试结果显示,亚甲基蓝可以有效地从水溶液中吸附到复合水凝胶中,随后可以通过紫外辐射完全降解[40].通过微波加热过程制备零维CQDs 纳米颗粒后,将PVA 和CQDs 纳米颗粒结合形成PVA/CQDs 纳米复合薄膜,吸附过程的实验表明,在室温下,PVA/CQDs纳米复合材料能够在40min 内从水溶液中高效去除大浓度的亚甲基蓝染料(30mg/L),去除率约为97.1%,且其使用5 次后吸附效率依旧保持稳定[41].
3 CQDs 的生物毒性
毒性是评估纳米材料在生物体内应用安全性的重要指标之一,许多研究表明,CQDs 在一定浓度下对细胞和生物体可能具有一定的毒性效应,这些效应可能包括细胞凋亡、氧化应激、细胞膜破坏和炎症反应等.虽然碳本身并不具备固有的毒性,但由于CQDs 在各个领域应用广泛,它们将不可避免流入环境中,并对环境造成生态安全威胁,因此需要全面评估其对各种生物系统的潜在危害效应[42].
3.1 CQDs 的毒性效应
目前针对CQDs 的毒性研究已经展开,然而所研究的生物种类仍十分有限,主要聚焦在各类细胞、斑马鱼、部分藻类和小鼠.相较于金属量子点材料,CQDs 几乎是无毒的,对环境的危害也比较小,研究表明,低浓度的CQDs 对人类肝癌细胞[43]、人类乳腺癌细胞[44]、大肠杆菌[45]、酿酒酵母[46]、铜绿微囊藻[47]、斑马鱼胚胎[48]无明显的毒性,但当CQDs 的浓度达到一定量时,就会产生较为明显的抑制作用.
2018 年,Li 等[49]报道了一种基于自噬调控的全新肿瘤治疗方案,方案中用到了叶酸(FA)表面修饰的氮掺杂碳点(FN-CQDs),其量子产率高达91%.方案的治疗原理如图7 所示,FN-CQDs 首先与细胞膜上叶酸受体结合,实现对肿瘤细胞的靶向作用,接着它们以稳定的形式存在于细胞质中的自噬囊泡内,在自噬抑制剂的作用下,FN-CQDs 从自噬囊泡中“释放”出来,并通过凋亡信号通路诱导细胞死亡.研究显示,FN-CQDs 与自噬抑制剂的组合使肿瘤细胞生长迅速受到抑制(在24h内),并在26种不同的肿瘤细胞系中具有高效的杀伤效果(在4d 内的杀伤率为63.63%~76.19%).Chousidis 等[50]制备了非掺杂(以柠檬酸作为碳源)、氮掺杂(N-掺杂)和氮硫共掺杂(N,S-掺杂)的CQDs 以探究CQDs 掺杂替代功能基团对斑马鱼胚胎发育的影响.结果显示,CQDs 对斑马鱼产生明显的毒性作用(>150μg/mL),而且毒性效应与剂量相关.其中,N,S-掺杂CQDs 的毒性最强(LD50=149.92μg/mL),其次是N-掺杂CQDs(LD50=399.95μg/mL),非掺杂CQDs 是三者中毒性最低的(LD50=548.48μg/mL).生长速率(GR)同样受到毒性模式的影响(GRN,S-掺杂 图7 利用CQDs 治疗肿瘤的方案原理[49]Fig.7 The principle of using CQDs for tumor treatment Xiao 等[51]探究了CQDs(N、S 掺杂的CQDs, N掺杂的CQDs,无掺杂的CQDs)和金属量子点(CdTe QDs、CdS QDs、CuInS2/ZnS QDs)对模式生物蛋白核小球藻的细胞毒性作用.结果发现,暴露96h 后,3种CQDs 的EC50分别为38.56,185.83,232.47mg/L,6种量子点的毒性顺序依次为: CuInS2/ZnS QDs<无掺杂的 CQDs 3.2 影响CQDs 生物毒性的因素 与其他纳米材料相似,CQDs 的生物毒性受到多种因素的综合影响,除了生物体类型、外部环境因素外,CQDs 的物理化学性质,包括粒径与形态、暴露浓度与时间、表面修饰基团与溶解度等因素皆可对其生物毒性大小和机制产生显著影响. 3.2.1 暴露浓度 当前的许多研究表明,CQDs 的生物毒性与其浓度密切相关.这种浓度依赖特性在使用不同碳源(如碳纳米管、蜡烛灰等)制备的CQDs以及经过表面改性或掺杂处理的CQDs 的毒性研究中得到了验证.这些研究几乎覆盖了涉及的各类生物,包括细菌、细胞、藻类和鱼类等[53].吴琳等[54]研究发现,低浓度CQDs 对三角褐指藻并无明显抑制作用,反而促进了生长,而在高浓度下则具有明显的生长抑制作用,其120h 的EC50值为108.89mg/L.CQDs 对纽扣珊瑚同样具有明显的行为抑制作用,在解除暴露后虽有恢复,但高浓度(≥50mg/L)暴露组,仍有部分纽扣珊瑚无法恢复,最终死亡.陈静等[55]利用微波法成功制备CQDs,研究表明,低浓度(<500mg/L)CQDs 对玉米未显示出明显的毒性,但当浓度达到2000mg/L 时,会抑制玉米种子萌发过程中根的伸长;当浓度高于1000mg/L 时,玉米根和叶的鲜重相较于对照组分别减少了57%和38%.将62.5~1000mg/L的CQDs 处理拟南芥后发现, CQDs 浓度一旦超过125mg/L,就将开始显著抑制拟南芥幼苗的生长,当CQDs 的浓度达到1000mg/L 时,拟南芥根和叶的鲜重相较于对照组分别减少了64%和32%. 3.2.2 表面修饰基团与表面电荷 在实际的应用中,表面改性和杂原子掺杂是对CQDs 进行处理的常见方法,用于改变其物理化学性质,增强其性能,经过处理的CQDs 具有更好的分散性和稳定性,具有更高的化学反应活性和生物相容性.Chousidis 等[50]和Xiao 等[51]分别对制备的3 种CQDs(N、S 掺杂的CQDs,N 掺杂的CQDs,无掺杂的CQDs)进行了毒性研究,得出了同样的毒性顺序:无掺杂的CQDs 已有的研究表明,纳米材料中的阳离子颗粒具有中度毒性,而阴离子颗粒几乎无毒,且其毒性强度与材料表面携带的正电荷数量呈正相关[56].Havrdova 等[57]对标准小鼠成纤维细胞(NIH/3T3)进行了CQDs 的体外细胞毒性研究,其中包括3 种不同表面功能化CQDs 的细胞周期分析:携带羧基团而呈负电荷的CQDs(CQDs-Pri)、携带聚乙二醇而显示中性电荷的CQDs(CQDs-PEG),以及携带聚乙烯亚胺而显示正电荷的CQDs(CDs-PEI).实验结果表明,中性的CQDs-PEG 在生物应用中最有前景,因为浓度达到300mg/mL 时,它不会引发任何细胞形态异常、细胞内运输问题和细胞周期问题.带负电荷的CDs-Pri 能够阻断细胞周期的G2/M 阶段,刺激细胞增殖并导致更高的氧化应激,即使在较低浓度(50mg/L)下,这种影响也十分显著.但其并不会进入细胞核内.相比之下,带正电荷的CDs-PEI 具有最强的细胞毒性,并在约100mg/mL 的浓度下引发细胞周期的最大变化,影响G0/G1 阶段,且能够进入细胞核内. CQDs 具有良好的光学特性、生物相容性和化学反应活性,因此逐渐被广泛地应用于各领域.未来仍需加强以下方面的研究:(1)目前,CQDs 的前体材料来源丰富,合成方法灵活简易,然而如何提高CQDs 的产率、优化制备方法、实现粒径和结构的精确控制,仍是当前需要关注的问题.(2)CQDs 在环境污染物检测与去除方面有广阔的应用前景.但CQDs 在环境领域的应用主要基于其荧光特性,并且在大部分的研究中,其仅能检测或去除单一物质,未来应结合CQDs 的优良性能,实现CQDs 针对多种环境污染物的协同检测及降解.(3)现有的研究显示,CQDs 的生物毒性是不可否认的,且毒性大小受到多种因素的综合影响,然而,针对CQDs 生物毒性的研究仍十分有限,研究的生物对象种类也较少.在今后的实际应用中,科学家们除了对CQDs 进行表面修饰或掺杂以调节其结构外,还应明确CQDs 的结构与生物毒性效应的关系.
4 结论与展望
