不同补料方式对好氧颗粒污泥合成PHA 的影响
2024-03-28娄雨晴张艳萍孙迎雪北京工商大学生态环境学院北京100048
陈 淞,苑 泉,娄雨晴,张艳萍,孙迎雪(北京工商大学生态环境学院,北京 100048)
聚羟基脂肪酸酯(PHA)是一类可由多种微生物合成、作为碳源和能量储备的天然的可生物降解聚酯[1].PHA 不仅具有可生物降解和可以堆肥的特性,还易于转化为不同的形式,与塑料材料具有非常相似的特性[2],可以广泛应用于工业、农业、建筑、制药及生物医学等领域[3].目前,利用单一微生物发酵是现阶段获得PHA 的主要方式,但是昂贵的发酵底物以及发酵过程中需要维持的无菌环境使其生产成本至少是传统塑料的3 倍以上[4].此外,高值化废弃物管理的一种策略是将废弃物作为有用资源进行再利用,其中就包括利用活性污泥合成PHA[5].近年来,国内外学者对活性污泥合成PHA 的影响因素进行了大量研究,主要集中在碳源类型、底物浓度、营养元素的比例、pH 值、DO 等[6–12]方面.在普通的絮体污泥系统中,菌胶团在碳源充足的条件下可以将多余的碳源以PHA 的形式储存在体内,在底物缺乏的情况下其又会消耗PHA 提供生命代谢的能量.然而这种絮体污泥密度低、沉降速度慢、污泥体积指数(SVI)高[13].好氧颗粒污泥(AGS)具有沉降速度快、生物量高、有机负荷高,同时能够脱氮除磷[14]等特点.杨国靖等[15]培养出的AGS 具有良好的同步脱氮除磷效果,对氨氮的去除率接近100%,总磷的去除率在80%以上.Laanbroek 等[16]的研究表明,在AGS的粒径大于150µm 时,其内部会产生厌氧区从而有利于脱氮除磷菌的生长,使其具有良好的脱氮除磷能力.王杰等[17]的研究认为菌胶团在外碳源充足的情况下会将多余的碳源合成PHA,AGS 含有大量菌胶团来维持其结构的稳定性,因此AGS具有良好的PHA合成能力.Rojas-Zamora 等[18]的研究以固体垃圾渗滤液为原料利用AGS合成PHA,AGS比活性污泥的产量高出了5.3%,AGS 的PHA 合成量高于活性污泥.
研究者利用活性污泥合成PHA 时发现,PHA的含量在好氧阶段均会呈现下降的趋势,为了使活性污泥能够在好氧阶段继续合成PHA 或减少PHA的消耗,需要在好氧阶段补加碳源.目前鲜有关于补料方式对AGS 合成PHA 影响的研究,且鲜有研究关注AGS 在合成PHA 过程对AGS 结构变化和脱氮除磷性能的影响.本文以AGS 为研究对象,考察了不同补料方式对其合成PHA 的影响,考察AGS的结构变化以及碳氮磷去除效能.
1 材料与方法
1.1 试验及试验装置
采用有效容积为7L 的序批式活性污泥反应器(SBR)培养AGS(图1).反应器每周期进水3L,即排水比为43%.采用厌氧-好氧的模式运行,每周期共持续6h,包括厌氧进水15min,厌氧搅拌90min,好氧曝气220~245min,沉淀30~5min(沉淀时间随着颗粒污泥的形成逐渐缩短至5min,改变沉淀时间的同时调整相应的好氧曝气时间,使每个反应周期为6h),排水5min.厌氧阶段采用机械搅拌器使系统混合均匀,好氧阶段采用曝气盘曝气,曝气量恒定在1L/min.反应在室温下进行,约26℃ ,试验期间未控制进水及反应器内pH 值.污泥接种于北京市某污水厂剩余污泥,在反应器中经20d 驯化后形成AGS.探究未补料(空白)、好氧0h 补料、好氧0.5h 后补料、好氧1h 后补料等进料方式对AGS 反应器的影响,试验参数如表1 所示.
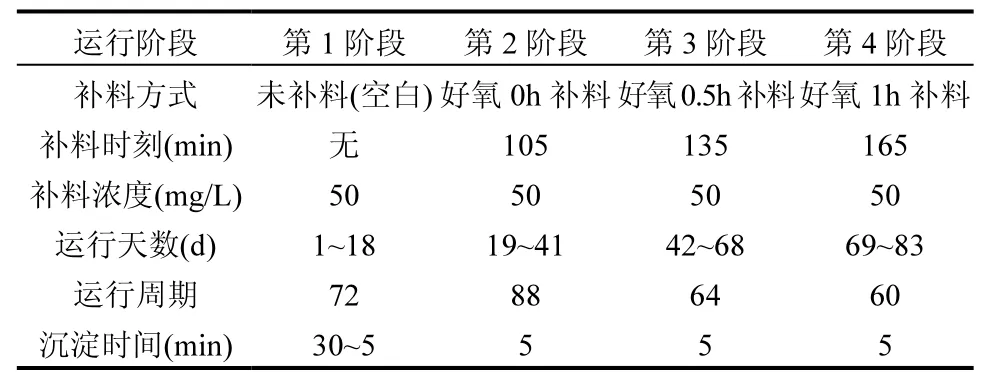
表1 AGS 反应器运行参数Table 1 The operational parameters of the AGS reactor

图1 SBR 试验装置与控制示意Fig.1 Schematic diagram of AGS systems
1.2 进水水质
实验采用人工配水,以乙酸钠为碳源、NH4Cl为氮源、KH2PO4为磷源,控制COD 为400mg/L,氨氮浓度为50mg/L,TP 浓度为10mg/L,另外添加营养液为4mL/L,营养液的成分如下:FeCl3·6H2O 1.5g/L、CuSO4·5H2O 30mg/L 、 CoCl2·6H2O 150mg/L 、ZnSO4·H2O 120mg/L、KI 180mg/L、H3BO3150mg/L、Na2MoO4·2H2O 60mg/L、MnCl2·6H2O 120mg/L、EDTA-2Na 10g/L.
1.3 检测指标及测定方法
测定指标主要有:NH4+-N、NO3--N、NO2--N、溶解性正磷酸盐(SOP)、MLSS、MLVSS,检测方法采用国家标准方法,COD 的测定采用快速消解法.
PHA 测定:从反应器中取10mL 新鲜的颗粒污泥样品置于离心管中以8000r/min 高速离心,去除上清液后将剩余固体置于-80℃中冷冻24h 后,置于冷冻干燥机中冷冻干燥24h.用电子天平(精确度万分之一)称量冷干后样品.取10mg 左右干燥的颗粒污泥于消解管中,加入2mL 氯仿,2mL 酸化甲醇溶液,105℃烘箱消解6h 进行水解酯化反应,然后取出消解管,冷却后加入1mL 去离子水并剧烈振荡,静置待溶液分层后取下层有机相5μL 检测.污泥中PHA含量根据下式计算:
式中:mHB为测试的样品中所得HB 的质量,mg;mHV为测试的样品中所得HB 的质量,mg;m 为测试样品的干重,g.
PHA 转化率[19]:
式中:PHAe为反应过程中 PHA 的最高含量,mg/L;PHA0为反应开始时PHA的含量,mg/L;Se为反应开始时的COD,mg/L;S0为反应过程中PHA 含量达到最高时的COD,mg/L.
PHA 测定采用气相色谱法(采用Agilent HP-5型毛细色谱柱30m×0.25mm×0.25μm).色谱条件:进样口200 ℃,载气为N2,压力71.2kPa,流量41.4mL/min,分流比为25:1,柱箱:初始温度70 ℃,保持1min,后以10℃ /min的速度上升到140 ℃,保持2min.检测器:FID检测器,温度250 ℃,H2流量40mL/min,空气流量45mL/min.
微生物群落结构的分析:在各阶段的稳定运行期内,保留污泥样品-80°C 储存.试验结束后统一进行基因组DNA 的提取,用341F(5′-CCTACGGGNGGCWGCAG-3′)和785R(5′-GACTACHVGGGTATCTAATCC-3′)作为扩增引物,对细菌16S rRNA 基因进行2 轮PCR 扩增.使用Illumina Novaseq 6000测序平台进行高通量并行测序,将相似水平在97%的序列归为1 个OTU 进行生物信息统计分析.
2 结果与讨论
2.1 反应器运行效果
2.1.1 颗粒污泥的形态变化 种泥为典型的絮体污泥,在经过20d 的培养,逐渐形成肉眼可以观察到的颗粒污泥,AGS 初步形成.碎小的沉降性能差的絮体污泥逐渐被淘汰,大而密实的颗粒污泥逐渐形成,经过56d 的培养后,95%以上的颗粒污泥粒径达到425μm 以上.由图2 可知,反应器内接种污泥浓度为4170mg/L,在培养过程中,沉淀时间由30min 缩短至5min,部分沉降性能差的絮体污泥随着出水被洗出反应器外,使污泥浓度在培养初期不断下降至1134mg/L,随着培养时间的延长,污泥浓度逐渐恢复至2500~3500mg/L.在接种污泥中有58.66%的污泥粒径小于180μm,在培养过程中污泥粒径逐渐增大,经过一段时间后,形成的AGS 有95%以上的粒径达425μm 以上,且沉降性能良好.颗粒污泥的粒径并不是越大越好,粒径过大会影响污泥内部的传质作用,从而影响颗粒污泥的稳定性[15].因此,本研究中获得的颗粒污泥粒径适中,有利于反应器的稳定运行.

图2 培养过程中反应器内颗粒污泥粒径及污泥浓度变化Fig.2 The change of granular sludge particle size and sludge concentration during cultivation
2.1.2 不同补料方式下COD 的去除情况 在整个反应器的运行过程中,如图3 所示,进水COD 在300.58~450.07mg/L 之间波动,空白阶段COD 平均去除率为(93.22±5.53)%,在好氧阶段补加碳源以后,COD 的平均去除率分别为(89.26±5.03)%、(88.16±3.68)%和(88.93±5.39)%,在好氧阶段补加碳源以后COD 去除率有所降低,但补料时间的变化并未对COD 的去除率产生显著影响.
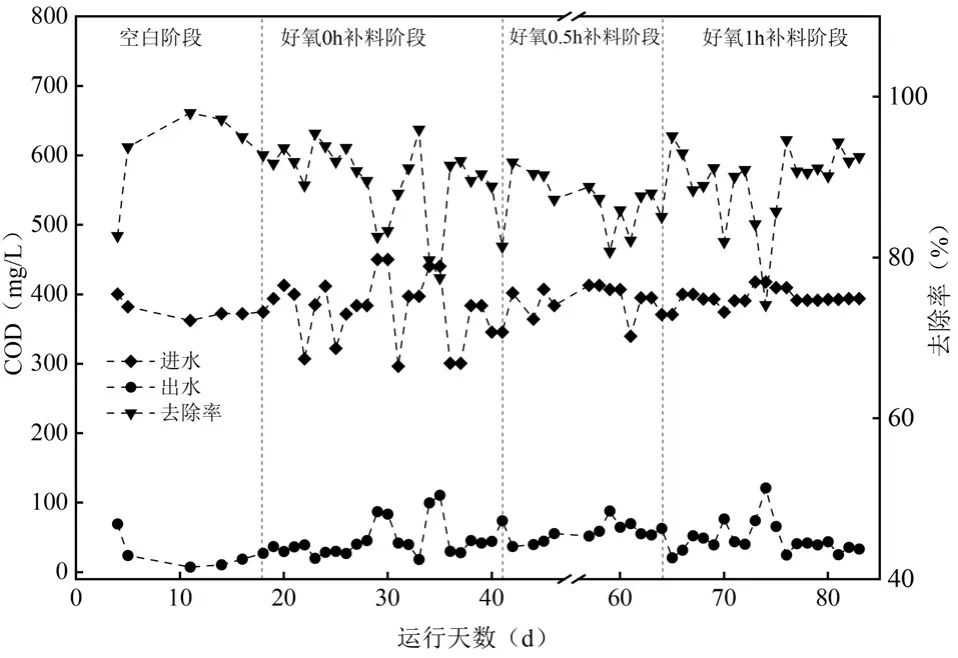
图3 不同补料方式条件进出水COD 变化Fig.3 COD variation in influent and effluent water under various dosing times
2.1.3 不同补料方式下反应器除磷效果 如图4所示,在溶解性正磷酸盐(SOP)浓度约11.39mg/L 时,空白阶段(未补料)出水SOP 浓度约(0.69±0.21) mg/L,去除率为(94.08±1.42)%.好氧0h 补料条件下,出水SOP 浓度降低至(0.26±0.18) mg/L.但当补料时间由好氧0h 推后至0.5h 和1h,出水SOP 浓度逐渐升高,平均浓度分别为(2.21±1.04) mg/L 和(4.24±1.68)mg/L,系统除磷效果逐渐下降.可见,补料时间的变化会影响AGS 除磷过程.
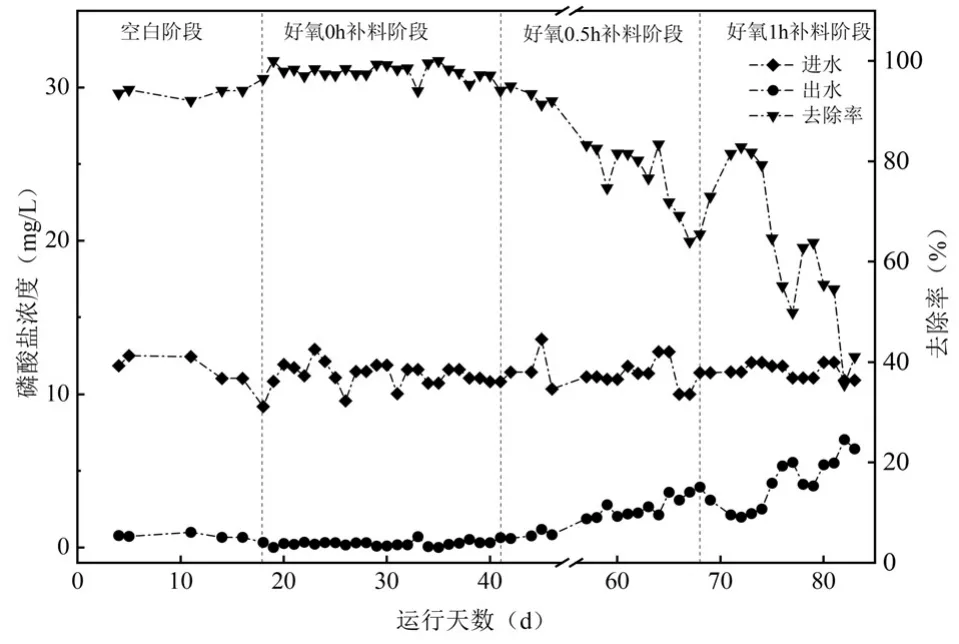
图4 不同补料方式条件进出水SOP 变化Fig.4 SOP variation in influent and effluent water under various dosing times
2.1.4 不同补料方式下脱氮效果 如图5 所示,在进水TN 约53.21mg/L 时,空白阶段(未补料)的出水NH4+-N浓度为(0.38±0.56) mg/L,去除率为(99.29±1.09)%,出水主要以NO3--N 和NO2--N 的形式存在,出水TN 浓度为(8.07±0.78)mg/L,去除率为(83.96±2.44)%.好氧0h 补料阶段,NH4+-N 去除效果变化不大,由于系统补充了碳源,促进了反硝化过程,出水NO3--N 浓度下降,NO2--N 的出水浓度有所升高.整体而言,出水TN 浓度有所降低,去除率提高.在好氧0.5h 补料阶段,出水NH4+-N 和NO2--N 浓度升高,出水NO3--N 浓度进一步下降,出水TN 浓度为(6.52±3.59) mg/L,TN 去除率为(87.86±6.88)%,此时TN的去除率达到最高.

图5 不同补料方式条件进出水氮素浓度变化Fig.5 Nitrogen concentration changes in the influent and effluent under various dosing times
可见,好氧0.5h 补料时,在曝气量不变的情况下,异养菌与AOB 和NOB 竞争氧,影响了系统的硝化过程,导致NH4+-N 和NO2--N 浓度升高,而碳源的存在强化了反硝化过程,使系统内发生了同步硝化反硝化过程(SND),降低了出水TN 浓度;且张杰等[20]和易名儒等[21]的研究表明,在污泥颗粒化的过程中,AGS 中溶解氧的扩散阻力明显增大,颗粒污泥内部形成好氧、缺氧、厌氧的分区结构,能够增强SND作用,提高反应器内的脱氮性能.当补料时间进一步推后至好氧1h 时,出水NH4+-N 浓度急剧上升至(15.55±9.13) mg/L,出水NO3--N 和NO2--N 浓度分别为(0.96±1.14) mg/L 和(1.38±0.63) mg/L,出水TN 浓度为(17.89±8.96) mg/L,TN 去除率仅为(67.60±16.24)%,此时TN 去除率达到最低.可见,好氧1h补料时,补加的碳源进一步影响了系统的硝化过程,从而降低了系统的脱氮效率.整体而言,过晚补料会影响AGS 的硝化过程,进而影响系统的脱氮性能.
2.2 沿程C、N、P 浓度变化
每个运行工况下,反应器运行稳定后,取任一周期测定沿程C、N、P 变化(图6).空白条件(未补料)下,厌氧阶段结束时,反应器内 NH4+-N 浓度为22.30mg/L,降低了4.19mg/L,这可能是因为AGS 具有一定的吸附能力,吸附了进水的中的部分NH4+-N[22];在上一周期积累的NO3--N(约7.56mg/L)因进水中充足的碳源而被反硝化去除;厌氧阶段,COD 迅速降低,在75min 时达到平衡(4.05mg/L);相应的,SOP 浓度逐渐升高,释磷速率为17.00mg/(L⋅h),厌氧阶段结束时SOP 浓度达到了40.77mg/L,系统表现出很好的厌氧释磷能力.在好氧阶段,NH4+-N 浓度迅速降低,转化速率为11.97mg/(L⋅h),好氧2h 以后NH4+-N 浓度趋于稳定(约0.15mg/L);NO2--N 浓度则随着NH4+-N 浓度的降低而逐渐升高,好氧2.5h 时达到最高,为5.45mg/L,而后逐渐降低至0.06mg/L,NO3--N 浓度在好氧1h 后逐渐升高,出水浓度为6.75mg/L,TN 浓度持续下降,可见AGS 在好氧阶段利用同步硝化反硝化以及同步短程硝化反硝化过程实现高效脱氮;SOP 浓度迅速降低,吸磷速率为19.99mg/(L⋅h),在好氧1.5h 以后SOP 浓度下降到了1mg/L 以下,出水SOP 浓度为0.64mg/L.
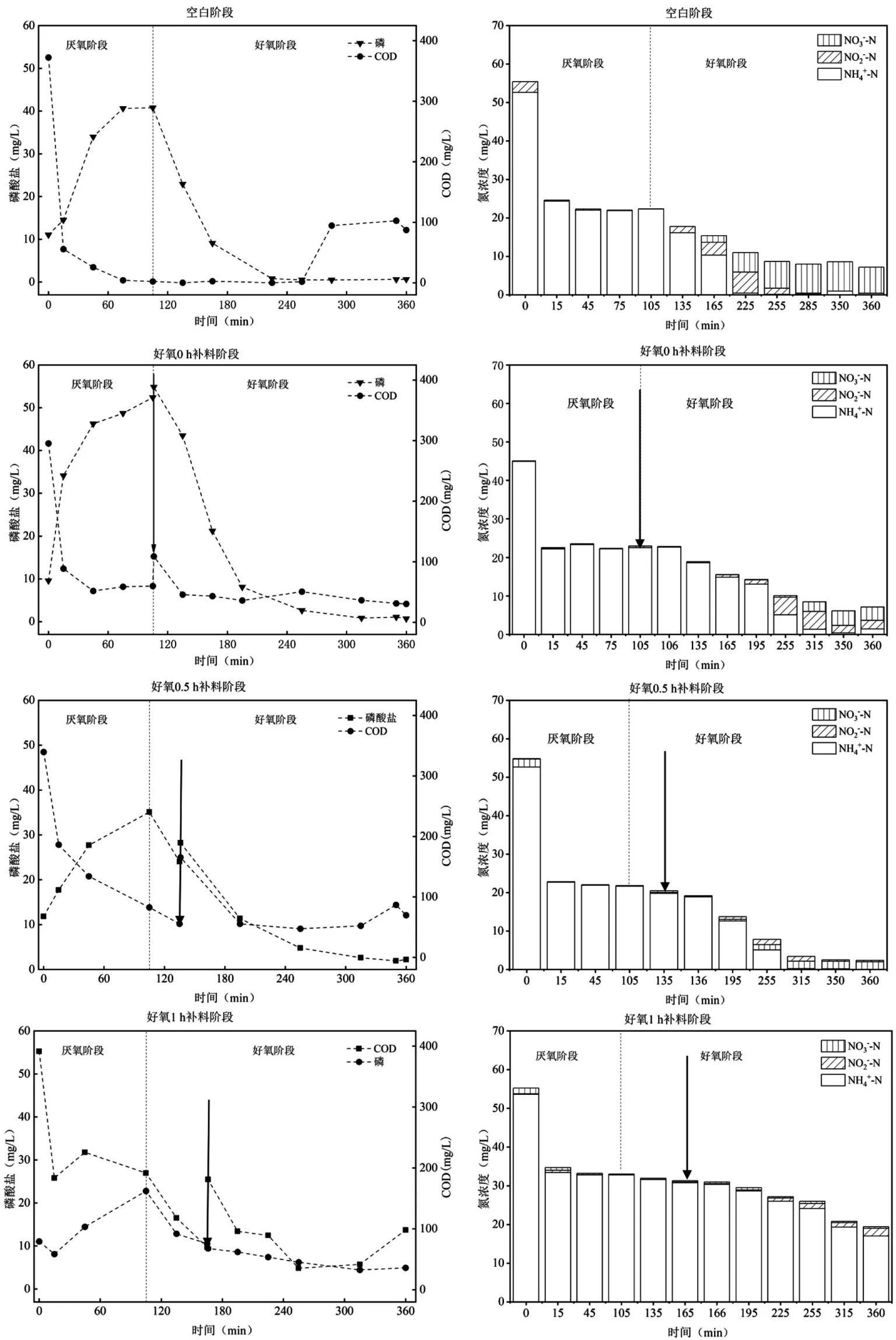
图6 不同补料方式条件下沿程C、N、P 浓度变化Fig.6 In-cycle C, N, and P concentrations changes at various dosing time
好氧0h 补料阶段,SOP 在厌氧阶段的释磷速率较空白条件提高了15.12%,厌氧阶段结束时系统SOP 浓度为46.14mg/L.在好氧阶段,补加的碳源影响了系统的硝化过程和好氧吸磷过程,NH4+-N 的转化速率降低至7.45mg/(L⋅h),较空白条件降低了38%,好氧吸磷速率为17.85mg/(L⋅h),较空白条件降低了10.71%.当补料时间推后至0.5h 和1h,COD 在厌氧阶段的去除量降低,好氧阶段NH4+-N 转化速率进一步降低至6.01,2.75mg/(L⋅h),出水浓度升高;厌氧释磷和好氧吸磷速率也随着补料时间的推后而急剧下降.一方面,这可能是因为补料时间影响了AGS 脱氮除磷菌群对氧的有效利用和分配;另一方面,补料时间可能影响了AGS 微生物群落结构变化,导致出水组成变化较大.
2.3 不同补料时间条件下PHA 的合成情况
在空白阶段,厌氧阶段结束时,PHA 的含量最高,为48.56mg/g,好氧阶段一部分PHA 用于聚磷菌(PAOs)好氧吸磷,因此好氧阶段结束时PHA 的含量为36.00mg/g.补料后1 个周期内PHA 含量的变化如图7 所示.好氧0h 补料时,PHA 合成量有所提升,最高为50.38mg/g,比空白阶段含量提升了3.7%,PHA转化率为30.97%,好氧阶段结束时PHA 的含量为32.56mg/g.好氧0.5h 补料阶段,补料以后PHA 含量迅速增加,最高达116.48mg/g,比空白阶段提升了2.40 倍,随后PHA 含量逐渐降低,好氧阶段结束时的PHA 含量为59.35mg/g,比好氧0h 阶段有所提高.好氧1h 补料阶段,在补料以后PHA 在补料完的15min内持续升高,最高含量为125.06mg/g,比空白阶段增加了2.58 倍,PHA 转化率为76.2%,好氧阶段结束时PHA 含量为36.85mg/g.可以看出,好氧阶段补料后,PHA 的产量增加,且随着补料时间的延长,增量越大.研究表明[23-24],在好氧阶段补充碳源能够明显提升PHA 的产量,这与本文研究结果一致.Gobi 等[25]研究了AGS 粒径大小对PHA 产量的影响,PHA 的最大积累量随粒径的增大而减小.这是由于粒径小的颗粒污泥具有大的比表面积,增大了有机物与颗粒污泥之间的有效接触从而增加了PHA 的产量.而在本研究中随着反应器的运行,污泥粒径逐渐增大,而PHA 的产量却随着补料时间的推迟而逐渐增加,进一步说明了在好氧阶段补加碳源能够提高PHA的产量.
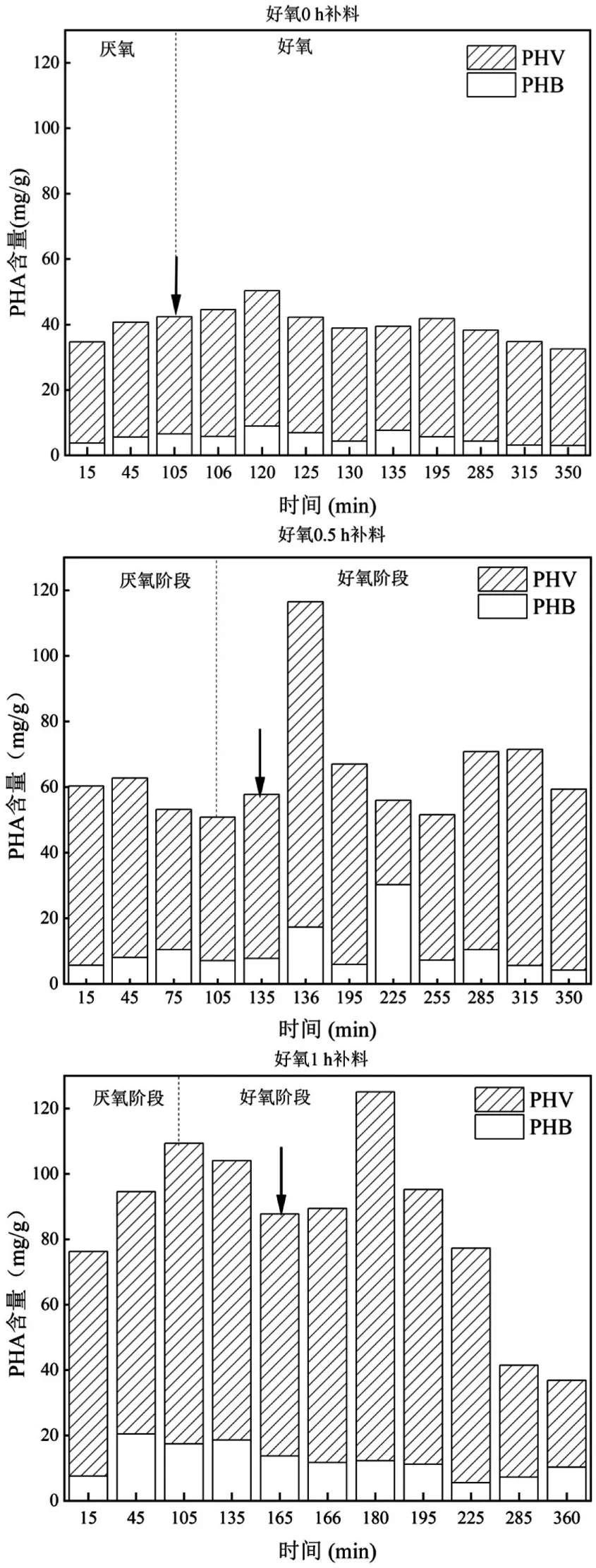
图7 不同补料方式条件下的PHA 合成情况Fig.7 PHA synthesis at various dosing times
陈玮等[26]利用活性污泥合成 PHA,在 COD 1000mg/L,C/N/P=100:10:2 的条件下,在厌氧阶段结束时获得最高PHA 产量为12%,而本研究的进水COD 为 400mg/L,C/N/P=100:8:40,PHA 产量为17.75%,与文献的PHA 产量相当.在谢一涵[26]的研究中,在COD 为800mg/L,C/N/P=100:5:1 的条件下,在限氧1h 后补加使反应器COD 浓度为200mg/L 的溶液,所得PHA 含量最高为26.52%.相比之下,本研究AGS 的PHA 产量较低,这可能是因为本研究进水的C:N:P 比例较低.研究表明[23-24],在氮、磷营养元素限制的条件下有利于PHA 的合成.因此在未来研究中,应提高进水碳源浓度,限制氮磷浓度,以提高AGS 合成PHA 产量.
Zheng等[27]研究在COD为3000mg/L的条件下,利用活性污泥合成PHA 获得的含量为19.8%,最大PHA 转化率仅为38.7%;Liao 等[28]利用废活性污泥并以其水解液(COD 为(977.5±48.9) mg/L)作为碳源合成PHA 时所得的最大PHA 转化率为46%.Gobi等[29]利用AGS 以棕榈油厂废水作为碳源,有机负荷率为2.25kg COD/(m3⋅d)的条件下合成PHA 的最大转化率为66%.且在黄龙[30]的研究中,利用废弃碳源作为底物采用连续流补料工艺获得的最大转化率为61%.本研究采用AGS 合成PHA 转化率高达76.2%,说明利用AGS 可使更多的碳源转化成PHA.而本研究中采用补料的方式获得了更高的PHA 转化率,说明补料条件提升了AGS 的PHA 转化率.
由图6 可以看出,AGS 产生的PHA 中,PHV 的含量较高.在空白阶段,PHV的占比均在90%以上(厌氧末端91.71%,好氧末端91.34%);在不同补料方式条件下,PHV 的比例略有降低,占比均在80%以上.PHA 的单体组分较多,常见的有3HB、3HV、3H2MV、3H2MB 等,不同组分PHA 的物理和化学性质差异很大,聚合物的疏水性、熔点、玻璃转变温度和结晶度完全取决于单体的组成[31].以3HB 为单体的PHB 物理特性较脆,不利于进行一般的加工;以3HV 为单体的PHV 物理延展性较好,两者结合P(3HB-co-3HV)则具有更好的物理加工特性[31].与本研究不同,其他以乙酸作为碳源合成PHA 研究中,PHA 多以PHB 为主.例如,在黄惠珺等[32]以乙酸钠为碳源,利用活性污泥合成PHA,发现PHB 的含量占比较高,为81%;秦清等[33]在研究不同短链脂肪酸对活性污泥合成PHA 的影响时发现,以乙酸作为单一碳源时,PHB 的含量占比高达97.85%.本研究中出现以乙酸钠作为碳源,但所得PHA 组分以PHV 为主,推测可能有以下2 种原因.一方面可能是由于微生物组成不同,菌种差别影响了单体的结构[34].Yan等[35]用相同浓度的葡萄糖作为碳源培养了来自不同污水处理厂的污泥,利用淀粉污水处理厂的污泥所得的PHV 占比13%,利用乳品废水处理厂的污泥所得PHV 占比8%,造纸废水污水处理厂的污泥所得PHA 组分均为PHB.可见,菌群的种类和群落结构的变化导致不同来源的污泥合成的PHV 比例不同.而本研究中AGS 的结构组成复杂,微生物的种类繁多,复杂丰富的微生物体系可能会影响PHA 的组分,导致与其他活性污泥合成PHA 的组分差异较大.另一方面,AGS 独特的颗粒形态可能因传质效果差异,从而影响了微生物的代谢特征.不同颗粒形态的污泥,存在的传质阻力不同从而影响了有机物与颗粒污泥之间的扩散作用,从而影响PHA 的合成[25].
2.4 微生物群落分析
2.4.1 Alpha 多样性指数分析 如表2 所示,各个样品的覆盖率均大于99%,说明样品中的微生物几乎能够完全被覆盖,测序的结果能够反应样品的微生物的真实状况.在形成颗粒污泥以后,Ace 指数均有所下降,说明在形成颗粒污泥的过程中微生物群落的丰富度有所下降.且微生物丰富度还受不同补料时间的影响,补料时间越迟,微生物群落的丰富度越低.说明多样性越高.Shannon 指数呈现先减少后增加后继续减少的趋势.说明在颗粒污泥形成的过程中,物种多样性是减少的.好氧0h 补料条件下,物种多样性有所增加,但在好氧0.5h 和1h 补料条件下,物种多样性又持续降低,说明不同的补料时间条件会影响污泥中微生物的丰富度和多样性.在形成AGS 以后,微生物群落的丰富度和多样性减少的原因可能是在沉降时间变短后,生物量降低导致的;也可能是在污泥系统中,在反应器运行的过程中限制和淘汰了不能合成PHA 的微生物导致的.
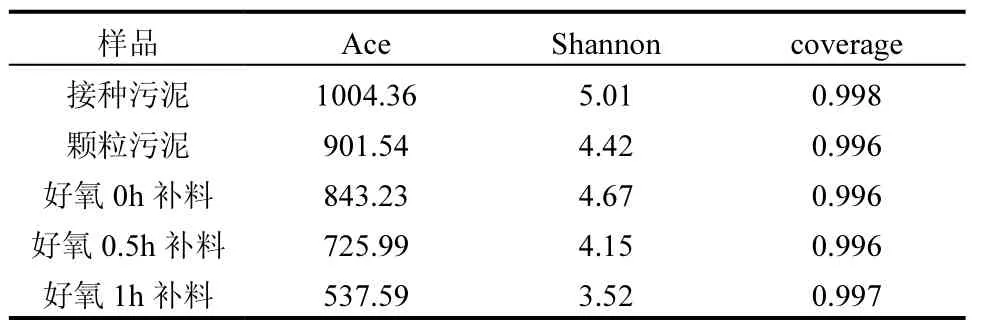
表2 污泥样品中细菌群落的α多样性指数Table 2 α diversity indexes of bacterial community in sludge samples
2.4.2 微生物群落结构分析 由图8 可以看出,细菌的相对丰度随补料时间的改变而有明显差异.所有样本中的最主要优势菌门都是变形菌门(Proteobacteria),其在接种污泥(Inoculation)、空白阶段(AGS0)、好氧0h 补料(AGS1)、好氧0.5h 补料(AGS2)和好氧1h 补料(AGS3)占比分别为45.34%、70.02%、71.24%、79.78%、72.09%,随着AGS 的形成,变形菌门(Proteobacteria)的相对丰度显著提高.其次为拟杆菌门(Bacteroidetes),占比分别为34.12%、22.94%、17.8%、15.61%、25.63%.在接种污泥混合菌种的优势细菌还有绿弯菌门(Chloroflexi)和硝化螺旋菌门(Nitrospirae),其相对丰度分别为4.07%和5.55%,形成AGS以后丰度有所下降.变形菌门是很多污水处理厂的活性污泥中普遍存在的优势菌群,拟杆菌门和变形菌门是合成PHA的主要细菌门[36],说明在AGS 补料条件下有利于PHA 合成菌的积累.

图8 不同补料条件下的微生物群落结构变化Fig.8 The microbial communities at the phylum and genus levels in all reactors
由图 8(b)可见,在接种污泥中陶厄氏菌属(Thauera)、黄杆菌属(Flavobacterium)和硝化螺旋菌(Nitrospira)的相对丰度占比较大,分别为11.32%、5.15%和5.55%.在形成AGS 以后,Thauera、噬氢菌属(Hydrogenophaga)、动胶菌属(Zoogloea)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)和短波单胞菌属(Brevundimonas)等的相对丰度增加.其中Zoogloea 在AGS 形成的初期相对丰度较高,为3.63%,这种菌属能够分泌EPS,从而有利于污泥团聚,形成结构紧密的颗粒污泥[37],在颗粒污泥形成稳定以后,其相对丰度逐渐降低.Hydrogenophaga、Flavobacterium、Brevundimonas 和Thauera 等均被鉴定有显著的合成PHA 的能力[38],但在不同补料时间条件下优势种不同.
Thauera 是典型的反硝化聚磷菌之一[39],也是典型的好氧PHA 合成菌[40],在形成AGS 以后,其相对丰度大幅升高,在空白阶段其相对丰度为20.73%,在补料条件下相对丰度逐渐降低,在AGS1、AGS2 和AGS3 中的相对丰度分别为1.17%、0.95%和0.14%,表明补料条件限制了此类菌群的生长.Acinetobacter在生物除磷系统中具有明显优势,有合成PHA 的能力,徐少娟等[41]研究发现在Acinetobacter 占优势的生物除磷系统中,2mg/L 的氨氮浓度对好氧阶段系统消耗PHA 有抑制作用,从而提高PHA 的产量,其在AGS0、AGS1、AGS2 和AGS3 中的相对丰度分别为2.77%、11.17%、0.03%和0.18%.当补料时间推后至0.5h 和1h 后Thauera 和Acinetobacter 的相对丰度急剧下降,这可能是导致系统脱氮除磷性能变差的原因之一,说明Thauera 和Acinetobacter 在AGS 承担了主要的脱氮除磷任务.
Hydrogenophaga是革兰氏阴性的氢氧化细菌,具有良好的PHA 合成能力,其在AGS0、AGS1、AGS2和AGS3 中的相对丰度分别为5.53%、0.54%、2.71%、32.81%.随着补料时间的延迟, Hydrogenophaga 不断聚集,成为AGS3 的优势菌种,是合成PHA 的主要菌种之一.Flavobacterium 在AGS0、AGS1、AGS2 和AGS3 阶段的相对丰度占比分别为3.58%、5.47%、9.54%和20.24%,其在AGS3 阶段占比最高.在AGS3中,Hydrogenophaga 和Flavobacterium 这两种具有PHA合成能力的菌属丰度占比超过50%,说明在好氧1h 补料有利于PHA 合成菌的富集,使得AGS 混合菌群合成PHA 的能力提高.
3 结论
3.1 补料方式会影响PHA 的产量和系统脱氮除磷性能.随着补料时间的后移,PHA 的含量逐渐升高,但过晚补料会影响AGS 的脱氮除磷性能.在好氧0.5h补料条件下,PHA 含量显著升高且系统稳定,在好氧1h补料条件下,虽PHA含量最高,系统脱氮除磷效果变差.
3.2 在不同补料时间条件下,微生物群落结构发生了很大的变化,在空白条件以及好氧0h 补料条件下,优势菌为既能合成PHA 同时能够脱氮或除磷的Acinetobacter,当条件变为好氧1h补料时,优势菌变为了能合成PHA的Hydrogenophaga和Flavobacterium.
