Fe( Ⅲ)对Anammox 污泥脱氮效能长短期影响
2024-03-28郭佳文刘天琪赵魏东苏州科技大学环境科学与工程学院江苏苏州25009苏州科技大学江苏水处理技术与材料协同创新中心江苏苏州25009苏州天竣环境科技有限公司江苏苏州25009
郭佳文,林 兴,李 祥,2,3*,黄 勇,2,刘天琪,赵魏东(.苏州科技大学环境科学与工程学院,江苏 苏州 25009;2.苏州科技大学,江苏水处理技术与材料协同创新中心,江苏 苏州 25009;3.苏州天竣环境科技有限公司,江苏 苏州 25009)
厌氧氨氧化(Anammox)与传统生物脱氮相比,可减少64%的溶解氧需求,节省100%的有机碳源,降低 80%~90%的污泥量,并具有较高的脱氮效能[1-2].目前, Anammox 已经从实验室小试阶段走向工程应用阶段[3].然而, Anammox 菌倍增时间长,对环境因子比较敏感(温度,溶解氧,pH 值等)限制着其大规模的工业运用[4].
铁是微生物生长的必需元素,几乎参与了所有重要的新陈代谢,微生物细胞体内的呼吸作用,氧化还原反应和脱氧核糖核酸(DNA)前体的合成,是微生物生长的限制因子之一[5]. Anammox 菌在新陈代谢的过程中需要大量含酶的血红素(超过细胞总蛋白质的20%),在合成血红蛋白的同时需要大量吸收并存储铁[6],铁的存在可促使Anammox 反应器的脱氮能力提高[7-8].Fe( Ⅱ)相比于 Fe( Ⅲ)更利于微生物的吸收利用,因此许多研究铁在Anammox 体系中作用时均投加Fe( Ⅱ)[9].然而在模拟废水配置的过程中,Fe( Ⅱ)极易被氧化(E0[Fe2+/Fe3+]高达+0.77V).甚至投加Fe3O4和具有更强还原性的零价铁时,体系中的铁都主要以Fe( Ⅲ)形式存在[10-11].因此,在模拟废水的配置过程中投加Fe( Ⅱ)基本被氧化为Fe( Ⅲ).然而,有关Fe( Ⅱ)对Anammox 菌活性影响的研究报道中都没有强调如何保证体系中 Fe( Ⅱ)不被氧化.所投加的Fe( Ⅱ)极可能被氧化为Fe( Ⅲ),反应器内铁价态及浓度变化对Anammox 微生物活性影响还需进一步分析[12-13].
本研究向Anammox 体系中投加Fe( Ⅲ),通过长短期批式试验,研究了铁浓度及价态变化对Anammox 菌脱氮效能、污泥形态和微生物群落结构的影响,并建立Fe( Ⅲ)对Anammox 污泥活性影响的动力学模型,通过氮素转化比的变化探讨Anammox 体系中铁对氮素的转化的影响.
1 材料与方法
1.1 接种污泥及配水
接种污泥取自本课题组自2008 年成功驯化后长期运行至今的Anammox 种泥[1].整个培养过程中Anammox 脱氮效果良好,脱氮速率(NRR)为1.2kgN/(L·d),出水NH4+-N, NO2--N 的去除率均保持在90%以上,污泥形态基本为颗粒,粒径主要分布在0.5~2mm,混合液挥发性悬浮固体(MLVSS)/混合液悬浮固体(MLSS)为0.7~0.8.
实验所用废水由人工配置.废水主要由NH4Cl(按需配制),NaNO2(按需配制),NaHCO31000mg/L,KHCO31000mg/L, KH2PO427mg/L, CaCl2·2H2O 136mg/L, MgSO4·7H2O 200mg/L, Fe(Ⅲ )EDTA 储备液浓度为0.03mol/L(以Fe( Ⅲ)计,按需投加),微量元素浓缩液成分为(mg/L):EDTA 5000, ZnSO4·7H2O 430, CoCl2·6H2O 240, MnCl2·4H2O 990, NaMoO4·2H2O 220, NiCl2·6H2O 190, NaSeO4·10H2O 210,H3BO414.
1.2 短期批次实验
为使接种污泥的脱氮性能相近,提高实验准确度,将含水的Anammox 污泥进行泥水分离.然后将分离后的颗粒污泥等分为12份,每份约5g,分别置于12个1L的血清瓶中.恒温气浴振荡器32℃连续培养15h.根据脱氮效能变化,选用最接近的6 个(差值不大于5%),以进一步保证污泥等分.
在Fe( Ⅲ)对Anammox 污泥短期影响实验时,6个血清瓶分别加入800mL 营养液以及不同浓度的Fe( Ⅲ)(0.03, 0.06, 0.09, 0.12, 0.18mol/L),用高纯氮吹脱15min 以去除瓶内上部空气及液相溶解氧. 通过HCl 调节pH7.5,采用恒温培养箱进行培养,搅拌转速为130r/min,控制培养温度32℃.进水NH4+-N,NO2--N 浓度分别为100,130mg/L.通过每间隔3h 取一次样测定氮素的转化,评估Fe( Ⅲ)对Anammox 污泥脱氮性能的影响.
1.3 长期实验
采用相同的方法选取3 个性状相似的污泥1g分别装于500mL 的血清瓶R1, R2, R3 中进行长期实验.每个血清瓶加入400mL 营养液以及不同浓度的Fe( Ⅲ)(表1).初始运行周期设定为1d,其中进水5min,运行1420min,沉淀5min,出水5min,换水比为100%,待脱氮效能逐步上升后再将水力停留时间缩短为 12h 的方式提高反应器总氮负荷(NLR).反应器进水均使用高纯氮吹脱除氧,采用恒温培养箱进行培养,反应搅拌转速为130r/min,控制培养温度35℃.

表1 两个阶段反应器进水Fe( Ⅲ)浓度(mol/L)Table 1 Fe( Ⅲ) concentration in influent water of the twostage reactor(mol/L)
1.4 分析方法
实验中各污染物指标的监测方法均参照文献[14]进行:NH4+-N 采用纳氏试剂分光光度法;NO2--N 和 NO3--N:戴安 ICS900/AS23 离子色谱;Fe(Ⅱ)和Fe(Ⅲ):邻菲啰啉分光光度法及总铁与Fe(Ⅱ)差值计算;pH:哈纳pH211 型酸度计.
1.5 扫描电镜(SEM)分析
从运行结束的R1,R2,R3 中取样,置于2.5%戊二醛溶液中,4℃固定24h,再经过6 种浓度梯度的乙醇溶液(10%, 20%, 40%, 60%, 80%和100%)脱水处理60min,然后在真空干燥箱中干燥8h,然后对样品进行喷金处理,最后用FEI 2500 型(美国)扫描电镜观察.
1.6 微生物群落结构分析
R1,R2,R3 运行结束后,取污泥样品,分别标记为R1, R2 和R3,采用FastPrep DNA 提取试剂盒法(QBIOGENE, USA)提取DNA,并利用1%琼脂糖凝胶电泳检测抽提的基因组 DNA,核对基因组DNA的完整性与浓度.
采用细菌16S V4-V5 区通用引物,对每个样品进行3 个重复扩增,同一样品扩增产物进行混合;前端引物515F(5-GTGCCAGCMGCCGCGG-3),后端引物907R(5-CCGTCAATTCMTTTRAGT TT-3);对PCR产物进行切胶纯化,Qubit定量之后,等物质的量混合,用于建立测序文库,采用illumina hiseq 进行测序和分析.
2 结果与讨论
2.1 短期内Fe(Ⅲ)对Anammox 污泥脱氮效能影响
批次试验的进水NH4+-N 浓度100mg/L、NO2--N浓度130mg/L 左右,每隔3h 取样,观察Fe( Ⅲ)对Anammox 脱氮效能的短期影响(图1).不加Fe( Ⅲ)的对照组反应18h 后,出水NH4+-N,NO2--N 浓度分别为28.64, 35.07mg/L, NRR 为0.208kg/(L·d).进水Fe( Ⅲ)浓度从 0.03mol/L 到 0.09mol/L,NRR 从0.214kg/(L·d)增长到0.238kg/(L·d),较对照组分别提升了2.5%和14.2%.随着进水Fe( Ⅲ)浓度的继续提升,NRR 呈逐渐降低趋势.当进水Fe( Ⅲ)浓度达到0.18mol/L 时,NRR 降至 0.215kg/(L·d),相比于0.09mol/L 铁环境,下降了10.75%.说明短期适量的提升Fe( Ⅲ)也可以促进Anammox 脱氮效能的提高,最适浓度为0.09mol/L.当进水Fe( Ⅲ)浓度短期内高于0.09mol/L 时, Anammox 活性被抑制.Shu 等[15]在研究Fe( Ⅱ)对Anammox 影响的批次实验表明,0.08mol/L Fe( Ⅱ)浓度下,Anammox 菌的比活性可达到0.265d-1,并认为Fe( Ⅱ)浓度高于0.08mol/L,会对Anammox 菌活性产生抑制.而Qiao 等[16]研究表明0.09mol/L 的Fe( Ⅱ)作用下,TN 去除量比对照组(0.03mol/L Fe( Ⅱ))提升了32.8%,且0.09mol/L 为最适Fe( Ⅱ)浓度.本文与Shu 等[15]和Qiao 等[16]研究Fe( Ⅱ)对Anammox 菌活性影响的规律基本相似.

图1 短期内Anammox 污泥脱氮效能随Fe( Ⅲ)浓度的变化Fig.1 Short-time effect of Fe( Ⅲ) on nitrogen removal efficiency of Anammox sludge
2.2 Fe(Ⅲ)抑制Anammox 活性的动力学分析
适量的Fe(Ⅲ)对Anammox 具有促进作用,但过量的Fe(Ⅲ)会对Anammox 产生抑制.采用Haldane模型描述基质抑制动力学[17],模拟方程如下:
式中: NRR 为氮去除速率,kg/(L·d); NRRmax为最大氮去除速率,kg/(L·d);SFe为进水Fe( Ⅲ)浓度,mol/L;KFe为半速率常数,mol/L;KI为半抑制常数,mol/L.
如图2 所示,通过Origin 9.0 对批次试验所得的数据进行Haldane 模型拟合,所得拟合曲线的相关系数 R2为0.999.这说明Haldane 模型可以较好的描述Fe( Ⅲ)对 Anammox 的抑制动力学. NRRmax为0.316kg/(L·d),半速率常数为0.012mol/L,半抑制常数为0.449mol/L, Fe( Ⅲ)浓度为0.09mol/L 为最适宜浓度,Fe( Ⅲ)浓度超过0.09mol/L 时,随着Fe( Ⅲ)浓度的提升,氮去除速率逐步下降.
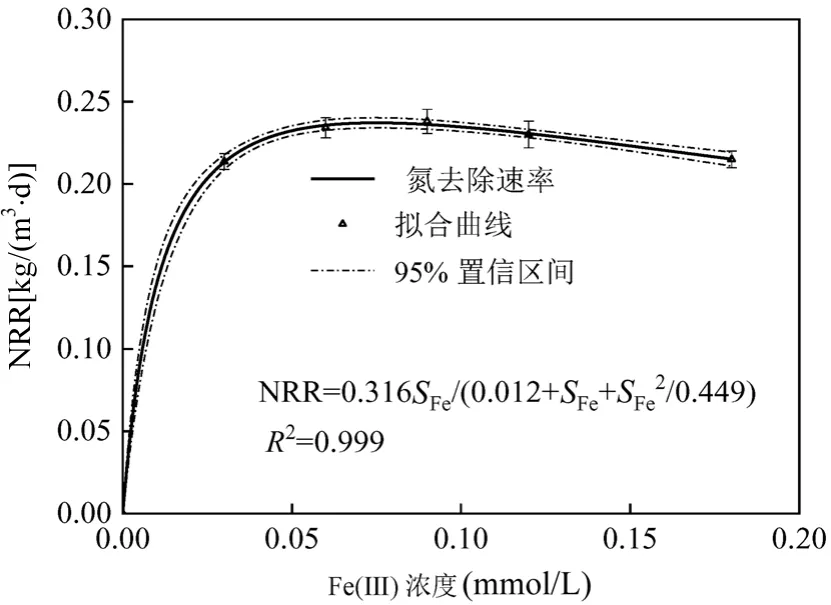
图2 不同Fe(Ⅲ )浓度下Anammox 脱氮效能抑制动力学曲线Fig.2 The model-fitted relationship between Fe(Ⅲ ) concentrations and nitrogen removal efficiency of Anammox using the substrate inhibition kinetics
2.3 长期内Fe(Ⅲ)对Anammox 菌脱氮性能的影响
为了进一步探讨Anammox 菌对Fe( Ⅲ)的耐受性和可驯化性进行长期实验(图3).第1 阶段, NLR保持在0.25kg/(L·d)左右,进水Fe( Ⅲ)浓度分别为0.03,0.06,0.09mol/L 时,3 个反应器的平均NRR 分别为0.123,0.128kg/(L·d)和0.147kg/(L·d).与R1 相比,R2 和R3 的NRR 分别提高了4.3%和19.9%.同时,0.09mol/L Fe( Ⅲ)下R3 平均NRR 和最大NRR 分别比0.03mol/L 的R1 提升19.9%和15.6%. Wei 等[18]分别用缺乏和充足Fe( )Ⅲ的培养基培养Nitrosomonas europaea,结果发现Fe( Ⅲ)充足时,培养基中细菌量是Fe( Ⅲ)缺乏时的1.6~3.3 倍,并且细胞中血红素c的含量更高,说明Fe( Ⅲ)同样可以作为微生物新陈代谢过程中微量铁元素. Qiao 等[16]研究不同浓度Fe( Ⅱ)对Anammox 影响时也发现,投加0.06mol/L Fe( Ⅱ)和0.09mol/L Fe(Ⅱ )的实验组的NRR 相较于对照组分别提升2.6%和7.9%,但是增幅明显低于本实验,表明Fe( Ⅲ)比 Fe( Ⅱ)更能刺激Anammox 系统的脱氮性能.
为了进一步探讨Anammox 菌对Fe( Ⅲ)的耐受性,第31d,保持R1 进水Fe( Ⅲ) 0.03mol/L 不变,R2,R3 进水 Fe( Ⅲ) 浓度分别提升至 0.12mol/L,0.18mol/L, NLR 从0.25kg/(L·d)逐步提升至0.468kg/(L·d),3个反应器的平均NRR分别达到0.265kg/(L·d),0.304kg/(L·d)和0.303kg/(L·d).这一阶段,R2, R3 的NRR 相较于R1,分别提高了14.7%, 14.6%,说明此浓度的Fe( Ⅲ)仍能促进Anammox 反应.但是NRR 增幅比第1 阶段0.09mol/L Fe( Ⅲ)投加量下降了5.2%.然而此阶段下,反应器的NRR 并不像第1 阶段随Fe( Ⅲ)浓度增大而呈梯度上升关系.随着运行时间的延长, 0.18mol/L Fe( Ⅲ)浓度对Anammox 的抑制作用逐渐体现.长期培养至52d 后,R3 的NRR 基本维持不变,并有下降趋势.而R2 的NRR 几乎提高到与R3 一致,甚至高过了R3,最大NRR 比R3 提升了4%.Huang 等[19]研究金属离子对Anammox 影响时,投加 0.08mol/L Fe(Ⅱ ),获得最大 TN 转化量1.93kg/(m3·d),继续提高Fe( Ⅱ)浓度,TN 去除量降低,表明适宜浓度的Fe( Ⅱ)对Anammox 菌的重要性.本研究在长期实验中获得的最适浓度 Fe( Ⅲ)为0.09mol/L,与短期实验一致.
3 个反应器不同时期除Fe( Ⅲ)外,还存在微量的Fe(Ⅱ),其含量与Fe( Ⅲ)投加量相对应,呈现R3>R2>R1 的趋势,特别是第2 阶段, Fe( Ⅲ)浓度差异较大时其更为明显(图4).Zhao 等[20]发现Anammox 细菌中存在大量的铁还原酶,约81%的铁还原酶位于细胞膜部分.Li 等[21]以NH4+-N 和Fe( Ⅲ)为底物,在Anammox 污泥中成功观察到厌氧铁氧化氨现象,即投加的Fe( )Ⅲ作为电子受体参与反应氧化NH4+-N,伴随着NH4+-N的转化自身还原为Fe(Ⅱ).同时,厌氧铁氧化氨过程产生的 Fe(Ⅱ)作为微量矿物质被Anammox 菌吸收.因此,本系统中Fe(Ⅱ)的产生推测是由于厌氧铁氧化氨现象所致,并且随着Fe( Ⅲ)浓度的提升,这种现象更加明显[22].
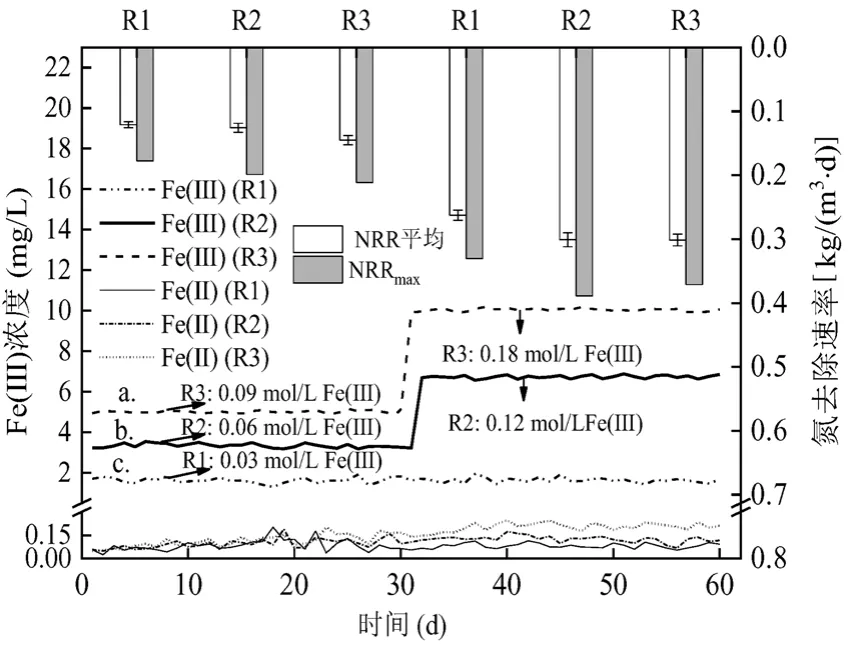
图4 反应器内铁离子浓度变化对比Fig.4 Comparison the Fe concentration of each reactor in two phases
2.4 不同铁离子浓度对Anammox 过程氮转化比的影响
在Anammox 反应过程中,氮素转化比是其反应特性的重要评价指标,NH4+-N: NO2--N: NO3--N 理论值为1: 1.32: 0.26[23].通过研究氮素转化比的变化,进一步分析铁与氮素的同步转化关系(图5).
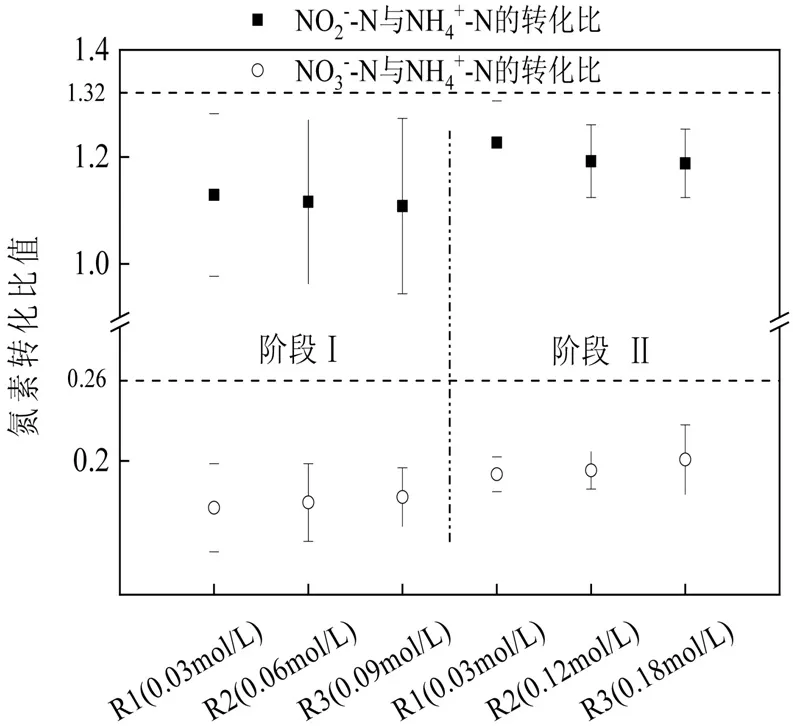
图5 Fe( Ⅲ)浓度对NO2--N/NH4+-N 和NO3--N/NH4+-N 的影响Fig.5 The effect of different Fe( Ⅲ) on NO2--N/NH4+-N and NO3--N/NH4+-N
在第1 阶段, R1, R2, R3 的3 氮平均转化比分别为1:(1.129 ± 0.152):(0.165 ± 0.033), 1:(1.116 ±0.153):(0.169 ± 0.029), 1:(1.108 ± 0.164):(0.173 ±0.022).进入第2 阶段,进水Fe(Ⅲ)浓度提高后,R1,R2,R3 的3 氮平均转化比分别达到1:(1.227 ± 0.078):(0.190 ± 0.013), 1:(1.192 ± 0.068):(0.193 ± 0.014), 1:(1.188 ± 0.0.064):(0.201 ± 0.026),说明Fe( Ⅲ)浓度的提高明显导致了NH4+-N 的过量转化. Shu 等[15]研究Fe(Ⅱ)对Anammox 影响时发现,随着Fe(Ⅱ)浓度从0.02mol/L 提升至0.08mol/L, NO2--N/NH4+-N 由初始的1.311±0.041 降低至1.291±0.015,认为存在厌氧铁氨氧化作用导致NH4+-N 的过量转化.而这种依赖Fe( Ⅲ)还原的NH4+-N 氧化现象,目前已在湿地[24]、稻田[25]等厌氧环境中发现. Sawayama 等[26]通过培养中温厌氧发酵污泥验证了厌氧铁氧化氨现象,所添加铁的形态即为Fe(III)EDTA 络合物.Yang 等[27]在厌氧条件下利用同位素示踪技术检测到旱地土壤中存在铁还原耦合氨氧化现象. Pham 等[28]和Bond 等[29]研究表明,当体系中溶解氧有限时, Aeromonas hydrophila 和Geobacter sulfurreducen 两种菌可以在缺氧条件下利用Fe( Ⅲ)代替氧作为电子受体参与反应.相同阶段内R1,R2,R3 的NO2--N 与NH4+-N 的转化比均呈现递减趋势,说明随着Fe( Ⅲ)浓度的提升,更多的Fe(Ⅲ )作为电子受体参与氧化NH4+-N,导致转化比随Fe( Ⅲ)浓度提升而降低.与此同时,3 个反应器出水NO3--N/NH4+-N 均是逐渐增大.Park 等[30]在验证厌氧铁氧化氨反应时发现产物中有大量的NO3--N 生成.Li 等[21]以Fe(Ⅲ )为电子受体在Anammox 体系内,探究Fe(Ⅲ )还原氨氧化现象,发现出水NO2--N浓度始终低于1mg/L,而出水NO3--N 约为15mg/L,NO3--N 和N2为反应的主要产物.伴随着铁浓度的提升,厌氧铁氧化氨反应受到强化,产物主要是NO3--N,而参与该作用的功能微生物还需进一步研究.
2.5 Fe(Ⅲ)对Anammox 菌形态的影响
将经过长期运行后的3 个反应器污泥取出进行扫描电镜分析.接种的Anammox 菌主要呈球状,与现有文献报道的Anammox 菌的形态结构一致(图6(a))[31].经过长期的Fe( Ⅲ)刺激培养下颗粒表面呈均匀球状,表面光滑,排列紧密,单个Anammox 菌的大小在0.9~1.2µm, Anammox菌体结构和形态趋于稳定(图6(b),(c)).这表明低浓度Fe( Ⅲ)对Anammox 菌结构的形成具有促进作用.

图6 Anammox 污泥扫描电镜照片Fig.6 The SEM graphs of sludge samples taken from reactor
2.6 微生物群落结构分析
如表2 所示,3 个反应器的序列数在27908~31280 之间,差异不大.Chao 1, Shannon, Simpson 指数常用于表征细菌群落和物种的丰富度,其中丰富度指数Chao 1 可以估算群落中OTUs 的数目,在生态学中常用来估计物种总数,值越大代表物种总数越多.在低浓度Fe(Ⅲ)的刺激下,反应器内细菌多样性得到提升,反应器内Chao1 值由955 上升至1023.当Fe(Ⅲ)浓度达到0.18mol/L(R3)时,Chao1 值又下降至976,说明Fe(Ⅲ)抑制作用导致细菌多样性的减少.OTUs 的变化规律与Chao1 相一致. Simpson 指数体现了优势物种生物量占群落生物总量的比重.该指数越大表明优势菌群生物量占总生物量比重越大,反之则优势菌群生物量占总生物量比重越小.Simpson 变化趋势表明,Fe(Ⅲ)有利于Anammox菌的富集,而其浓度过高后,对Anammox 菌产生抑制,导致优势菌群比重有所下降.
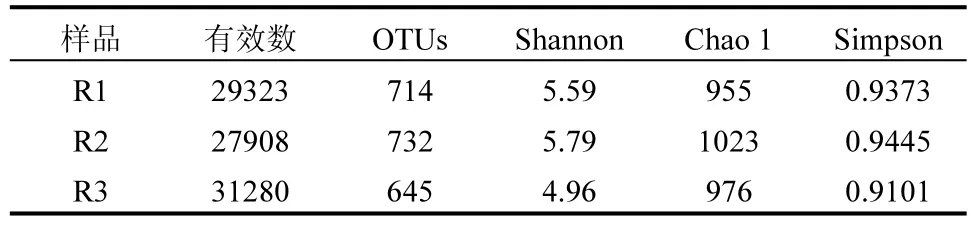
表2 反应器中微生物群落丰富度和多样性估计值的变化Table 2 Variations of richness and diversity estimators of microbial communities in the reactor
从门水平上可知,反应器内细菌群落结构多样性较为丰富,按照丰富度排列主要有Chloroflexi,Proteobacteria, Ignavibacteriae, Bacteroidetes,Planctomycetes, Acidobacteria 等门类(图7a).从脱氮功能菌来看,3个反应器内Proteobacteria所占比例分别为22.6%, 28.0%和27.4%.Planctomycetes 所占比例为2.2%, 4.1%和2.5%,远低于Proteobacteria.说明随着Fe(Ⅲ)浓度的提升,脱氮功能微生物有明显富集.R2 中Proteobacteria 门占比较R1 增长了23.9%,Planctomycetes 更是增长了86.4%,这说明适宜浓度的Fe(Ⅲ)对Anammox 的生长具有重要的促进作用.而当Fe(Ⅲ)浓度过高后,这两种主要脱氮微生物的比例有所下降.
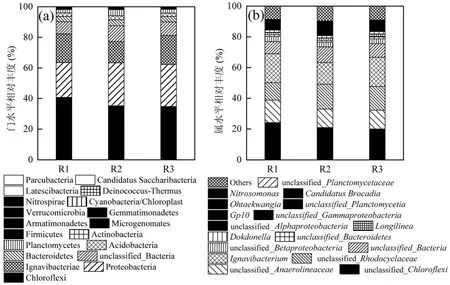
图7 Fe(Ⅲ)对Anammox 系统微生物群落结构的影响Fig.7 Effects of Fe(Ⅲ) on microbial community structure in Anammox system
为进一步阐明Fe(Ⅲ)对Anammox 系统细菌群落的演化,在属的水平上,选取系统中占有量超过0.1%的属进行分析(图7b). Proteobacteria 门中占比较高的是 Rhodoplanes 属(11.37%~16.18%),Betaproteobacteria 属(3.17%~3.38%),Dokdonella 属(1.01%~1.23%).这些属均属于Proteobacteria 主要细菌,在废水处理及环境样品中常被检测到.Rhodoplanes 属可在厌氧黑暗环境下很好地降解有机物和一些难以生物降解的含氮杂环化合物如喹啉都能较好地被其降解[32].而Fe(Ⅲ)明显刺激了Rhodoplanes 属的生长,在R2 中的丰度达到16.18%,较R1 增幅达到42.3%.而Fe(Ⅲ)浓度达到0.18mol/L时对Rhodoplanes 属产生抑制,R3 中丰度略有下降.Betaproteobacteria 属,Dokdonella 属则没有明显变化.Planctomycetes 中,检测到Candidatus Brocadia 属的存在,但含量没有明显变化,而 unclassified_Planctomycetia 的含量,呈现R2>R3>R1 的趋势,与Fe(Ⅲ)对Anammmox 系统脱氮的作用规律一致.其他的菌属, 诸如未被分类的 Chloroflexi,Anaerolineaceae 属的含量在Fe(Ⅲ)浓度下提高下出现减少,原因需要进一步深入研究.
3 结论
3.1 短期结果表明,适量的 Fe( Ⅲ)可以提升Anammox 菌脱氮效能,0.09mol/L 为最适浓度.此时氮去除速率为0.238kg/(L·d),较之对照组0.208kg/(L·d),提升了14.2%.继续提高进水Fe( Ⅲ)浓度,氮去除速率逐步下降,当Fe( Ⅲ)浓度升至0.18mol/L 时,氮去除速率降至0.215kg/(L·d),比0.09mol/L Fe( Ⅲ)下降10.75%.短期实验拟合得到Fe( Ⅲ)对Anammox半速率常数(KFe)为0.012mol/L,半抑制常数(KI)为0.449mol/L.
3.2 长期结果表明, 0.09mol/L Fe( Ⅲ)环境下,Anammox 氮去除速率增速最快,较对照组提升19.9%. Fe( Ⅲ)浓度为0.09~0.18mol/L 时,Anammox氮去除速率可持续增加,但增幅随Fe( Ⅲ)浓度增加而下降. NO2--N 与NH4+-N 的转化比在1.108 和1.227 之间波动,并随Fe( Ⅲ)浓度的提升而降低.
3.3 随着 Fe( Ⅲ)浓度的提高,主要脱氮门类Proteobacteria, Planctomycetes 占比明显增长,Planctomycetes 主要属为Candidatus Brocadia 属和unclassified_Planctomycetia, 其 中 unclassified_Planctomycetia 的含量变化与Fe( Ⅲ)作用规律一致,而Candidatus Brocadia 属含量没有明显变化.
3.4 随着Fe( Ⅲ)浓度增加系统中Fe( Ⅱ)浓度也随着增加,并且NH4+-N 过量转化和NO3--N 过量生成现象,推测存在厌氧铁还原氨氧化现象.
