TRPM2离子通道在颞叶癫痫相关神经炎症中的作用研究
2024-03-27王星辰刘瑞寒肖翔宇夏敏李秋波孔庆霞
王星辰?刘瑞寒?肖翔宇?夏敏?李秋波?孔庆霞


【摘要】目的 探讨小胶质细胞及星形胶质细胞中的瞬时受体电位M2型(TRPM2)离子通道在颞叶癫痫(TLE)相关神经炎癥中的作用。方法 将大鼠随机分为对照组和癫痫组,癫痫组采用氯化锂-毛果芸香碱(匹罗卡品)制作癫痫模型,对照组给予等剂量的生理盐水代替,根据造模后观察的时间将TLE大鼠随机分为7个亚组(n = 5):急性期(3 h组、6 h组、1 d组、2 d组)、潜伏期(14 d组)、慢性期(30 d组、90 d组)。检测TRPM2在不同亚组TLE大鼠海马中的表达及TRPM2在大鼠海马中的细胞定位情况。采用过氧化氢(H2O2)诱导小胶质细胞BV2及星形胶质细胞C8细胞系,检测细胞释放IL-1β、IL-6和TNF-α的水平,检测H2O2诱导的BV2及C8细胞中TRPM2、聚腺苷二磷酸核糖聚合酶-1(PARP-1)、糖原合成酶激酶3β(GSK-3β)、磷酸化核因子κB p65蛋白(p-NF-κB p65)的表达变化,同时检测H2O2诱导BV2细胞中钙调神经磷酸酶(CaN)的活性变化。结果 急性期TLE大鼠海马中的TRPM2表达升高(P < 0.05)。H2O2诱导的BV2及C8细胞中TRPM2的表达升高、炎症因子释放增加(P均< 0.05),H2O2可促进BV2细胞中PARP-1、p-NF-κB p65的表达并提高CaN、GSK-3β的活性(P均< 0.05)。结论 氧化应激可促进小胶质细胞及星形胶质细胞TRPM2及促炎细胞因子的表达,癫痫反复发作引起的氧化应激可能在小胶质细胞中通过TRPM2/CaN/ p-NF-κB p65通路介导TLE相关神经炎症的发生。
【关键词】TRPM2;颞叶癫痫;神经炎症;小胶质细胞
Role of TRPM2 channel in temporal lobe epilepsy-associated neuroinflammation Wang Xingchen△, Liu Ruihan, Xiao Xiangyu, Xia Min, Li Qiubo,Kong Qingxia.△Cheeloo College of Medicine, Shandong University, Jinan 250012, China
Corresponding author,Kong Qingxia, E-mail: kxdqy8@sohu.com
【Abstract】Objective To investigate the role of transient receptor potential melatonin 2 (TRPM2) ion channels in microglia and astrocytes in temporal lobe epilepsy (TLE) -associated neuroinflammation. Methods Rats were randomly divided into the control group and epilepsy group. Seizure models were induced by lithium chloride-pilocarpine in the epilepsy group, and those in the control group were injected with the same dose of saline. The TLE rats were randomly divided into 7 subgroups according to the observation time after model establishment: acute phase (3 h group, 6 h group, 1 d group, 2 d group), latent phase (14 d group) and chronic phase (30 d group, 90 d group) subgroups (n = 5). The expression level of TRPM2 in the hippocampus of TLE rats at different stages were detected, and the cellular localization of TRPM2 in the brain of TLE rats was investigated. BV2 and C8 cell lines were induced by hydrogen peroxide (H2O2). The levels of IL1-β, IL-6 and TNF-α released by BV2 and C8 cells were observed by ELISA. The levels of TRPM2, poly (ADP-ribose) polymerase 1 (PARP-1), glycogen synthase kinase-3β (GSK-3β) and phosphorylated nuclear factor-κb p65 (p-NF-κb p65) were measured in H2O2-induced BV2 and C8 cells. Meantime, the activity of Calcineurin (CaN) in H2O2-induced BV2 was observed. Results The TRPM2 expression in 2d epileptic rat hippocampus was increased (P < 0.05). The expression of TRPM2 and the release of inflammatory cytokines were increased in H2O2 induced-BV2 and C8 cells (both P < 0.05). H2O2 could up-regulate the expression of PARP-1 and p-NF-κB p65 and enhance the activity of CaN in BV2 cells (all P < 0.05). Conclusions Oxidative stress can up-regulate the expression levels of TRPM2 and pro-inflammatory cytokines in microglia and astrocytes. Oxidative stress caused by recurrent epilepsy may mediate the occurrence of TLE-associated neuroinflammation through the TRPM2/ CaN/p-NF-κB p65 pathway in microglia.
【Key words】TRPM2; Temporal lobe epilepsy; Neuroinflammation; Microglia
癫痫是一种严重的慢性神经系统疾病,全世界超过7 000万人受其影响[1]。目前约30%的癫痫患者药物治疗效果不佳,进展为耐药性癫痫,其中颞叶癫痫(TLE)是最常见的耐药性癫痫类型[2-3]。
有证据表明,神经元兴奋性增加伴随着神经炎症和活性氧的过度产生,且神经炎症在癫痫的病理生理中起着重要作用,是耐药性癫痫的共同病理特征[4-6]。因此,进一步了解神经炎症在癫痫中的作用,为患者提供更多的治疗方法十分必要。
瞬时受体电位M2型(TRPM2)离子通道是瞬时受体电位通道超家族中TRPM亚家族的第二个成员,被认为是一种氧化应激敏感的钙离子(Ca2+)通透性通道,对过氧化氢(H2O2)等氧化应激产物的刺激高度敏感[7-8]。细胞内升高的Ca2+和ADP核糖(ADPR)可调节TRPM2离子通道的开放,此外,TRPM2也可被不同的应激因素调节,如酸性pH值、谷胱甘肽和高温[9-11]。TRPM2广泛分布于中枢神经系统,在神经元、星形胶质细胞及小胶质细胞中高表达,并参与氧化应激引起的神经元死亡[7]。Hu等[12]发现敲除TRPM2可抑制癫痫小鼠海马中小胶质细胞和星形胶质细胞的激活,并可降低癫痫小鼠海马中的神经炎症反应,提示TRPM2在癫痫相关神经炎症中发挥重要作用, 但相关的报道很少,潜在细胞和分子机制仍有待深入研究。
氧化应激下的TRPM2信号传导主要围绕聚腺苷二磷酸核糖聚合酶(PARP),尤其是PARP-1[13]。现已证明H2O2等过氧化物可激活PARP-1,从而激活TRPM2离子通道,导致Ca2+内流,细胞内Ca2+稳态发生变化[14]。钙调神经磷酸酶(CaN)在大脑中高表达,是已知的唯一对Ca2+信号高度敏感的丝氨酸/苏氨酸蛋白磷酸酶,在调节神经免疫功能和神经炎症过程中发挥着不可或缺的作用[15]。据报道,在神经源性细胞中,CaN可调节糖原合成酶激酶3β(GSK-3β)丝氨酸-9的去磷酸化,导致GSK-3β的激活 [16]。Jiang等[16]在研究双相情感障碍时发现,TRPM2离子通道可通过激活CaN來调节GSK-3β的活性,而GSK-3β的激活可导致核转录因子-κB p65蛋白(NF-κB p65)的磷酸化和易位,加重炎症反应[17]。由此推测,癫痫反复发作引起的氧化应激反应可通过促进PARP-1的产生激活TRPM2离子通道,介导Ca2+内流,并通过CaN/GSK-3β/ NF-κB p65通路介导神经炎症的产生。本研究首次对TRPM2介导癫痫相关神经炎症的主要作用细胞PARP-1/TRPM2/CaN/GSK-3β/ NF-κB p65通路在癫痫相关神经炎症中的作用进行了探索,分析TRPM2在癫痫发生发展中的作用,为TLE的治疗提供新的思路。
材料与方法
一、实验材料
1.实验动物
90只7~8周龄、体质量270~300 g的 SPF级雄性SD大鼠购自济南鹏悦有限公司。
2.主要试剂与仪器
氯化锂、阿托品、毛果芸香碱(匹罗卡品)购自中国Macklin公司,TRPM2抗体、PARP-1抗体、辣根过氧化物酶标记的山羊抗兔IgG二抗、离子钙结合衔接分子 1(Iba-1)抗体、山羊抗兔IgG H&L Alexa Fluor R 647以及山羊抗小鼠IgG H&L Alexa Fluor R 555购自美国Abcam公司,TRPM2抗体(用于免疫荧光染色)购自中国ABclonal公司,p-NF-κB p65抗体购自美国Affinity公司,GAPDH抗体、超敏ECL蛋白印迹检测试剂购自美国 Proteintech 公司,胶质纤维酸性蛋白(GFAP)抗体、4,6-二脒基-2-苯基吲哚(DAPI)抗体购自中国BOSTER公司,过氧化氢(H2O2)购自美国Sigma-Aldrich公司,全细胞裂解试剂盒购自中国凯基生物公司,BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司,GENMED细胞CaN活性比色法定量检测试剂盒购自上海杰美基因医药科技生物有限公司。使用美国Bethesda的ImageJ软件,美国GE公司的Image Quant LAS 500 生物分子成像仪,德国ZEISS公司的LSM800共聚焦显微镜。
二、实验方法
1.分组与模型建立
采用随机数表法将大鼠分为对照组和癫痫组,于癫痫组大鼠腹腔注射氯化锂,18~20 h后腹腔注射阿托品,注射阿托品30 min后腹腔注射盐酸匹罗卡品并进行行为学观察,根据Racine评分进行分级,达到Ⅳ~Ⅴ级癫痫发作的大鼠为TLE造模成功大鼠[18]。对注射匹罗卡品30 min后未达到Ⅳ~Ⅴ级癫痫发作的大鼠,继续每10 min注射10 mg/kg匹罗卡品,直至达到Ⅳ~Ⅴ级癫痫发作(最多追加5次)。对惊厥持续1 h的大鼠给予腹腔注射10 mg/kg
地西泮控制惊厥。于对照组大鼠腹腔注射0.9%生理盐水。死亡大鼠及癫痫发作等级未达到Ⅳ~Ⅴ级的大鼠退出实验。造模成功的大鼠按随机数表法分为7个亚组(n = 5):急性期(3 h、6 h、
1 d、2 d)、潜伏期(14 d)和慢性期(30 d、90 d)。本动物实验经济宁医学院附属医院伦理委员会批准(批件号:2023-04-B002)。
2. 细胞培养
BV2细胞及C8细胞使用含有4 500 mg/L葡萄糖、1%青霉素/链霉素和10%胎牛血清的DMEM培养基在5%二氧化碳、37 ℃下培养。将细胞接种于6孔板中直至细胞密度达到70%~80%。实验组BV2细胞及C8细胞用含1 mmol/L H2O2的DMEM处理3 h、6 h、12 h、24 h,对照组细胞用等体积的DMEM处理。本研究所有细胞实验均进行3次。
3. 蛋白免疫印迹法检测相关蛋白的表达
TLE大鼠中TRPM2的表达以及H2O2诱导的BV2细胞中TRPM2、PARP-1、p-NFκB-p65的表达:根据全细胞裂解试剂盒(KeyGEN BioTECH)的说明书提取TLE大鼠海马以及BV2细胞的蛋白进行定量。上样分离、转移、封闭后于4℃与一抗孵育过夜,洗涤,将膜与HRP标记的山羊抗兔IgG二抗在室温中孵育1 h。使用超敏ECL蛋白印迹检测试剂显示免疫反应带。用ImageJ软件进行半定量分析。
4. 免疫荧光染色
组织切片复温后用磷酸盐缓冲液(PBS)冲洗,孵育、封闭、移除封闭液后与TRPM2抗体以及Iba-1抗体在4℃孵育过夜,洗涤,室温与山羊抗兔IgG 和山羊抗小鼠IgG孵育1 h,洗涤,用DAPI染色15 min,洗涤后封片。采用LSM800共聚焦显微镜进行图像采集。
5. ELISA检测细胞培养基炎症因子表达情况
上述细胞离心后取培养基,按照说明书用ELISA试剂盒检测其中的IL-1β、IL-1及TNF-α,根据标准品的浓度与检测结果计算出待测样品中各细胞因子浓度。
6. CaN活性检测
用CaN检测试剂盒检测H2O2诱导的BV2细胞中CaN活性,在平板扫描仪660 nm处测定吸光度。CaN活性的定义为CaN以1 mg蛋白/分钟释放的游离磷酸盐量。
三、统计学处理
采用GraphPad Prism 8进行统计分析。实验数据均符合正态分布,以表示。多组间比较采用单因素方差分析,多重比较使用Dunnett-t检验。P < 0.05为差异有统计学意义。
结果
一、TRPM2在癫痫组大鼠海马中呈动态表达
急性期(2 d)癫痫组大鼠海马中TRPM2表达升高(P < 0.05);而潜伏期和慢性期(14 d、30 d、90 d)TLE大鼠海马中TRPM2的表达与对照组比较差异无统计学意义。见图1。
二、TRPM2在癫痫组大鼠海马中的细胞定位
免疫荧光结果显示,TRPM2在对照组和癫痫组大鼠海马中与Iba-1和GFAP共表達,表明TRPM2在对照组和癫痫组大鼠海马的星形胶质细胞和小胶质细胞中均有表达。与对照组相比,癫痫组中小胶质细胞处于激活状态,表现为小胶质细胞增多、远端突触减少、突触增粗、胞体变大、Iba-1荧光强度增强,同时,TRPM2在活化的小胶质细胞中的表达较多。癫痫组中星形胶质细胞胞体增大、突触变多、增粗、荧光强度增强,表明癫痫组海马中星形胶质细胞激活,且TRPM2在激活的星形胶质细胞中的表达较多。见图2。
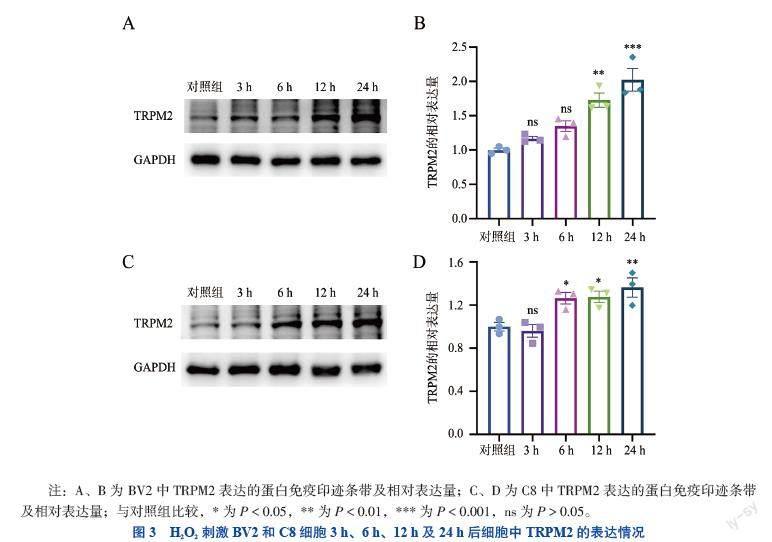
三、TRPM2在H2O2诱导的C8和BV2细胞中的表达
蛋白免疫印迹结果显示,H2O2诱导的BV2细胞及C8细胞中TRPM2表达量均较对照组高(PBV2 12 h<
0.01;PBV2 24 h <0.001;PC8 6 h <0.05;PC8 12 h <0.05;PC8 24 h <
0.01),且表达量随H2O2刺激时间的延长而增加。见图3。
四、H2O2诱导的BV2和C8细胞中促炎细胞因子的表达
采用ELISA检测H2O2诱导的BV2和C8细胞分泌促炎细胞因子IL-1β、IL-6以及TNF-α的水平。结果显示,随着H2O2刺激时间的延长,BV2细胞释放IL-1β、IL-6及TNF-α的水平增加(PIL-1β 3 h <
0.05;PIL-1β 12 h <0.01;PIL-1β 24 h <0.001;PIL-6 24 h <0.05;PTNF-α 3 h <0.01;PTNF-α6 6 h <0.001;PTNF-α 12 h <0.001;
PTNF-α 24 h <0.001)。C8细胞释放IL-1β和IL-6的水平也增加(PIL-1β 12 h <0.05;PIL-1β 24 h <0.05;PIL-6 24 h <0.01),而TNF-α的含量与对照组比较差异无统计学意义。见图4。
五、PARP-1、TRPM2、GSK-S9、GSK以及p-NF-κB p65在H2O2诱导的BV2和C8细胞中的表达
用H2O2诱导BV2和C8细胞系来模拟癫痫发作时氧化应激对小胶质细胞和星形胶质细胞的影响。结果显示,随着H2O2诱导时间的延长,BV2细胞中PARP-1、TRPM2和p-NF-κB p65的表达逐渐增加(PPARP-1 6 h <0.01;PPARP-1 12 h <0.001;PPARP-1 24 h<0.001;PPARP-1 6 h <0.01;PTRPM2 12 h <0.01;PTRPM2 24 h<0.001;
Pp-NF-κB p65 12 h <0.001;Pp-NF-κB p65 24 h <0.01),GSK-3β/GSK的比值下降、GSK的活性增加(PGSK-3β/GSK 12 h <0.05;PGSK-3β/GSK 24 h <0.001),见图5。在H2O2诱导的C8细胞中,TRPM2表达及GSK的活性也增加(PTRPM2 6 h <
0.05;PTRPM2 12 h <0.05;PTRPM2 24 h<0.01;PGSK-3β/GSK 6 h <
0.001;PGSK-3β/GSK 12 h <0.001;PGSK-3β/GSK 24 h < 0.001),而PARP-1以及p-NF-κB p65的表达与对照组比较差异无统计学意义。见图6。
六、H2O2诱导的BV2细胞中CaN活性的测定
结果表明,H2O2诱导的BV2细胞中CaN的活性随着H2O2刺激时间延长而增加,在12 h、24 h时增加具有统计学意义(P12 h < 0.01;P24 h < 0.01)。见图7。
讨论
TRPM2已被证实参与癫痫相关认知功能障碍的发生,并在癫痫相关神经炎症中发挥作用[12, 19]。本研究明确了TRPM2在急性期TLE大鼠海马中表达升高,进一步验证了TRPM2与TLE发生密切相关。TRPM2对氧化应激刺激高度敏感,TLE大鼠海马中TRPM2表达升高可能会增加海马对氧化应激的易感性,更易受到癫痫发作引起的氧化应激的损伤,促进癫痫相关神经炎症的发生。有研究表明,敲除TRPM2并不影响匹罗卡品诱导癫痫点燃[12]。据此,本研究团队推断TRPM2可能参与了匹罗卡品诱导的初始脑损伤的发生以及大鼠脑内癫痫灶的形成。
TRPM2离子通道介导的氧化应激和炎症反应在多发性硬化、缺血性脑卒中、创伤性脑损伤和阿尔茨海默病等多种神经系统疾病中发挥作用[20-24]。Hu等[12]的研究显示,敲除TRPM2可抑制匹罗卡品癫痫小鼠中小胶质细胞和星形胶质细胞的激活,并降低癫痫小鼠海马中IL-1β、TNF-α、趋化因子配体2(CXCL2)、IL-6 mRNA的表达,但TRPM2在调节癫痫相关神经炎症中的具体作用仍需进一步研究。本研究显示TRPM2在癫痫大鼠海马小胶质细胞和星形胶质细胞中均有表达,因此本研究团队进一步利用H2O2刺激BV2细胞及C8细胞来模拟癫痫反复发作引起的氧化应激对小胶质细胞和星形胶质细胞的影响,结果显示H2O2可激活BV2细胞及C8细胞中的TRPM2并产生促炎细胞因子。现认为,氧化应激可通过加重神经炎症促进癫痫的发生,因此推测氧化应激可上调小胶质细胞及星形胶质细胞TRPM2的表达,增加胶质细胞对氧化应激的易感性,并通过TRPM2介导小胶质细胞中促炎细胞因子的产生,进而促进TLE的发生发展[25]。
TRPM2在中枢神经系统中表达最高,并且在小胶质细胞中富集,其激活被证实可以刺激炎症反应[26]。Raghunatha等[27]发现小胶质细胞N-甲基-D-天冬氨酸受体通过PARP-1/TRMP2信号驱动促炎症反应。本研究显示,在H2O2刺激的BV2细胞中,PARP-1、TRPM2和p-NF-κB p65的表达升高,GSK-3β及CaN活性升高,推测癫痫反复发作时,氧化应激可能通过促进小胶质细胞中PARP-1的产生激活TRPM2离子通道的开放,导致Ca2+内流,并通过CaN/GSK-3β/NF-κB p65引发一系列促炎细胞因子的产生,最终加重神经炎症反应,促进癫痫的反复发作。与小胶质细胞相比,H2O2刺激的C8细胞分泌促炎细胞因子的能力较弱,且PARP-1、p-NF-κB p65在C8细胞中的表达水平无明显变化,据此认为,TRPM2可能主要在小胶质细胞中介导癫痫相关神经炎症的发生。
综上所述, TRPM2在TLE大鼠海马中的高表达使海马更易受到癫痫发作时氧化应激的影响,并可能在小胶质细胞中通过TRPM2/CaN/GSK-3β/p-NF-κB p65通路参与癫痫相关神经炎症的发生,从而促进癫痫的反复发作。本研究结果提示小胶质细胞中的TRPM2可能是TLE治疗的一个新靶点,接下来将进一步明确小胶质细胞中TRPM2/CaN/GSK-3β/p-NF-κB p65通路在TLE中的作用,并深入探讨星形胶质细胞的TRPM2在癫痫中的作用机制。
参 考 文 献
[1] Thijs R D, Surges R, OBrien T J, et al. Epilepsy in adults[J]. Lancet, 2019, 393(10172): 689-701.
[2] Ali A E, Mahdy H M, Elsherbiny D M, et al. Rifampicin ameliorates lithium-pilocarpine-induced seizures, consequent hippocampal damage and memory deficit in rats: impact on oxidative, inflammatory and apoptotic machineries[J]. Biochem Pharmacol, 2018, 156: 431-443.
[3] 周佳秀, 田绍文, 旷昕. 能量代謝在癫痫疾病中的研究进展[J]. 新医学, 2019, 50(12): 881-885.
Zhou J X, Tian S W, Kuang X. Research progress on energy metabolism in epilepsy[J]. J New Med, 2019, 50(12): 881-885.
[4] Parsons A L M, Bucknor E M V, Castroflorio E, et al. The interconnected mechanisms of oxidative stress and neuroinflammation in epilepsy[J]. Antioxidants, 2022, 11(1): 157.
[5] Vezzani A, Balosso S, Ravizza T. Neuroinflammatory pathways as treatment targets and biomarkers in epilepsy[J]. Nat Rev Neurol, 2019, 15(8): 459-472.
[6] Terrone G, Balosso S, Pauletti A, et al. Inflammation and reactive oxygen species as disease modifiers in epilepsy[J]. Neuropharmacology, 2020, 167: 107742.
[7] Wang Q, Liu N, Ni Y S, et al. TRPM2 in ischemic stroke: structure, molecular mechanisms, and drug intervention[J]. Channels, 2021, 15(1): 136-154.
[8] Ji D, Luo Z W, Ovcjak A, et al. Role of TRPM2 in brain tumours and potential as a drug target[J]. Acta Pharmacol Sin, 2022, 43(4): 759-770.
[9] Zong P, Feng J, Yue Z, et al. Functional coupling of TRPM2 and extrasynaptic NMDARs exacerbates excitotoxicity in ischemic brain injury[J]. Neuron, 2022, 110(12): 1944-1958.e8.
[10] Huang Y, Roth B, Lü W, et al. Ligand recognition and gating mechanism through three ligand-binding sites of human TRPM2 channel[J]. eLife, 2019, 8: e50175.
[11] Wang L, Fu T M, Zhou Y, et al. Structures and gating mechanism of human TRPM2[J]. Science, 2018, 362(6421): eaav4809.
[12] Hu H, Zhu T, Gong L, et al. Transient receptor potential melastatin 2 contributes to neuroinflammation and negatively regulates cognitive outcomes in a pilocarpine-induced mouse model of epilepsy[J]. Int Immunopharmacol, 2020, 87: 106824.
[13] Malko P, Jiang L H. TRPM2 channel-mediated cell death: an important mechanism linking oxidative stress-inducing pathological factors to associated pathological conditions[J]. Redox Biol, 2020, 37: 101755.
[14] ??nar R, Naz?ro?lu M. TRPM2 Channel Inhibition Attenuates Amyloid β42-Induced Apoptosis and Oxidative Stress in the Hippocampus of Mice. Cell Mol Neurobiol[J]. 2023, 43(3):1335-1353.
[15] Ronan P J, Flynn S A, Beresford T P. Calcineurin signaling as a target for the treatment of alcohol abuse and neuroinflammatory disorders[J]. Prog Mol Biol Transl Sci, 2019, 167: 125-142.
[16] Jang Y, Lee S H, Lee B, et al. TRPM2, a Susceptibility Gene for Bipolar Disorder, Regulates Glycogen Synthase Kinase-3 Activity in the Brain[J]. J Neurosci, 2015, 35(34): 11811-11823.
[17] Aloor R, Zhang C, Bandyopadhyay M, et al. Impact of nuclear factor-κB on restoration of neuron growth and differentiation in hippocampus of degenerative brain[J]. J Neurosci Res, 2015, 93(10): 1471-1475.
[18] Racine R J. Modification of seizure activity by electrical stimulation: II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972, 32(3): 281-294.
[19] Zheng Q, Zhu T, Hu H, et al. TRPM2 ion channel is involved in the aggravation of cognitive impairment and down regulation of epilepsy threshold in pentylenetetrazole-induced kindling mice[J]. Brain Res Bull, 2020, 155: 48-60.
[20] Liu H W, Gong L N, Lai K, et al. Bilirubin gates the TRPM2 channel as a direct agonist to exacerbate ischemic brain damage[J]. Neuron, 2023, 111(10): 1609-1625.e6.
[21] Miyanohara J, Kakae M, Nagayasu K, et al. TRPM2 channel aggravates CNS inflammation and cognitive impairment via activation of microglia in chronic cerebral hypoperfusion[J]. J Neurosci, 2018, 38(14): 3520-3533.
[22] Shao Y, Chen C, Zhu T, et al. TRPM2 contributes to neuroinflammation and cognitive deficits in a cuprizone-induced multiple sclerosis model via NLRP3 inflammasome[J]. Neurobiol Dis, 2021, 160: 105534.
[23] Zhu T, Zhao Y, Hu H, et al. TRPM2 channel regulates cytokines production in astrocytes and aggravates brain disorder during lipopolysaccharide-induced endotoxin sepsis[J]. Int Immunopharmacol, 2019, 75: 105836.
[24] Wang L, Wei L Y, Ding R, et al. Predisposition to Alzheimers and age-related brain pathologies by PM2.5 exposure: perspective on the roles of oxidative stress and TRPM2 channel[J]. Front Physiol, 2020, 11: 155.
[25] Eastman C L, DAmbrosio R, Ganesh T. Modulating neuroinflammation and oxidative stress to prevent epilepsy and improve outcomes after traumatic brain injury[J]. Neuropharmacology, 2020, 172: 107907.
[26] Zhang Y, Chen K, Sloan S A, et al. An RNA-sequencing transcriptome and splicing database of glia, neurons, and vascular cells of the cerebral cortex[J]. J Neurosci, 2014, 34(36): 11929-11947.
[27] Raghunatha P, Vosoughi A, Kauppinen T M, et al. Microglial NMDA receptors drive pro-inflammatory responses via PARP-1/TRMP2 signaling[J]. Glia, 2020, 68(7): 1421-1434.
(收稿日期:2023-11-04)
(本文編辑:洪悦民)
