基于MRI影像组学联合临床特征的机器学习模型预测宫颈鳞癌组织学分级的价值
2024-03-27王贺真边芳童玉洁段亚楠翟冬枝
王贺真?边芳?童玉洁?段亚楠?翟冬枝


【摘要】目的 探討基于MRI影像组学联合临床特征的不同机器学习模型对宫颈鳞癌组织学分级的预测价值。方法 回顾性分析经病理活检证实的150例宫颈鳞癌患者,按4∶1的比例随机分为训练集和验证集。从T2加权像脂肪抑制序列(FS-T2WI)和增强T1WI(延迟期)的感兴趣区中提取特征。经过降维和筛选特征后,使用Logistic回归(LR)、支持向量机(SVM)、贝叶斯(NB)、随机森林(RF)、轻量级梯度提升机(LightGBM)、K-最近邻法(KNN)构建预测宫颈鳞癌组织学分级的影像组学模型。采用受试者操作特征(ROC)曲线下面积(AUC)评估6种模型的预测性能。采用单因素及多因素Logistic回归分析预测独立危险因素,并建立临床及影像组学联合模型。通过AUC比较各个模型的差异,决策曲线(DCA)评估模型的临床价值。结果 在影像组学模型中,LightGBM模型AUC下面积最大(训练集为0.910,验证集为0.839)。临床特征联合LightGBM模型的AUC面积最大(训练集0.935,验证集0.888),高于临床模型(AUC训练集为0.762,验证集为0.710)和LightGBM影像组学模型。结论 LightGBM模型在影像组学模型中预测价值较高。联合模型的DCA效果最佳,具有最好的临床净获益。结合影像组学和临床特征的联合预测模型对宫颈鳞癌低分化具有良好的预测价值,可为临床决策提供一种无创、高效的方法。
【关键词】宫颈鳞癌;影像组学;组织学分级;磁共振成像;机器学习
Value of machine learning model based on MRI radiomics in predicting histological grade of cervical squamous cell carcinoma Wang Hezhen, Bian Fang, Tong Yujie, Duan Yanan, Zhai Dongzhi. Department of Medical Imaging, the Second Affiliated Hospital of Zhengzhou University, Zhengzhou 450014, China
Corresponding author, Zhai Dongzhi, E-mail: 963893762@qq.com
【Abstract】Objective To explore the predictive value of different machine learning models based on MRI radiomics combined with clinical features for histological grade of cervical squamous cell carcinoma. Methods Clinical data of 150 patients with cervical squamous cell carcinoma confirmed by pathological biopsy were retrospectively analyzed. They were randomly divided into the training set and validation set at a ratio of 4∶1. Features were extracted from the regions of interest of T2WI fat suppression sequence (FS-T2WI) and enhanced T1WI (delayed phase). After dimensionality reduction and feature selection, logistic regression (LR), support vector machine (SVM), na?ve Bayes (NB), random forest (RF), Light Gradient Boosting Machine (LightGBM), K-nearest neighbor (KNN) were used to construct a radiomics model for predicting the histological grade of cervical squamous cell carcinoma. The area under the receiver operating characteristic (ROC) curve (AUC) was used to evaluate the predictive performance of the six models. Univariate and multivariate logistic regression analyses were performed to predict the independent risk factors, and a combined model of clinical and radiomics was established. The differences of each model were compared by AUC, and the clinical value of the model was evaluated by decision curve (DCA). Results In the radiomics model, the LightGBM model had the largest AUC (0.910 in the training set, and 0.839 in the validation set). The AUC of clinical features combined with LightGBM model was the largest (0.935 in the training set, and 0.888 in the validation set), which was higher than those of clinical model (0.762 in the training set, and 0.710 in the validation set) and LightGBM radiomics model. Conclusions The LightGBM model has a high predictive value in the radiomics model. The combined model has the optimal DCA effect and the highest clinical net benefit. The combined prediction model combining radiomics and clinical features has good predictive value for cervical squamous cell carcinoma with low differentiation, providing a non-invasive and efficient method for clinical decision-making.
【Key words】Cervical cancer; Radiomics; Histological grade; Magnetic resonance imaging; Machine learning
宫颈癌是全球女性第二常见癌症,病死率为60%[1]。在发达国家及地区,由于细胞学筛查计划的广泛实施,其发病率和病死率一直在下降;但是欠发达地区的人乳头瘤病毒(HPV)疫苗接种率和筛查率相差甚远,而且近年来发病年龄趋于年轻化,部分病例在确诊时已为晚期,预后极差[2-3]。
组织学分级影响宫颈癌患者的预后,低分化肿瘤患者的预后与高分化肿瘤患者相差甚远,肿瘤复发率极高[4-5]。针对此类患者,准确判断其分期及组织学分级为患者提供精准治疗,并尽最大可能改善预后极其重要。MRI无辐射,可多序列、多参数成像,具有优异的软组织分辨力,有助于病变的检出、大小和位置的判断;同时检出盆腔、腹膜后区及腹股沟区的淋巴结转移,是宫颈癌的最佳影像学检查方法[6]。影像组学是一项创新技术,具有无创、经济、快捷等优势[7]。在影像图像中定量提取具有高通量可挖掘空间的特征方面开辟了一条道路,可以描绘更微小的肿瘤异质性[8]。这种方法已被广泛研究用于疾病的检测、分期和预后评估[9-12]。机器学习作为新型研究工具,通过计算机基于数据构建概率统计模型并运用模型对数据进行预测与分析,现阶段影像组学与机器学习相结合被广泛应用于医学领域,分析和计算大数据,训练出的模型较传统的Logistic回归模型的结果更为可靠,基于影像组学特征的机器学习模型可以为临床制定较优治疗方案提供有价值的信息[13]。本研究选择不同的机器學习方法进行影像组学模型的开发和验证,并基于MRI影像组学和临床特征联合的模型预测宫颈鳞癌组织学分级,旨在探讨其在临床的应用价值,现报道如下。
对象与方法
一、研究对象
回顾性收集2018年1月至2023年7月就诊于郑州大学第二附属医院的宫颈鳞癌患者临床、影像及病理资料。病例纳入标准:①经病理证实为宫颈鳞癌;②有详细的临床及病理资料;③MRI检查前未接受任何治疗。排除标准:MRI图像质量欠佳的患者。所有病例均由一名10年以上工作经验的放射科医师依据FIGO 2018分期进行临床分期。本研究经医院医学伦理委员会审批(批件号:2023137),所有患者均已签署知情同意书。
二、检查方法
采用Siemens Skyra3.0T或GE Pionner3.0T磁共振仪,配备8通道相控阵线圈完全覆盖患者盆腔。扫描序列和参数:①横断面脂肪抑制T2WI序列:TR 3 150 ms,TE 86 ms,层厚5 mm,间距1 mm,视野260 mm×260 mm,激励次数2次;②横断面增强T1WI序列:TR 3.2 ms,TE 1.2 ms,层厚
3 mm,视野380 mm×380 mm,激励次数1次。对比剂为钆喷酸葡胺(Gd-DTPA),注射流率3 mL/s,用量0.1 mmol/kg,使用生理盐水(20 mL)清洗。
三、图像处理
首先对图像预处理,应用N4磁场校验并进行重采样调整体素为1 mm×1 mm×1 mm。然后将患者的横断位脂肪抑制T2WI、增强T1WI图像以DICOM格式导入ITK-SNAP3.8.0软件。在不知病理结果的情况下,由一位有5年工作经验的放射科医师沿病灶进行逐层勾画(图1)。为了保证影像组学特征的可重复性,2周后随机选取30个病灶重新勾画,计算组内相关系数。由另一位有10年工作经验的放射科医师进行核对,共同确定最终的ROI。
四、特征筛选及模型构建
使用Pyradiomics(Python3.0.1)对每个ROI提取影像组学特征, 包括一阶特征(Firstorder)、直方图灰度共生矩阵(GLCM)、形状特征(Shape)、灰度共生矩阵(GLDM)、邻域灰度差矩阵(NGTDM)、灰度游程长度矩阵(GLRLM)、灰度区域大小矩阵(GLSZM)特征。首先对提取的影像组学特征使用Z-score标准化,通过t检验(P <
0.05)筛选特征。随后使用Pearson相关性分析去除高相关性的相似特征,r > 0.90的特征被认为是高度相关的特征,2个特征保留1个。按照4∶1随机划分训练集与验证集。再在训练集中使用最小绝对收缩和选择算子(LASSO)回归筛选出最具预测性的特征,使用筛选的最佳特征构建影像组学模型。在训练集中使用Logistic回归(LR)、支持向量机(SVM)、贝叶斯(NB)、随机森林(RF)、K-最近邻法(KNN)、轻量级梯度提升机(LightGBM)建立模型,并且使用五倍交叉验证在训练集中评价模型,在验证组中验证。
五、统计学分析
采用SPSS 26.0和Python 3.0.1进行统计分析。正态分布的连续变量以表示,组间比较采用t检验;非正态分布的连续变量以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;分类变量以例(%)表示,有序变量组间比较采用秩和检验,无序变量组间比较采用χ 2检验或Fisher确切概率法。P < 0.05为差异有统计学意义。
通过绘制受试者操作特征(ROC)曲线,计算曲线下面积(AUC)、准确度、灵敏度、特异度、阳性预测值(PPV)、阴性预测值(NPV)、精确率和召回率的调和均值(F1),比较6种模型的诊断性能,筛选出最佳的放射组学模型。对训练集中每例患者的年龄、绝经状态、FIGO分期、肿瘤最大径、淋巴结转移、接触性出血、产次等临床指标进行单因素及多因素Logistic分析筛选宫颈鳞癌组织学分级临床危险因素,建立临床特征模型,然后使用最佳分类器构建临床与影像组学组合模型。对训练集及验证集模型的性能进行评估和验证,绘制ROC曲线,计算AUC、准确度、灵敏度、特异度、PPV、NPV,通过Delong检验比较3个模型AUC的差异。使用决策曲线(DCA)量化训练和验证队列中不同阈值概率的净获益,评估模型的临床效益。
结果
一、研究对象的临床资料
本研究共纳入150例宫颈鳞癌患者,包括中高分化患者82例、低分化患者68例。在训练集与验证集中,低分化与中高分化患者年龄比较差异均有统计学意义(P < 0.05)。见表1。
二、宫颈鳞癌组织学分级的单因素及多因素Logistic回归分析
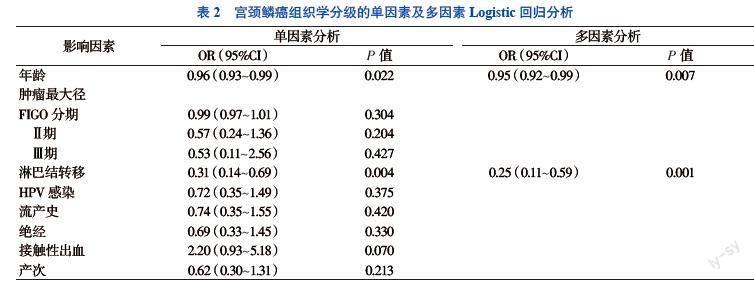
单因素和多因素Logistic回归分析显示,年龄增加及淋巴结转移是宫颈鳞癌组织学分级的危险因素(P < 0.05)。见表2。
三、机器学习模型性能评价
从两个序列的ROI中共提取2 395個特征,经过降维和筛选保留了7个特征分别为wavelet_-HLH_glszm_SmallAreaEmphasis、log_sigma_3_0_-mm_3D_firstorder_Median、original_shape_Sphericity、wavelet_HHH_gldm_DependenceNonUniformityNorma-lized、wavelet_HLH_glcm_Correlation、wavelet_HLL_-glcm_Idn、wavelet_LLH_firstorder_Maximum。训练集和验证集中的6个影像组学模型(LR、NB、SVM、KNN、RF、LightGBM)的ROC曲线见图2。在训练集中最佳模型是RF,AUC为1.000,然而在验证集中,最佳的模型是LightGBM。LightGBM模型的AUC、准确度、灵敏度、特异度、PPV、NPV和F1分别为0.839、0.833、0.938、0.714、0.789、0.909、0.857,见表3。RF模型虽然在训练集体现出良好的预测价值,但在验证集上欠佳,显示出过拟合的趋势。为了保证模型的稳定性和持续性,最终选择LightGBM模型为最佳模型。
四、模型构建与验证
将临床预测因素(年龄及淋巴结转移)和7个影像组学特征结合建立联合模型。使用LightGBM建立临床模型、影像组学模型及二者联合模型。三种模型在训练集和验证集的ROC曲线见图3。联合模型的效能明显优于临床和影像组学模型,AUC较高(训练集0.935,验证集0.888),见表3。3种模型的DCA见图4,联合模型在训练集和验证集中具有最显著的净获益。
讨论
在探讨影像组学在宫颈癌病理预测中的价值时,许多学者已进行了深入研究。Wang等[14]研究显示,宫颈腺癌纹理异质性高于宫颈鳞癌,多序列MRI图像构建的联合模型鉴别宫颈鳞癌与腺癌的 AUC为0.89,高于各单独序列模型。谢元亮等[15]报道,基于动态增强MRI的纹理分析技术有助于在术前预测宫颈癌的组织病理学分型和临床分级。近年来,影像组学为预测组织学分级提供新的方法。Wang等[16]认为,T2WI模型可以更好鉴别宫颈鳞癌的高低分化。尹进学等[17]发现,基于T2WI的3D纹理特征术前预测宫颈癌病理组织学分级具有一定价值。Shi等[18]构建的T2WI和体素不相干运动弥散加权成像联合模型,在评估组织分化方面性能优于单独序列。Liu等[19]基于表观扩散系数的影像组学特征评估宫颈癌的组织病理分级,结果显示三维全肿瘤体积分析在区分宫颈癌的组织学分级方面优于二维肿瘤切片。孟影等[20]联合MRI影像组学评分和临床模型构建的列线图,能较好预测宫颈癌组织学分级。早期准确识别宫颈癌组织分级,对治疗及预后至关重要[21]。既往研究多是使用一种机器学习建模,而本研究构建了6种机器学习模型。
宫颈癌在动态增强延迟期易与周围正常组织区分,呈相对弱强化,因此本研究采用延迟期图像进行病灶分割[22]。机器学习可以提供更准确、客观、可靠的模型来辅助临床决策[23]。解添淞等[7]基于CT影像组学预测胰腺癌 CD8+T淋巴细胞浸润状态,使用决策树、极端随机树、RF 3种机器学习算法建立模型,显示极端随机树模型效能最佳(AUC训练集0.865,验证集0.744)。Zhang等[24]发现,RF模型能够准确预测转移性结直肠癌的早期死亡,优于Logistic回归、CatBoost、XGBoost和LightGBM模型,RF模型比其他模型具有更多的临床效益。影像组学模型的预测性能对于疾病诊断和治疗方案制定至关重要,而这种良好的预测性能在很大程度上取决于适当的机器学习算法。
本研究中,联合模型表现出最佳的诊断性能(AUC训练集0.935,验证集0.888),其次是SVM、RF、KNN、NB、临床模型、LR模型。单一的影像组学模型可能无法充分考虑到患者个体差异以及其他临床因素对于肿瘤发展的影响。因此,将临床特征与肿瘤影像组学模型相结合,可以提供更全面、准确的诊断信息。RF是一种基于集成多棵决策树的算法,在很多数据集上准确率较高[25]。但在处理小样本时可能存在过拟合问题。考虑到放射表型和基因型数据之间关系的复杂性和非线性,SVM是解决非线性问题的有效和稳健的方法,具有良好的稳定性和效率[26]。NB是一种基于概率论的分类算法,它可以增加特异度[27]。KNN是用距离最近的k个点来判断属于哪个类别,样本不平衡时准确率低[28]。LightGBM算法建立在决策树算法上,利用提升树的估计量,提供了梯度增强算法的有效实现,主要优点是训练算法的明显加速,产生更有效的模型[29-30]。Rufo等[31]使用LightGBM建立糖尿病的诊断模型,该模型的准确度、AUC、灵敏度和特异度分别为0.981、0.981、0.999、0.963,优于KNN、SVM、NB、Bagging、RF和XGBoost模型。Shao等[32]基于CT增强使用LightGBM算法建立模型,有助于鉴别静脉平滑肌瘤病和子宫平滑肌瘤。本研究表明,LightGBM、SVM和RF模型比LR模型诊断效能更优,推测宫颈癌可能是非线性或线性不可分的,因此使用线性算法的LR模型比非线性LightGBM、RF和SVM的效能低。
总之,本研究利用机器学习技术构建并验证临床和MRI影像组学的联合模型,可有效预测宫颈癌组织学分级,其中采用LightGBM算法的联合模型在评估宫颈鳞癌组织学分级方面具有较高的预测价值,对临床诊断具有积极意义。但本研究是回顾性研究,未进行外部验证且样本量较少,可能过拟合,日后有待扩大样本量、进行多中心及多模态研究进一步验证研究结论。
参 考 文 献
[1] Park Y R, Kim Y J, Ju W, et al. Comparison of machine and deep learning for the classification of cervical cancer based on cervicography images[J]. Sci Rep, 2021, 11(1): 16143.
[2] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[3] Buskwofie A, David-West G, Clare C A. A review of cervical cancer: incidence and disparities[J]. J Natl Med Assoc, 2020, 112(2): 229-232.
[4] Matsuo K, Mandelbaum R S, Machida H, et al. Association of tumor differentiation grade and survival of women with squamous cell carcinoma of the uterine cervix[J]. J Gynecol Oncol, 2018, 29(6): e91.
[5] Rigaud B, Simon A, Gobeli M, et al. Statistical shape model to generate a planning library for cervical adaptive radiotherapy[J]. IEEE Trans Med Imaging, 2019, 38(2): 406-416.
[6] Wang D, Yin H, Liu W, et al. Comparative analysis of the diagnostic values of T2 mapping and diffusion-weighted imaging for sacroiliitis in ankylosing spondylitis[J]. Skeletal Radiol, 2020, 49(10): 1597-1606.
[7] 解添淞, 翁微微, 劉伟, 等. 基于CT图像影像组学的机器学习模型预测胰腺癌免疫细胞浸润及预后的初步研究[J]. 中华放射学杂志, 2022, 56(4): 425-430.
Xie T S, Weng W W, Liu W, et al. A polit study of using CT-radiomics based machine learning model in predicting immune cells infiltrating and prognosis of pancreatic cancer[J]. Chin J Radiol, 2022, 56(4): 425-430.
[8] Fiset S, Welch M L, Weiss J, et al. Repeatability and reproducibility of MRI-based radiomic features in cervical cancer[J]. Radiother Oncol, 2019, 135: 107-114.
[9] Li Y, Cheng Z, Gevaert O, et al. A CT-based radiomics nomogram for prediction of human epidermal growth factor receptor 2 status in patients with gastric cancer[J]. Chung Kuo Yen Cheng Yen Chiu, 2020, 32(1): 62-71.
[10] Shin J, Lim J S, Huh Y M, et al. A radiomics-based model for predicting prognosis of locally advanced gastric cancer in the preoperative setting[J]. Sci Rep, 2021, 11(1): 1879.
[11] Feng B, Huang L, Li C, et al. A heterogeneity radiomic nomogram for preoperative differentiation of primary gastric lymphoma from borrmann type IV gastric cancer[J]. J Comput Assist Tomogr, 2021, 45(2): 191-202.
[12] 程木华. PET代谢影像组学研究进展与挑战[J]. 新医学, 2018, 49(9): 619-623.
Cheng M H. Research advances and challenges of PET metabolic radiomics[J]. J New Med, 2018, 49(9): 619-623.
[13] 刘进, 印宏坤, 陈果, 等. MRI组学特征构建机器学习模型预测胸腰段再骨折[J]. 中国组织工程研究, 2022, 26(33): 5323-5328.
Liu J, Yin H K, Chen G, et al. A machine learning prediction model based on MRI radiomics for refracture of thoracolumbar segments[J]. Chin J Tissue Eng Res, 2022, 26(33): 5323-5328.
[14] Wang W, Jiao Y, Zhang L, et al. Multiparametric MRI-based radiomics analysis: differentiation of subtypes of cervical cancer in the early stage[J]. Acta Radiol, 2022, 63(6): 847-856.
[15] 谢元亮, 杜丹, 谢伟, 等. DCE-MRI纹理分析鉴别宫颈鳞癌与腺癌及预测分级的价值[J]. 放射学实践, 2019, 34(8): 835-840.
Xie Y L, Du D, Xie W, et al. The value of texture analysis based on dynamic contrast-enhanced MRI for differentiating cervical adenocarcinoma from squamous cell carcinoma and its prediction of stages[J]. Radiol Pract, 2019, 34(8): 835-840.
[16] Wang S, Jiang T, Hu X, et al. Can the combination of DWI and T2WI radiomics improve the diagnostic efficiency of cervical squamous cell carcinoma?[J]. Magn Reson Imaging, 2022, 92: 197-202.
[17] 尹進学, 卢斌贵, 杨佩瑜, 等. 基于T2WI 3D纹理分析评估宫颈癌组织学分级[J]. 中国医学影像技术, 2021, 37(1): 86-90.
Yin J X, Lu B G, Yang P Y, et al. Three-dimensional texture analysis based on T2WI for evaluation on histological grade of cervical cancer[J]. Chin J Med Imag Technol, 2021, 37(1): 86-90.
[18] Shi B, Dong J N, Zhang L X, et al. A combination analysis of IVIM-DWI biomarkers and T2WI-based texture features for tumor differentiation grade of cervical squamous cell carcinoma[J]. Contrast Media Mol Imaging, 2022, 2022: 2837905.
[19] Liu Y, Zhang Y, Cheng R, et al. Radiomics analysis of apparent diffusion coefficient in cervical cancer: a preliminary study on histological grade evaluation[J]. J Magn Reson Imaging, 2019, 49(1): 280-290.
[20] 孟影, 刘信信, 张志雅, 等. 基于MRI影像组学列线图在宫颈鳞癌组织学分级中的预测研究[J]. 临床放射学杂志, 2023, 42(4): 677-682.
Meng Y, Liu X X, Zhang Z Y, et al. Prediction of histological grading of cervical squamous cell carcinoma based on MRI histograms[J]. J Clin Radiol, 2023, 42(4): 677-682.
[21] Mongula J E, Bakers F C H, Mihl C, et al. Assessment of parametrial invasion of cervical carcinoma, the role of T2-weighted MRI and diffusion weighted imaging with or without fusion[J]. Clin Radiol, 2019, 74(10): 790-796.
[22] 佟晶, 卑贵光, 阚杨杨, 等. 多序列MRI影像组学预测局部晚期宫颈鳞癌同步放化疗早期治疗反应的价值[J]. 中华放射学杂志, 2022, 56(11): 1223-1229.
Tong J, Bei G G, Kan Y Y, et al. The value of multi-sequence MRI radiomics in predicting the early response to concurrent chemoradiotherapy for locally advanced cervical squamous cell carcinoma[J]. Chin J Radiol, 2022, 56(11): 1223-1229.
[23] Zhu Y, Yang L, Shen H. Value of the application of CE-MRI radiomics and machine learning in preoperative prediction of sentinel lymph node metastasis in breast cancer[J]. Front Oncol, 2021, 11: 757111.
[24] Zhang Y, Zhang Z, Wei L, et al. Construction and validation of nomograms combined with novel machine learning algorithms to predict early death of patients with metastatic colorectal cancer[J]. Front Public Health, 2022, 10: 1008137.
[25] Sarica A, Cerasa A, Quattrone A. Random forest algorithm for the classification of neuroimaging data in Alzheimers disease: a systematic review[J]. Front Aging Neurosci, 2017, 9: 329.
[26] Erickson B J, Korfiatis P, Akkus Z, et al. Machine learning for medical imaging[J]. Radiographics, 2017, 37(2): 505-515.
[27] Uddin S, Khan A, Hossain M E, et al. Comparing different supervised machine learning algorithms for disease prediction[J]. BMC Med Inform Decis Mak, 2019, 19(1): 281.
[28] Lin Q, Wu H J, Song Q S, et al. CT-based radiomics in predicting pathological response in non-small cell lung cancer patients receiving neoadjuvant immunotherapy[J]. Front Oncol, 2022, 12: 937277.
[29] Ke G, Meng Q, Finley T, et al. LightGBM: a highly efficient gradient boosting decision tree[M]. New York: Curran Associates Inc, 2017.
[30] Basha S, Rajput D, Vandhan V. Impact of gradient ascent and boosting algorithm in classification[J]. Int J Intell Eng Syst, 2018, 11(1): 41-49.
[31] Rufo D D, Debelee T G, Ibenthal A, et al. Diagnosis of diabetes mellitus using gradient boosting machine (LightGBM)[J]. Diagnostics, 2021, 11(9): 1714.
[32] Shao J, Wang C, Shu K, et al. A contrast-enhanced CT-based radiomic nomogram for the differential diagnosis of intravenous leiomyomatosis and uterine leiomyoma[J]. Front Oncol, 2023, 13: 1239124.
(收稿日期:2023-10-27)
(本文編辑:林燕薇)
