贝莱斯芽孢杆菌F85拮抗烟草炭疽菌的转录组学分析
2024-03-26刘涵斐李锡宏徐婷婷许汝冰郑露黄俊斌黎妍妍
刘涵斐,李锡宏,徐婷婷,许汝冰,郑露,黄俊斌,黎妍妍*
植物保护
贝莱斯芽孢杆菌F85拮抗烟草炭疽菌的转录组学分析
刘涵斐1,李锡宏2,徐婷婷1,许汝冰2,郑露1,黄俊斌1,黎妍妍2*
1 华中农业大学植物科技学院,湖北省作物病害监测和安全控制重点实验室,湖北省武汉市狮子山街特1号 430207;2 湖北省烟草科学研究院,湖北省武汉市硚口区宝丰路6号 430030
【目的】为探索烟草炭疽菌响应贝莱斯芽孢杆菌()F85拮抗的分子机制。【方法】以引起烟草炭疽病的为研究对象,设置经F85无菌发酵液处理后的菌株(T)和正常生长的菌株(CK),利用转录组测序探究贝莱斯芽孢杆菌拮抗条件下烟草炭疽菌菌丝的差异表达基因(Differential Expressed Genes, DEGs)和代谢通路富集情况。【结果】无菌发酵液处理的菌株(T)与对照(CK)相比,共有2870个DEGs,其中1524个基因上调表达,1346个基因下调表达。KEGG富集分析结果表明,DEGs主要富集在苯丙氨酸代谢(Phenylalanine metabolism)、缬氨酸、亮氨酸和异亮氨酸降解(Valine, leucine and isoleucine degradation)等通路上,编码过氧化物酶体(KatGs)、醛脱氢酶(ALDH)、甲基丙二酸半醛脱氢酶(MoMsdh)等的基因显著下调表达。【结论】在贝莱斯芽孢杆菌F85拮抗下,烟草炭疽菌菌丝转录组特征发生显著变化,F85主要影响菌丝过氧化物酶体调控以及菌丝能量形成过程等。
贝莱斯芽孢杆菌;烟草炭疽菌;转录组分析;生物防治
芽胞杆菌()是目前用于生物防治的主要微生物之一,其生长繁殖迅速,可以有效定殖在植物根际,其中,贝莱斯芽孢杆菌()因其广谱高效的抑菌特性而备受关注[1]。据报道,贝莱斯芽孢杆菌可分泌几丁质酶和葡聚糖酶等抗菌物质,降解病原菌细胞壁,使病原菌失去活性[2];产生surfactin、fengycin和iturin等脂肽类抗生素,其中surfactin的分泌产物有助于生防细菌更好地在植物上定殖,fengycin和iturin可抑制病原真菌菌丝的生长,脂肽类抗生素相关基因、、、等在抗病机理中具有重要作用[3];产生由非核糖体多肽合成酶(NRPS)和聚酮化合物(PKS)直接合成的抗病相关基因簇[4]。除直接作用于病原菌外,贝莱斯芽孢杆菌可诱导植物体内过氧化氢积累和胼胝质生成,启动植物自身的防御系统来提高植物抗病性[5];还可分泌嗜铁素、吲哚-3-乙酸等物质促进植物生长[1, 6]。目前,贝莱斯芽孢杆菌已广泛用于烟草病害(如青枯病[7]、赤星病[8]、靶斑 病[9]等)的防治中。
植物炭疽病由炭疽菌属真菌侵染引起。炭疽菌属共有14个复合种,每个复合种又包含不同的炭疽菌种[10]。在我国,已鉴定出引起烟草炭疽病的病原主要包括C. destructivum复合种中的[11]、C. gloeosporioides复合种中的和[12-13]、C. orbiculare复合种中的[14]、C.boninense复合种中的[15],不同的复合种在菌落特征、分生孢子和附着胞形态特征、大小等方面存在明显差异[10]。在这几种炭疽菌中,不仅是引起烟草炭疽病的主要病原[13],还可引起杧果[16]、橡胶树[17]、苹果[18]、草莓[19]等多种作物炭疽病。因此,关于的防控应引起足够重视。
前人研究结果表明[20-24],贝莱斯芽孢杆菌X10-03、SM905、HN-2、JK3、CE100等菌株对草莓、芒果、铁皮石斛等作物炭疽病菌具有较好的抑菌活性,而关于炭疽病菌如何响应或应答贝莱斯芽孢杆菌的机制并不清楚。本研究以和作为生防微生物和植物病原微生物互作系统,采用转录组测序技术比较分析菌株和经发酵液处理后菌株的基因表达特征,在转录组水平上揭示响应拮抗的分子机制,旨在为贝莱斯芽孢杆菌作为烟草炭疽病生防菌的开发奠定理论基础。
1 材料与方法
1.1 供试菌株
贝莱斯芽孢杆菌()菌株F85由华中农业大学植物真菌病害研究室保藏。炭疽菌()菌株BB001ES11分离自恩施州宣恩县凉风村烟草(云烟87)叶片。
1.2 炭疽菌的鉴定
按照相关文献中的方法[25]进行BB001ES11菌株的形态学鉴定和多基因分子鉴定。PDA培养基(马铃薯200 g、葡萄糖20 g、琼脂15~20 g、纯水定容至 1 L)中培养后,观察菌落形态并测量菌落直径,光学显微镜下观察产孢表型及分生孢子、附着胞的形态和大小;提取菌丝DNA后,基于多基因序列各引物[25]进行PCR扩增,PCR反应体系和反应程序见文献[25],测序完成后在MEGA11.0中采用邻近法(Neighbor Joining,NJ)构建BB001ES11菌株序列与参考菌株基因序列的系统发育树,自举法检测1000次。
打取在PDA平板上培养5~7 d的菌落边缘的菌丝块,采用微伤接种(划伤叶片但不穿破叶片)方式接种云烟87叶片。置于28℃恒温箱中培养,黑暗条件下培养5 d,观察叶片发病情况。
1.3 贝莱斯芽孢杆菌-炭疽菌共培养与样品制备
将活化后的F85菌株的菌液按0.5%(V/V)的比例接种于200 mL液体LB培养基(胰蛋白胨10 g、酵母提取物5 g、氯化钠5 g、纯水定容至1 L)中,在37℃、180 r/min的条件下培养48 h。将摇培后的发酵液于8000 r/min离心15 min,上清液用细菌过滤器过滤即获得F85菌株的无菌发酵滤液。将该无菌发酵滤液加至PDB培养基(马铃薯200 g、葡萄糖20 g、纯水定容至1 L)中,使其终浓度为5%,打取直径为5 mm的烟草炭疽菌菌丝块接种于PDB培养液中,标记为处理组(T);以不加F85无菌发酵滤液的处理作为对照,标记为对照组(CK)。28℃、180 r/min条件下摇培5 d后抽滤菌丝,用液氮冷冻菌丝后于-80℃冰箱中保存备用。每个处理重复3个样本。
1.4 总RNA提取、文库构建和Illumina测序
采用Trizol试剂盒(Invitrogen, Burlington, ON, Canada)提取样品总RNA,采用琼脂糖凝胶电泳分析样品RNA完整性及是否存在DNA污染;用NanoPhotometer spectrophotometer检测RNA纯度(OD260/280及OD260/230比值);用Agilent 2100 bioanalyzer检测RNA完整性。
使用Illumina的NEBNext®UltraTMRNA Library Prep Kit试剂盒进行建库,库检合格后,在Illumina Novaseq 6000平台上进行测序(北京诺禾致源科技股份有限公司),产生150 bp配对末端读数。
为保证数据分析的质量及可靠性,使用fastp(version 0.19.7)软件对原始数据(Raw reads)进行过滤,去除带接头(adapter)的reads、含N的reads、低质量reads(Qphred≤20的碱基数占整个read长度的50%以上的reads),得到Clean reads。同时,计算Clean reads的Q20、Q30和GC含量。
1.5 差异表达基因(DEGs)筛选
从NCBI网站(https://www.ncbi.nlm.nih.gov/)下载参考基因组和基因模型注释文件[26];使用HISAT2 v2.0.5构建参考基因组的索引,并将配对末端Clean reads与参考基因组比对。
使用DESeq2软件(1.16.1)分别进行处理组(T)和对照组(CK)之间的差异表达分析。以校正后的值(-adj < 0.05)以及|log2Fold change| >1(Fold change为T的表达量/CK的表达量)作为基因显著差异表达的阈值。
预算评价是指采用科学方法对预算管理及运行情况进行的定性和定量分析与评估。预算评价是加强预算管理、优化资源配置、提高财政资金使用效益的有效措施。预算评价信息系统不仅是预算管理子系统的集合,更重要的是可以进行信息的收集、处理、存储和分发,以支持一个组织的决策制定和控制,预算评价信息系统还可以成为问题分析和创造新产品的工具。从技术的视角看,预算评价信息系统将原始数据进行输入、处理和输出,通过收集、储存、转换、分发可以支持组织的决策、通信、协调、控制、分析和设想。作为一个基于信息技术的组织和管理解决方案是应对环境赋予的挑战的有效工具,可以提高组织绩效,最终提升财政效率。
1.6 GO分类注释和KEGG注释富集分析
采用R软件clusterProfiler包对差异表达基因进行GO富集分析,以-adj<0.05作为显著性富集的阈值。将差异表达基因提交至KEGG数据库(https://www. kegg.jp/)中进行注释,获得KEGG富集分析结果,以-adj<0.05作为显著性富集的阈值。
1.7 实时荧光定量PCR(qRT-PCR)验证
为验证转录组测序结果的准确性,以作为内参基因,随机选取8个差异表达基因进行qRT-PCR验证。使用反转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix,北京全式金公司)进行cDNA合成,具体步骤参照说明书。qRT-PCR涉及的引物序列见表1。qRT-PCR反应体系为cDNA模板1 μL、正反向引物(10 μmol/L)各0.4 μL,2× SuperMix 10 μL,补足ddH2O至20 μL。反应程序在CFX96™ Real Time PCR system上进行。反应条件:95℃,30 s;95℃,5 s;60℃,30 s重复40个循环;65~95℃,每个循环上升0.5℃,持续5 s。待扩增结束后,使用2−ΔΔCT方法计算基因的相对表达量[27]。每个样品3次生物学重复。

表1 qRT-PCR引物序列信息
2 结果与分析
2.1 炭疽菌的鉴定
对分离自烟草叶片上的BB001ES11菌株的生长特性、分生孢子和附着胞进行了形态学鉴定(图1 A~D)。在28℃、PDA培养基上培养7 d后,BB001ES11的菌落凸起且边缘完整,气生菌丝较浓密,絮状,呈现同心环纹,正面中央浅灰色,且由中央向边缘颜色递减,边缘白色;背面中央深墨绿色,边缘白色;菌落平均直径7.7 cm。分生孢子透明,无隔膜,圆柱状,两端钝圆,大小17.8~18.0 μm × 6.5~6.8 μm;附着胞光滑,黑色,近球形或者椭圆形,大小6.8~7.0 μm × 9.1~9.3 μm。按照Sutton[28]和Cai等[29]的分类标准,BB001ES11菌株属于复合种。

注:菌株BB001ES11:正面和背面菌落(B, A)、分生孢子(C)、附着胞(D),标尺=20 μm;致病性测定(E)。
Note: Strain BB001ES11: front and back colony (B, A), conidia (C) and appressoria (D), Bar=20 μm; pathogenicity test (E).
图1 BB001ES11菌株的形态学鉴定和致病性测定
Fig. 1 Morphological identification and pathogenicity test of the BB001ES11 strain
对于形态学上鉴定为复合种的BB001ES11菌株,分别扩增、、、、和ITS序列,以(CBS123755)作为外群(outgroup),进行多基因系统发育分析。结果表明,BB001ES11菌株与3株模式菌株(CBS125397、ICMP18581、ICMP18727)聚在一起;而与同属复合种的(ICMP12567、ICMP18121)、(ICMP17816)相距较远(图2)。

图2 基于ACT、CHS-1、CAL、TUB2、GAPDH和ITS序列的BB001ES11菌株的系统发育树
将BB001ES11菌株接种云烟87叶片,进行了致病性试验(图1 E)。结果表明BB001ES11可引起健康烟草叶片产生褐色病斑,病斑大小(长×宽)为20 mm2,在叶背面观察到明显穿孔症状。按照柯赫氏法则,将上述发病烟草叶片进行组织分离、病原菌纯化,鉴定其病原菌为,与最初接种的病原菌相同。
2.2 RNA-Seq数据质量统计与分析
对原始数据过滤后,获得超过40 M的Clean reads数据,Clean reads数据占Raw reads的比例在94%以上,Q20和Q30的比例分别在97%和92%以上,表明RNA-seq的测序结果质量较好,可用作分析(表2)。
将RNA-seq的Clean reads数据与参考基因组进行比对,对照组(CK)和处理组(T)比对到参考基因组的读长(Total map)占比分别为91.99%~96.91%和97.03%~97.16%,比对到参考基因组唯一分布的读长(Unique map)占比分别为91.80%~96.68%和96.82%~96.96%,表明转录组测序结果较好(表1)。对同组样品间的相关性进行分析,发现各组内样品间的2(皮尔逊相关系数的平方)均大于0.8,表明处理组(T)和对照组(CK)组内具有较高的重复性(图3)。
表2 测序数据质量统计
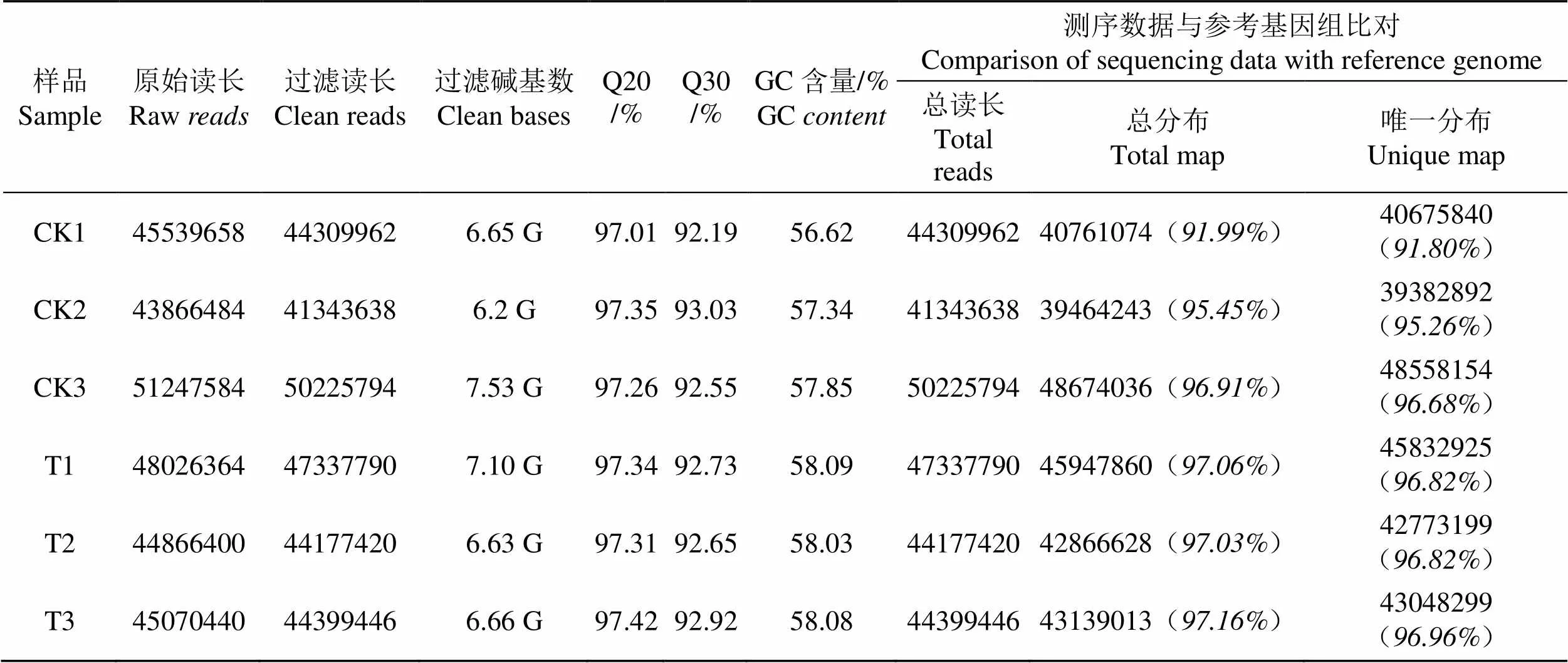
Tab.2 Statistics of sequencing data quality
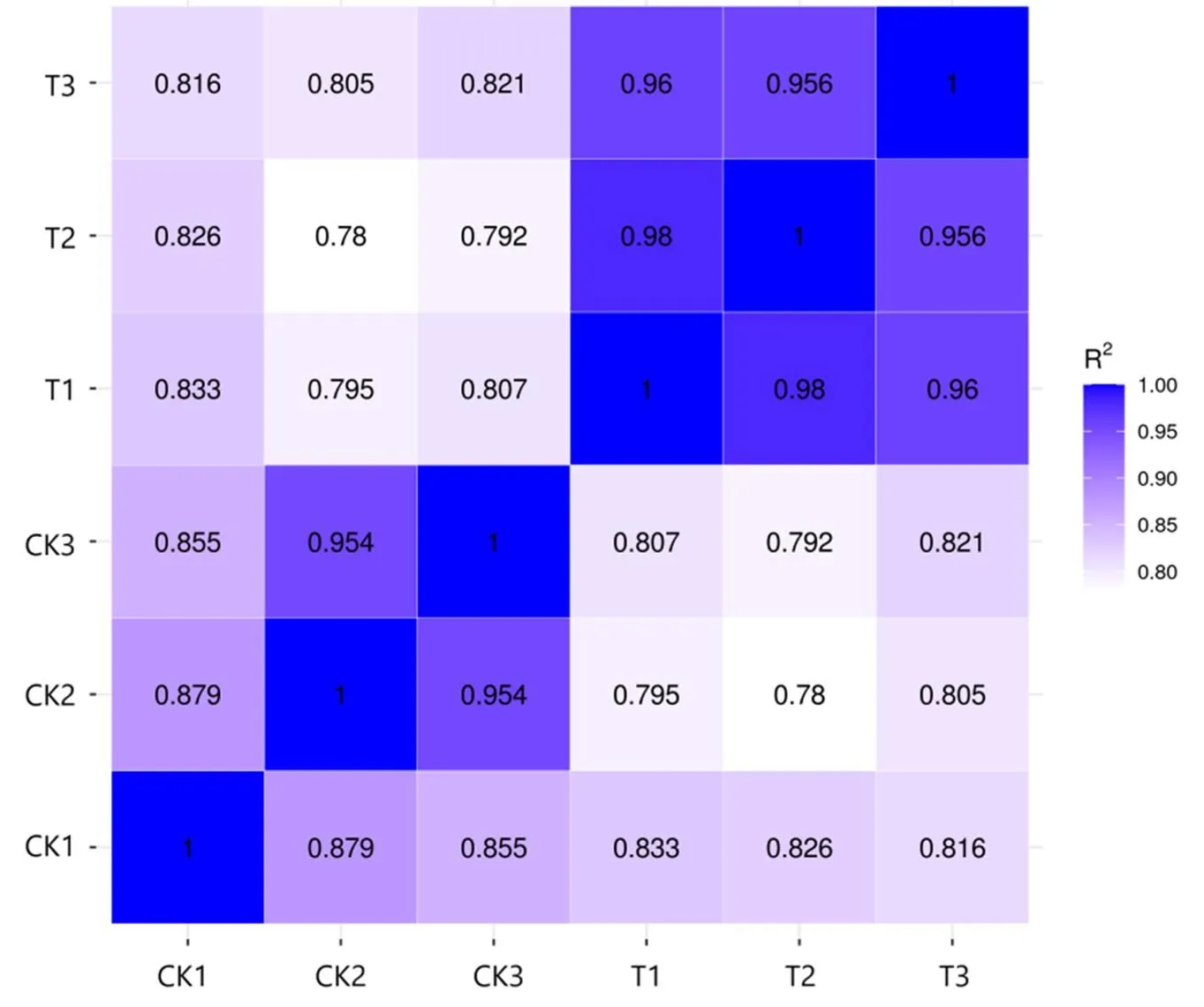
图3 样本间相关性分析
2.3 qRT-PCR验证
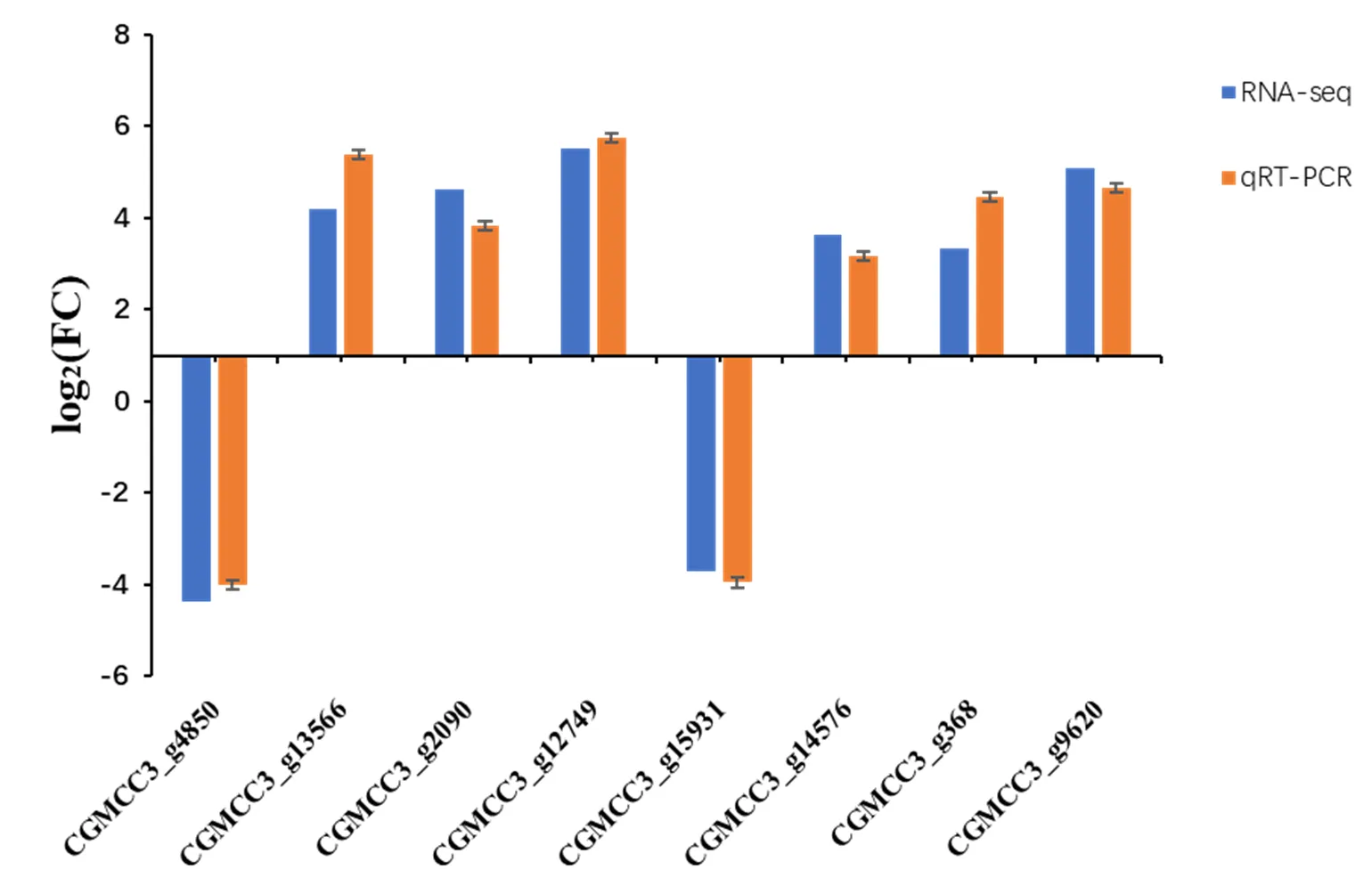
图4 RNA-seq和qRT-PCR基因表达结果比较
2.4 差异表达基因分析
对处理组(T)和对照组(CK)进行了差异表达基因(DEGs)筛选。结果表明(图5 A),与CK对比,处理组(T)共有2870个DEGs,其中1524个基因上调表达,1346个基因下调表达。聚类热图分析表明,处理组(T)和对照组(CK)的基因表达谱具有显著差异(图5 B)。

注:log2Fold Change中Fold change表示处理组(T)的表达量/对照组(CK)的表达量。表3、表4同。
Note: Fold change in log2Fold Change represents the expression level of treatment group (T)/ the expression level of control group (CK). The same for table 3 and table 4.
图5 火山图(A)和热图(B)分析经F85无菌发酵液处理后的差异表达基因
Fig.5 Volcano map (A) and heat map (B) of differential expressed genes oftreated with F85 sterile fermentation filtrate
2.5 差异表达基因功能富集分析
2.5.1 GO富集分析
对差异表达基因(DEGs)进行了GO功能富集分析(前30个条目),结果表明(图6),在分子功能(Molecular function)中,DEGs主要富集在辅酶结合(coenzyme binding)、转录调节活性(transcription regulator activity)等条目上;在生物学进程(Biological process)中,DEGs主要富集在细胞生物合成过程调控(regulation of cellular biosynthetic process)、生物合成过程调控(regulation of biosynthetic process)、高分子生物合成过程调控(regulation of macromolecule biosynthetic process)等条目上;富集到细胞组成(Cellular component)各条目中的DEGs数量较少。
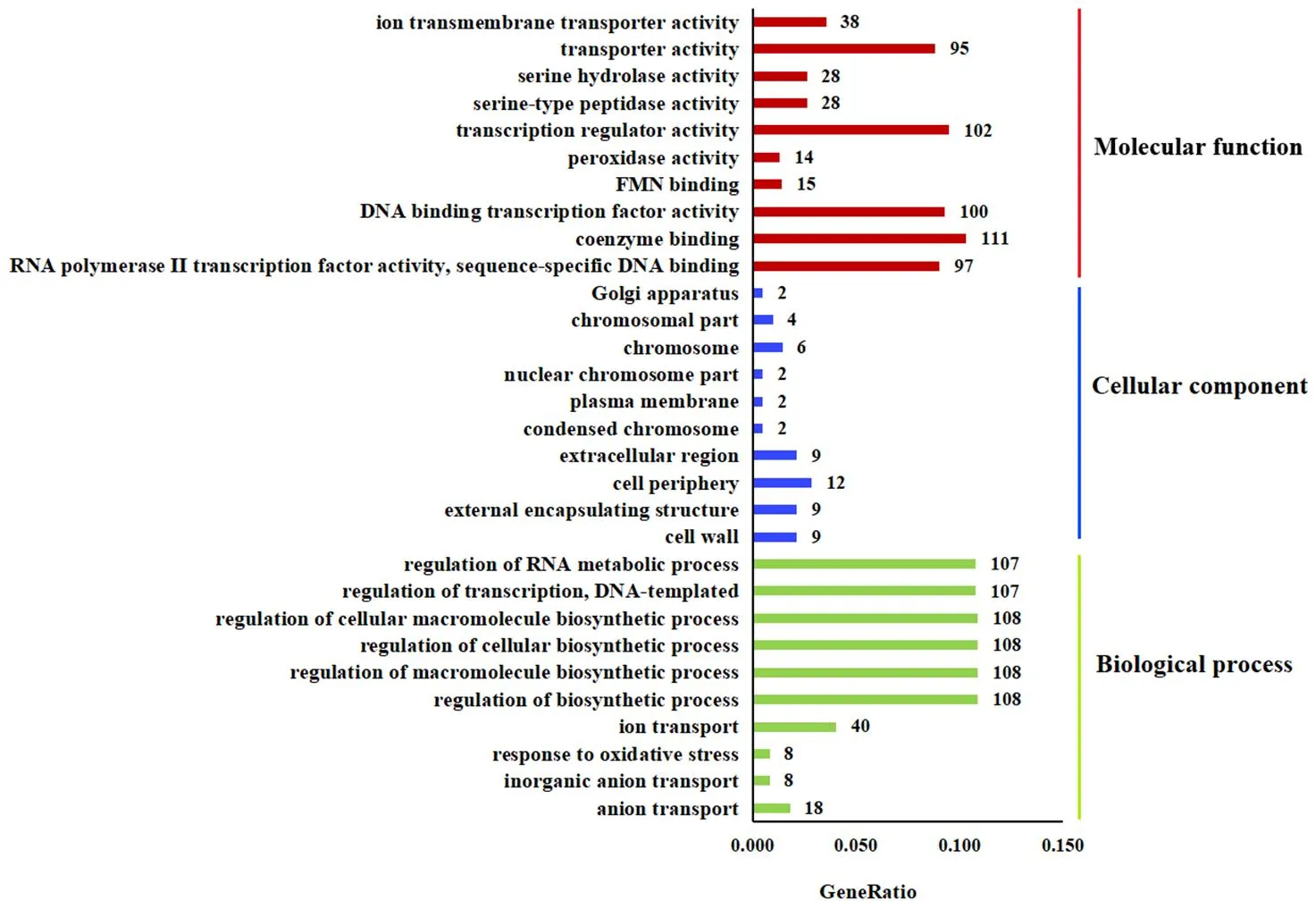
注:横轴表示注释到GO条目上的差异基因数与差异基因总数的比值,纵轴表示富集的GO条目。数字表示富集到该GO条目的基因数目。
Note: The horizontal axis represents the ratio of the number of DEGs annotated to this GO term to the total number of DGEs, and the vertical axis represents the enriched GO terms. The number represents the number of DEGs enriched to this GO term.
图6经F85无菌发酵滤液处理后差异表达基因的GO富集分析
Fig.6 GO enrichment analysis of the differential expressed genes oftreated with F85 sterile fermentation filtrate
2.5.2 KEGG富集分析
对差异表达基因(DEGs)进行了KEGG富集分析(前20个通路),结果表明(图5),DEGs主要富集在苯丙氨酸代谢(Phenylalanine metabolism,=0.0001),β-丙氨酸代谢(beta-Alanine metabolism,=0.0038),缬氨酸、亮氨酸和异亮氨酸降解(Valine, leucine and isoleucine degradation,=0.0038),甘氨酸、丝氨酸和苏氨酸代谢(Glycine, serine and threonine metabolism,=0.0045)等通路上。
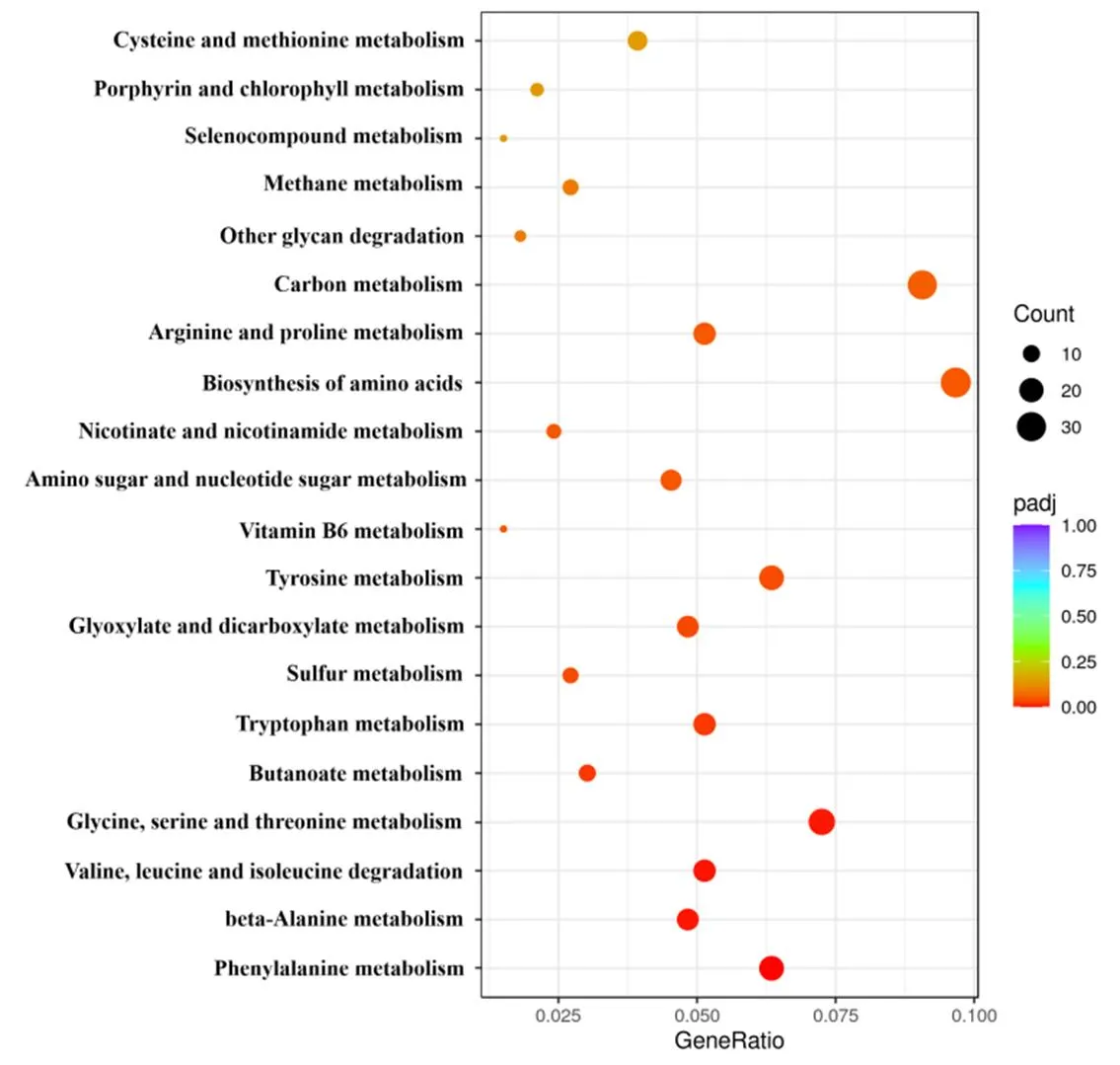
注:横轴表示注释到KEGG通路编号上的差异基因数与差异基因总数的比值,纵轴表示富集的KEGG通路。圆点从蓝色到红色表示-adj值从大到小,圆点的大小表示注释到该通路的基因数目。
Note: The horizontal axis represents the ratio of the number of DEGs annotated to this KEGG pathway to the total number of DEGs, and the vertical axis represents the enriched KEGG pathways. The dots from blue to red indicate the-adj value from large to small, and the size of the dots indicates the number of DEGs annotated to this KEGG pathway.
图7经F85无菌发酵滤液处理后差异表达基因的KEGG富集分析
Fig.7 KEGG enrichment analysis of the differential expressed genes oftreated with F85 sterile fermentation filtrate
2.6 烟草炭疽菌响应贝莱斯芽孢杆菌拮抗的关键通路及基因分析
2.6.1 苯丙氨酸代谢通路
与对照(CK)相比,经贝莱斯芽孢杆菌无菌发酵液处理后的烟草炭疽菌()(T)的苯丙氨酸代谢通路中共有21个差异表达基因(表3)。5个上调基因主要编码芳香族-L-胺基酸脱羧酶(Aromatic- L-amino-acid decarboxylase)、酰胺酶(Amidase)等,上调倍数为1.21~5.32倍;16个下调基因主要编码过氧化物酶体伯胺氧化酶(Peroxisomal primary amine oxidase)、过氧化氢酶-过氧化物酶(Catalase- peroxidase)、醛脱氢酶(Aldehyde dehydrogenase)、乙酸苯酯 2-羟化酶(Phenylacetate 2-hydroxylase)等,下调倍数为1.20~7.84倍。
表3 烟草炭疽菌KEGG富集中苯丙氨酸代谢通路中相关的差异表达基因

Tab.3 Related differentially expressed genes in phenylalanine metabolic pathways in KEGG enrichment of C. fructicola
续表3
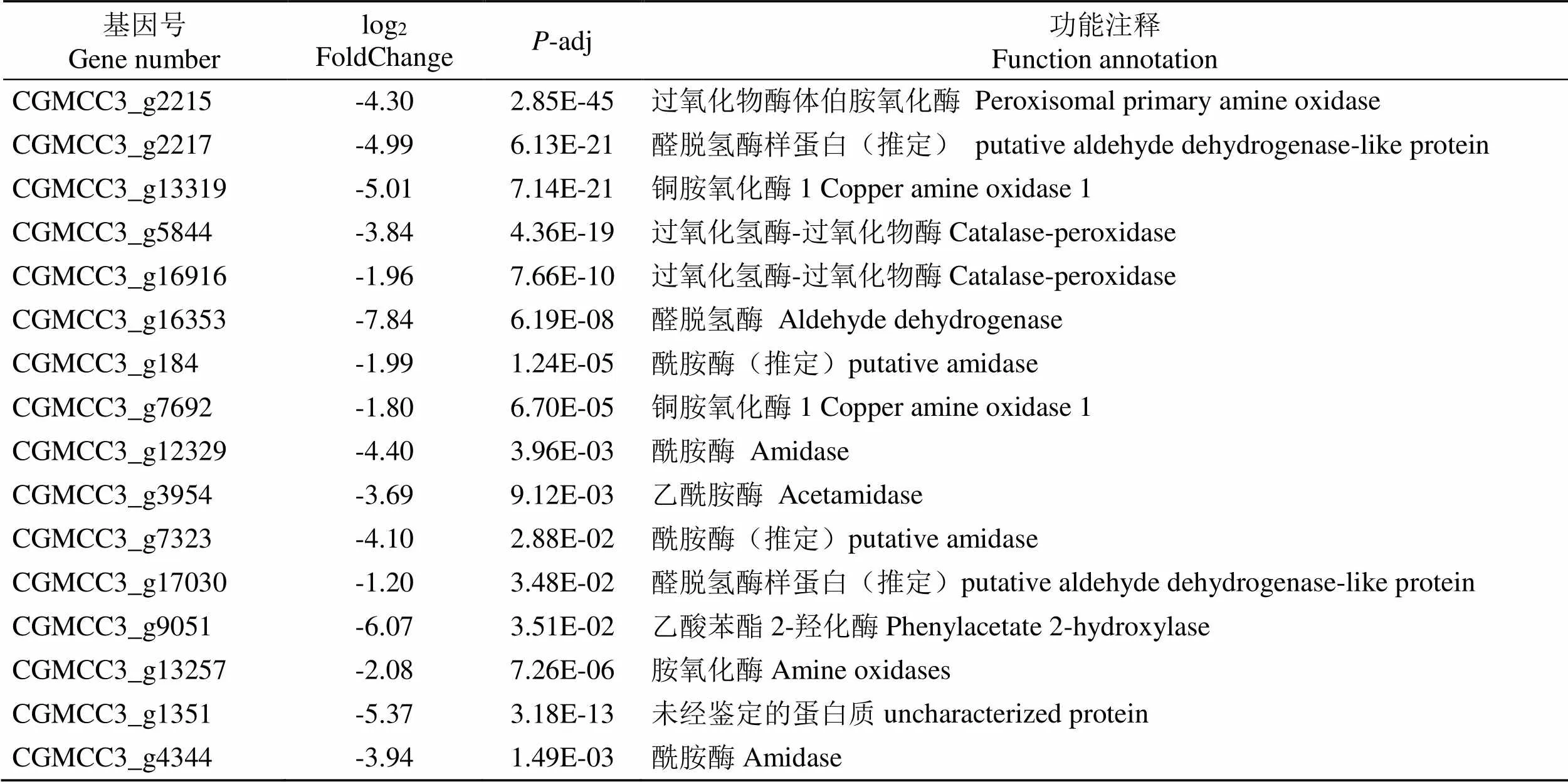
基因号Gene numberlog2 FoldChangeP-adj功能注释Function annotation CGMCC3_g2215-4.302.85E-45过氧化物酶体伯胺氧化酶Peroxisomal primary amine oxidase CGMCC3_g2217-4.996.13E-21醛脱氢酶样蛋白(推定)putative aldehyde dehydrogenase-like protein CGMCC3_g13319-5.017.14E-21铜胺氧化酶1 Copper amine oxidase 1 CGMCC3_g5844-3.844.36E-19过氧化氢酶-过氧化物酶Catalase-peroxidase CGMCC3_g16916-1.967.66E-10过氧化氢酶-过氧化物酶Catalase-peroxidase CGMCC3_g16353-7.846.19E-08醛脱氢酶Aldehyde dehydrogenase CGMCC3_g184-1.991.24E-05酰胺酶(推定)putative amidase CGMCC3_g7692-1.806.70E-05铜胺氧化酶1 Copper amine oxidase 1 CGMCC3_g12329-4.403.96E-03酰胺酶Amidase CGMCC3_g3954-3.699.12E-03乙酰胺酶Acetamidase CGMCC3_g7323-4.102.88E-02酰胺酶(推定)putative amidase CGMCC3_g17030-1.203.48E-02醛脱氢酶样蛋白(推定)putative aldehyde dehydrogenase-like protein CGMCC3_g9051-6.073.51E-02乙酸苯酯2-羟化酶Phenylacetate 2-hydroxylase CGMCC3_g13257-2.087.26E-06胺氧化酶Amine oxidases CGMCC3_g1351-5.373.18E-13未经鉴定的蛋白质uncharacterized protein CGMCC3_g4344-3.941.49E-03酰胺酶Amidase
2.6.2 缬氨酸、亮氨酸和异亮氨酸降解通路
与对照(CK)相比,经贝莱斯芽孢杆菌无菌发酵液处理后的烟草炭疽菌()(T)的缬氨酸、亮氨酸和异亮氨酸降解通路中共有17个差异表达基因(表4)。3个上调基因主要编码转氨酶(Aminotrans- ferases)和纤连蛋白(Fibronectin),上调倍数为1.25~5.90倍;14个下调基因主要编码甲基丙二酸-半醛脱氢酶(Methylmalonate-semialdehyde dehydrogena- se)、4-氨基丁酸转氨酶(4-aminobutyrate aminotransf- erase)、短/支链特异性酰基辅酶A脱氢酶(Short/branched chain specific acyl-CoA dehydrogen- ase)、2-氧异戊酸酯脱氢酶亚基α(2-oxoisovalerate dehydrogenase subunit alpha)、羟甲基戊二酰辅酶A合酶(Hydroxymethylglutaryl-CoA synthase)等,下调倍数为1.01~2.73倍。
表4 烟草炭疽菌KEGG富集中缬氨酸、亮氨酸和异亮氨酸降解通路中的相关差异表达基因
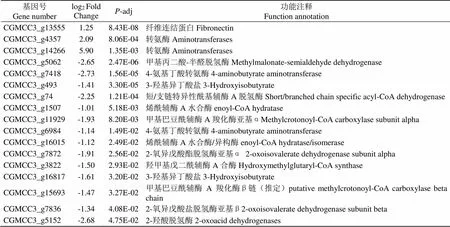
Tab.4 Related differentially expressed genes in valine, leucine and isoleucine degradation pathways in KEGG enrichment of C. fructicola
3 讨论
将贝莱斯芽孢杆菌作为生防菌应用于植物病害的生物防治,已成为目前微生物生态防控的研究热点。基于转录组学技术,研究生防菌-植物病原微生物互作系统中植物病原微生物的基因表达变化有助于进一步解析贝莱斯芽孢杆菌对病原微生物的直接作用。高雪等[30]发现贝莱斯芽孢杆菌HN-2正丁醇提取物主要影响稻黄单胞杆菌水稻致病变种()的核糖体途径、淀粉和蔗糖代谢途径、细菌趋化性途径。张国俊[31]研究表明贝莱斯芽孢杆菌无菌发酵液对太子参根腐病菌()的代谢途径、次生代谢产物合成及ABC转运蛋白合成途径进行调节,从而抑制的正常生长。为进一步明确贝莱斯芽孢杆菌对炭疽菌的抑菌机制,本研究将F85无菌发酵液处理后的进行转录组测序,为合理利用贝莱斯芽孢杆菌防治烟草炭疽病奠定了理论基础。
转录组测序分析发现F85无菌发酵液处理后的差异表达基因主要富集在苯丙氨酸代谢及缬氨酸、亮氨酸和异亮氨酸降解等通路上,表明贝莱斯芽孢杆菌很可能通过影响炭疽菌的这些代谢途径而发挥抑菌能力。其中,苯丙氨酸代谢通路富集最显著。在苯丙氨酸代谢通路中,过氧化物酶体可参与多种生化过程,在病菌损伤时它们阻塞菌丝细胞膜上的破损孔洞,具有防止胞质外流的作用[32]。研究表明,瓜类植物炭疽病菌()中编码过氧化物酶的基因参与过氧化物酶体的形成和增殖[33]。本研究结果显示,受F85无菌发酵液处理后,编码过氧化物酶体如Peroxisomal primary amine oxidase、Catalase-peroxidase(KatGs)等的基因表达显著下调,表明菌丝过氧化物酶体的形成过程受阻。同时,Bhambra等[34]研究表明,过氧化物酶体的缺陷可阻碍几丁质的合成,从而影响菌丝细胞壁的完整性。因此推测贝莱斯芽孢杆菌通过抑制炭疽菌过氧化物酶体的形成从而抑制菌丝细胞膜的修复、几丁质合成等过程,进而影响细胞壁的完整性,造成菌丝生长的缺陷。其他的酶体,如Aldehyde dehydrogenase(ALDH)能将醛脱氢氧化为相应的羧酸,其在生物体中具有脱毒(醛类物质)、参与代谢、渗透保护和NAD(P)H再生的4种主要功能[35-36]。经F85无菌发酵液处理后,编码这些酶类的基因也表现为显著下调,表明F85可以阻断中的渗透调节、多胺代谢等过程,进而对菌丝生长产生影响。
缬氨酸、亮氨酸、异亮氨酸降解通路中的物质多与能量代谢、转化有关。在三羧酸循环中,必须不断补充草酰乙酸才能维持循环正常进行,琥珀酰CoA是草酰乙酸回补反应中重要的物质原料,缬氨酸、异亮氨酸等可形成琥珀酰CoA而补充三羧酸循环[37],从而保持能量形成。在该通路中,甲基丙二酸半醛脱氢酶(Methylmalonate-semialdehyde dehydrogenase,Mo Msdh)是醛基脱氢酶超级家族中一种重要的酶。据报道[38],它在稻瘟病菌()的孢子形成、极化萌发、氧化还原稳态和致病机制中发挥着重要的作用。本研究中,受F85无菌发酵液处理后,缬氨酸、亮氨酸、异亮氨酸降解通路上的大部分基因下调,表明F85一方面可以阻断菌丝的能量形成过程,另一方面也可能对菌丝的形成产生抑制作用,这有待于进一步验证。
4 结论
转录组测序分析发现贝莱斯芽孢杆菌拮抗条件下烟草炭疽菌的差异表达基因主要富集在苯丙氨酸代谢(Phenylalanine metabolism)、缬氨酸、亮氨酸和异亮氨酸降解(Valine, leucine and isoleucine degradation)等通路上,贝莱斯芽孢杆菌可能影响菌丝过氧化物酶体的调控、能量形成过程等。本研究结果为进一步研究贝莱斯芽孢杆菌抑制烟草炭疽病的机制提供了依据。
[1] 张德锋,高艳侠,王亚军,等. 贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J]. 微生物学通报, 2020, 47(11): 3634-3649.
ZHANG Defeng, GAO Yanxia, WANG Yajun, et al. Advances in taxonomy, antagonistic function and application of[J]. Microbiology China, 2020, 47(11): 3634-3649.
[2] Dhouib H, Zouari I, Abdallah D B, et al. Potential of a novel endophyticin tomato growth promotion and protection againstwilt disease[J]. Biological Control, 2019, 139: 104092.
[3] Peypoux F, Bonmatin J. M, Wallach J. Recent trends in the biochemistry of surfactin[J]. Appl Microbiol Biotechnol, 1999, 51(5): 553-563.
[4] Fan B, Blom J, Klenk H-P, et al.,, andform an "operational group" within thespecies complex[J]. Front Microbiol, 2017, 8: 22.
[5] Rashid, M. H-O-, Khan, A, Hossain, M T, et al. Induction of systemic resistance against Aphids by endophyticYC7010 via expressingin[J]. Frontiers in Plant Science, 2017, 2(8): 1-12.
[6] 蔡高磊,张凡,欧阳友香,等. 贝莱斯芽孢杆菌()研究进展[J]. 北方园艺, 2018 (12): 162-167.
CAI Gaolei, ZHANG Fan, OUYANG Youxiang, et al. Research progress on[J]. Northern horticulture, 2018, 12: 162-167.
[7] 曹帅,李金梦,王蓝琴,等. 贝莱斯芽孢杆菌B4-7联合水稻秸秆生物炭对烟草青枯病的防治作用[J]. 南方农业学报,2022, 53(9): 2568-2574.
CAO Shuai, LI Jinmeng, WANG Lanqin, et al. Control effect ofB4-7 combined with rice straw biochar on tobacco bacterial wilt[J]. Journal of Southern Agriculture, 2022, 53(9): 2568-2574.
[8] 安依凡,韩猛,姚峰,等. 贝莱斯芽孢杆菌RJW-5-5对烟草赤星病菌的拮抗研究[J]. 安徽农业科学,2021, 49(6): 130-133.
AN Yifan, HAN Meng, YAO Feng, et al. Antagonistic study ofRJW-5-5 against tobacco brown spot disease[J]. J. Anhui Agric. Sci., 2021, 49(6): 130-133.
[9] 陈丹阳,甘勇,张万金,等. 烟草靶斑病拮抗菌的筛选鉴定及抗逆性研究[J/OL]. 四川农业大学学报,https://doi.org/10.16036/ j.issn.1000-2650.202108044.
CHEN Danyang, GAN Yong, ZHANG Wanjin, et al. Screening, identification and stress resistance of antagonistic against tobacco target spot [J/OL]. Journal of Sichuan Agricultural University, https://doi.org/10.16036/j.issn.1000-2650.202108044.
[10] 刘丽萍,高洁,李玉. 植物炭疽菌属真菌研究进展[J]. 菌物研究,2020, 18(4) : 266-281.
LIU Liping, GAO Jie, LI Yu. Advances in knowledge of the fungi referred to the genus[J]. Journal of Fungal Research, 2020, 18(4): 266-281.
[11] 贾玉. 烟草炭疽病菌的分子检测与烟草品种抗病性研究[D]. 泰安:山东农业大学,2012.
JIA Yu. Molecular detection ofand resistance reation of tobacco to[D]. Tai’an: Shandong Agricultural University, 2012.
[12] 柴欣,徐业平,姚剑,等. 烟草炭疽菌的分子鉴定与检测[J]. 安徽农业大学学报,2015, 42(5): 803-807.
CHAI Xin, XU Yeping, YAO Jian, et al. Molecular identification and detection of tobacco anthracnose pathogen[J]. Journal of Anhui Agricultural University, 2015, 42(5): 803-807.
[13] Wang H C, Huang Y F, Chen Q, et al. Anthracnose caused byon tobacco () in China[J]. Plant Disease, 2016, 100(6): 1235.
[14] 李继业,王璟晶,杨露,等. 烟草炭疽病原研究及拮抗链霉菌鉴定[J]. 浙江农业学报,2019, 31(8): 1337-1344.
LI Jiye, WANG Jingjing, YANG Lu, et al. ldentification of tobacco anthracnose and isolation of antagonistic[J]. Acta Agriculturae Zhejiangensis, 2019, 31(8): 1337-1344.
[15] ZHAO Q, XIA C J, WANG J, et al. First report ofcausing anthracnose on cigar tobacco in Hainan, China[J]. Plant Disease, 2020, 104(7).
[16] 覃丽萍,苏琴,谢玲,等. 杧果炭疽病菌和的危害特征及对杀菌剂的敏感性初探[J]. 植物保护,2020, 46(1): 197-202.
QIN Liping, SU Qin, XIE Ling, et al. A preliminary study on the damage characteristics of mango anthracnose causal agentsandand their sensitivity to fungicides[J]. Plant protection, 2020, 46(1): 197-202.
[17] 林春花,杨欢,赵晓宇,等. 海南橡胶树炭疽菌和的鉴定及系统发育分析[J]. 热带作物学报,2018, 39(1): 129-136.
LIN Chunhua, YANG Huan, ZHAO Xiaoyu, et al. Identification and phylogenetic analysis of anthracnose pathogenandisolated from rubber tree in Hainan[J]. Chinese Journal of Tropical Crops, 2018, 39(1): 129-136.
[18] 白静科. 果生炭疽菌与苹果不同抗性品种互作研究[D]. 杨凌:西北农林科技大学,2016.
BAI Jingke. Interaction between resistant and susceptible apple cultivars and[D]. Yangling: Northwest A & F University, 2016.
[19] 陈哲,黄静,赵佳,等. 草莓应答炭疽菌侵染的转录组分析[J]. 植物保护,2020, 46(3): 138-146.
CHEN Zhe, HUANG Jing, ZHAO Jia, et al. Transcriptomics analysis of strawberry response toinfection[J]. Plant protection, 2020, 46(3): 138-146.
[20] 代亚锋,吴楠楠,郜振,等. 茶树炭疽病拮抗内生细菌贝莱斯芽胞杆菌的筛选与鉴定[J]. 信阳师范学院学报(自然科学版),2021, 34(2): 201-207.
DAI Yafeng, WU Nannan,GAO Zhen, et al. Screening and identification of the endophytic bacteriaagainst tea anthracnose[J]. Journal of Xinyang Normal University(Natural Science Edition), 2021, 34(2): 201-207.
[21] 竺利红,李孝辉,施跃峰. 芽胞杆菌SM905的鉴定及其对铁皮石斛胶孢炭疽菌的抑菌活性研究[J]. 中国生物防治学报,2022, 38(2): 469-475.
ZHU Lihong, LI Xiaohui, SHI Yuefeng. Identification ofsp. SM905 and its antifungal activity against[J]. Chinese Journal of Biological Control, 2022, 38(2): 469-475.
[22] 王雨,谭峥,韦丹丹,等. 贝莱斯芽胞杆菌HN-2的鉴定及对杧果炭疽菌的抑菌活性研究[J]. 中国生物防治学报,2020, 36(2): 220-230.
WANG Yu, TAN Zheng, WEI Dandan, et al. Identification ofHN-2 and analysis of its antifungal properties[J]. Chinese Journal of Biological Control, 2020, 36(2): 220-230.
[23] 冯江鹏,邱莉萍,梁秀燕,等. 草莓胶孢炭疽菌拮抗细菌贝莱斯芽孢杆菌JK3的鉴定及其抗菌活性[J]. 浙江农业学报,2020, 32(5): 831-839.
FENG Jiangpeng, QIU Liping, LIANG Xiuyan, et al. Identification of antagonistic bacteriaJK3 against anthracnose of strawberry and its antipathogenic activity[J]. Acta Agriculturae Zhejiangensis, 2020, 32(5): 831-839.
[24] Choub V, Maung C E H, Won S J, et al. Antifungal activity of cyclic tetrapeptide fromCE100 against plant pathogen[J]. Pathogens, 2021, 10(2): 209-219.
[25] 侯圣凡,华战迎,刘峻杰,等. 我国草莓胶孢炭疽菌的多基因联合鉴定与致病性分析[J]. 中国农业大学学报,2022, 27(4): 82-94.
HOU Shengfan, HUA Zhanying, LIU Junjie, et al. Multi-gene joint identification and pathogenicity analysis of Colletotrichum gloeosporioides complex of strawberry in China[J]. Journal of China Agricultural University, 2022, 27(4): 82-94.
[26] Armitage A D, Nellist C F, Bates H J, et al. Draft genome sequence of the strawberry anthracnose pathogen[J]. Microbiol Resour Announc, 2020, 9: e01598-19.
[27] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25: 402-408.
[28] Sutton B C. Fungi Imperfecti with Pycnidia, Acervuli and Stromata: Colletotrichum. The Coelomycetes, 1980, 1:523-537
[29] CAI L, Hyde K D, Taylor P W J, et al. A polyphasic approach for studying Colletotrichum[J]. Fungal Divers, 2009, 39: 183-204.
[30] 高雪,劳广术,谭峥,等. 贝莱斯芽孢杆菌HN-2次生代谢产物处理下黄单胞菌(Xoo)的转录组分析[J]. 热带生物学报, 2023, 14(4): 389-398.
GAO Xue, LAO Guangshu, TAN Zheng, et al. Transcriptome Analysis ofpv.under the Treatment ofHN-2 secondary metabolites[J]. Journal of Tropical Biology, 2023,14(4): 389-398.
[31] 张国俊. 生防芽孢杆菌SBG9对太子参根腐病菌的抑菌作用研究[D]. 贵阳:贵州大学,2021.
ZHANG Guojun. The inhibition effect ofSBG9 onfor root rot of[D]. Guiyang: Guizhou University, 2021.
[32] LI L, WANG J Y, ZHANG Z, et al., which is essential for maintenance of peroxisomal structure and woronin bodies, is required for metabolism and development in the rice blast fungus[J]. PLoS One, 2014, 9(1): e85252.
[33] Kubo Y, Fujihara N, Harata K, et al.encodes a novel woronin body-associated Pex22 peroxin required for appressorium-mediated plant infection[J]. mBio, 2015, 6(5): e01305-15.
[34] Bhambra G K, WANG Z Y, Soanes D M, et al. Peroxisomal carnitine acetyl transferase is required for elaboration of penetration hyphae during plant infection by[J]. Mol Microbiol, 2006, 61(1): 46-60.
[35] 张乐,陈宣钦,李昆志. 植物醛脱氢酶基因家族[J]. 生命的化学,2013, 33(3): 299-306.
ZHANG Le, CHEN Xuanqin, LI Kunzhi. Aldehyde dehydrogenase gene family in plants[J]. Chemistry of life, 2013, 33(3): 299-306.
[36] Perozich J, Nicholas H, Wang Bicheng, et al. Relationships within the aldehyde dehydrogenase extended family[J]. Protein Sci, 1999, 8(1): 137-146.
[37] 杨荣武. 生物化学[M]. 北京:科学出版社,2013.
YANG Rongwu. Biochemistry[M]. Beijing: Science Press, 2013.
[38] Norvienyeku J, ZHONG Z H, LIN L L, et al. Methylmalonate- semialdehyde dehydrogenase mediated metabolite homeostasis essentially regulate conidiation, polarized germination and pathogenesis in[J]. Environmental Microbiology, 2017, 19(10): 4256-4277.
Transcriptomic analysis ofF85 antagonizing
LIU Hanfei1, LI Xihong2, XU Tingting1, XU Rubing2, ZHENG Lu1, HUANG Junbin1, LI Yanyan2*
1 College of Plant Science and Technology, Huazhong Agriculture University, Key Laboratory of Plant Pathology of Hubei Province,Wuhan 430207, China;2 Tobacco Research Institute of Hubei Province, Wuhan 430030, China
This study aims to explore the molecular mechanism ofspp. in response to the antagonism effect ofF85.Taking Colletotrichum fructicola, which causes tobacco anthracnose, as the research object, we set up a C. fructicola strain (T) treated with Bacillus velezensis F85 sterile fermentation broth and a normally growing C. fructicola strain (CK). We used transcriptome sequencing to explore the differentially expressed genes (DEGs) and the enrichment of metabolic pathways in the mycelium of tobacco anthracnose fungus under the antagonistic conditions of Bacillus velezensis..2870 DEGs were found between CK and T, including 1524 up-regulated genes and 1346 down-regulated genes. KEGG enrichment analysis showed that some pathways such as Phenylalanine metabolism, Valine, leucine and isoleucine degradation were significantly enriched by DEGs. Some genes coding KatGs, ALDH, CuAO, MoMsdh were down-expressed significantly.Under the antagonism of B. velezensis F85, the characteristics ofhyphae at transcriptomes level were significantly changed, and theF85 significantly affected the regulation of peroxisome and energy formation process ofmycelium.
;; transcriptome analysis; biological control
. Email:yanyanli0025@126.com
10.16472/j.chinatobacco.2023.T0010
湖北省烟草公司科技项目(027Y2021-004);中国烟草总公司重大科技项目(110202201019(LS-03))
刘涵斐(1994—),硕士研究生,主要从事作物病害研究,Email:2286743452@qq.com
黎妍妍(1982—),博士,研究员,主要从事烟草绿色防控技术创新与推广,Email:yanyanli0025@126.com
2023-01-31;
2023-08-04
刘涵斐,李锡宏,徐婷婷,等. 贝莱斯芽孢杆菌F85拮抗烟草炭疽菌的转录组学分析[J].中国烟草学报,2024,30(1). LIU Hanfei, LI Xihong, XU Tingting, et al. Transcriptomic analysis of Bacillus velezensis F85 antagonizing Colletotrichum fructicola[J]. Acta Tabacaria Sinica, 2024,30(1).
