结直肠黏液腺癌免疫细胞浸润与预后相关因素分析
2024-03-26卢瑗瑗
李 昂,弓 戈,王 新,卢瑗瑗
(1国家消化系统疾病临床医学研究中心,消化系肿瘤整合防治全国重点实验室,陕西 西安 710032;2空军军医大学西京消化病医院,陕西 西安 710032;3空军军医大学唐都医院消化内科,陕西 西安 710038)
黏液腺癌(mucinous adenocarcinoma,MAC)是结直肠癌的一种特殊病理亚型,其特征是细胞外黏液成分至少占肿瘤组织的50%。MAC相比于普通腺癌,分化程度低,恶性程度高,易发生腹膜转移,临床预后差[1]。肿瘤的恶性表型不仅由癌细胞的内在活性决定,也受到肿瘤微环境中募集和激活的基质细胞和免疫细胞的影响[2]。肿瘤浸润免疫细胞(tumor-infiltrating immune cells,TIICs)作为肿瘤微环境的重要组成部分,与肿瘤的发生和发展密切相关。TIICs的类型和丰度不仅能够有效预测患者的生存,也能影响肿瘤对治疗的反应[3]。然而,MAC的肿瘤免疫微环境目前尚缺乏研究,阐明其特殊的免疫微环境特征及具体TIICs的类型和丰度与肿瘤患者预后的相关性具有重要意义。因此,本研究利用生物信息学方法,对采集自癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库的MAC数据进行浸润免疫细胞量化和预后分析,以阐述MAC的免疫细胞浸润特点,揭示免疫细胞浸润与MAC预后的相关性,为MAC预后预测和临床决策提供可靠的参考意见。
1 对象与方法
1.1 对象
结直肠MAC和普通腺癌(adenocarcinoma not otherwise specified,AC)患者的基因表达谱(gene expression profiles,GEPs)与临床预后信息采集自TCGA数据库(https://portal.gdc.cancer.gov/)。MAC组纳入标准:①原发部位为结肠和直肠;②肿瘤组织HE染色图像复核为MAC;③具有完整的临床随访信息,包括性别、年龄、TNM分期、生存状态和总生存期。排除标准为:①遗传性结直肠癌患者;②合并其他系统肿瘤的患者。AC组纳入标准:①原发部位为结肠和直肠;②肿瘤组织HE染色图像复核为腺癌;③具有完整的临床随访信息,包括性别、年龄、TNM分期、生存状态和总生存期。排除标准为:①遗传性结直肠癌患者;②合并其他系统肿瘤的患者。最终,共有78例MAC患者、500例AC患者纳入该研究,基线资料见表1。
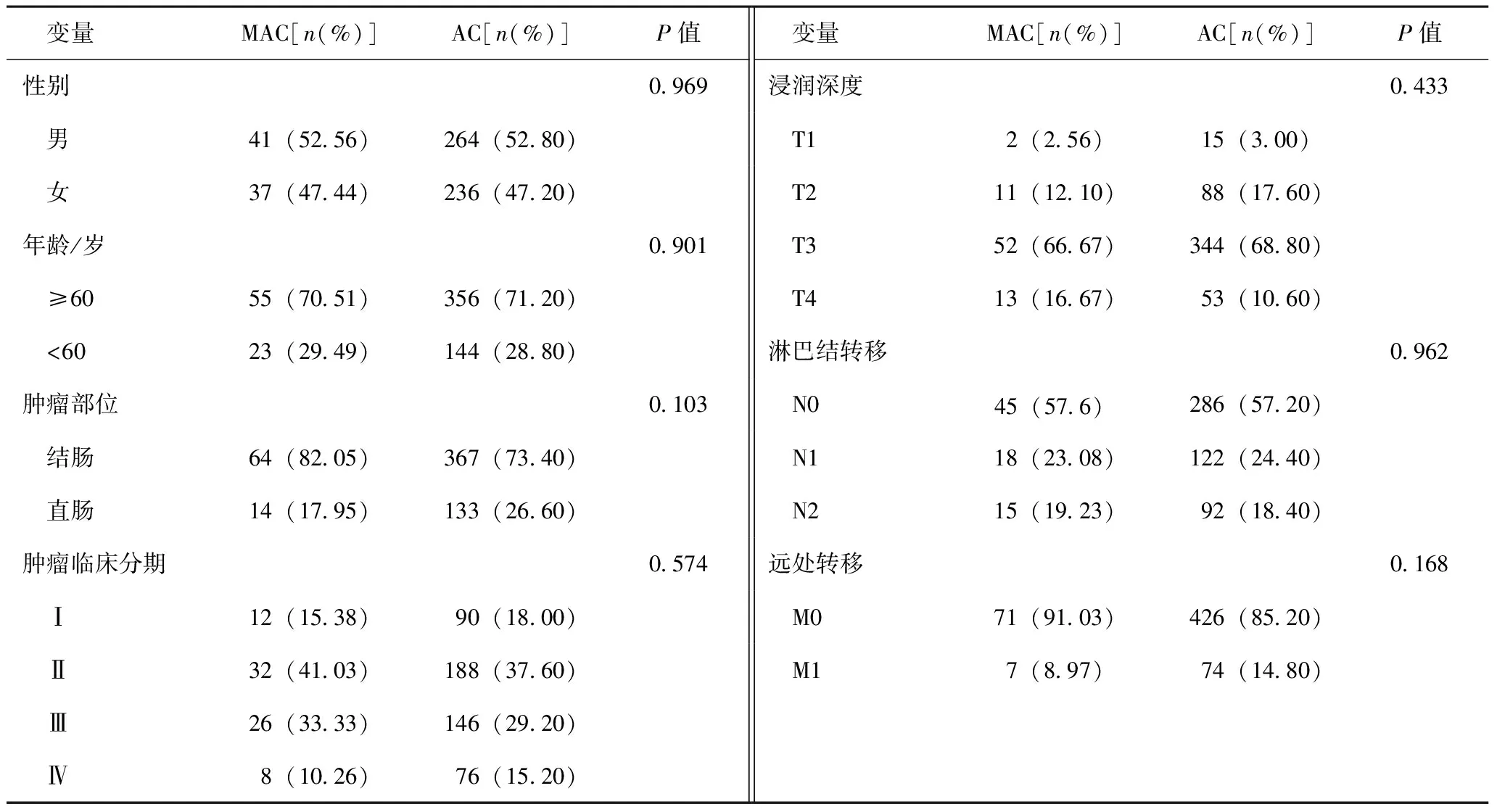
表1 TCGA结直肠MAC与AC患者临床基线信息
1.2 方法
1.2.1 TIICs特征分析 使用R软件的CIBERSORT程序包确定每个样本中22种TIICs的比例。CIBERSORT是通过分析每个个体组织样本中547个特定基因的相对表达水平,通过反卷积算法预测22种TIICs在组织中的比例,即幼稚B细胞、记忆B细胞、浆细胞、CD8+T细胞、幼稚CD4+T细胞、静息态CD4+记忆T细胞、激活态CD4+记忆T细胞、辅助性T细胞、调节性T细胞(regulatory T cells,Tregs)、γδT细胞、静息态自然杀伤细胞、激活态自然杀伤细胞、单核细胞、M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、静息态树突状细胞(dendritic cells,DC)、激活态DC、静息态肥大细胞、激活态肥大细胞、嗜酸性粒细胞和中性粒细胞[4]。通过将归一化的MAC的GEPs转化为22种TIICs的比例分数,测定每个样本中22种免疫细胞的相对表达量,并进行癌与癌旁的组间差异分析。
1.2.2 TIICs与预后相关性分析 将测定的MAC患者TIICs比例分数通过使用“survival”(R包)取截断值,分为低浸润组和高浸润组进行各免疫细胞与预后相关的Kaplan-Meier生存分析。再将MAC患者所有TIICs比例分数应用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归和单因素Cox回归筛选与预后相关的TIICs,并最终将上述因素纳入多因素Cox回归分析确定独立预后影响因素。
1.2.3 统计学方法 使用t检验、Mann-WhitneyU检验或非参数秩和检验分析连续性变量,使用χ2检验或Fisher精确检验分析分类变量,采用Kaplan-Meier生存分析、LASSO回归、Cox单因素和多因素回归进行预后分析。所有数据均采用SPSS 26.0和R 4.2.3进行分析。P<0.05表示差异有统计学意义。
2 结果
2.1 MAC肿瘤组织具有特异的免疫细胞浸润特征
基于CIBERSORT分析,我们初步探索了MAC患者肿瘤组织免疫细胞浸润特征(图1A),其中构成比中位数最高的前5种免疫细胞依次是M0巨噬细胞(0.27)、静息CD4+记忆T细胞(0.22)、M2巨噬细胞(0.15)、CD8+T细胞(0.13)、激活态肥大细胞(0.10)。进一步分析MAC患者肿瘤组织和癌旁组织免疫细胞浸润的差异,结果显示两种组织中TIICs差异明显,特别是与癌旁组织相比,肿瘤组织CD8+T细胞低浸润(P=0.024 5),而M0巨噬细胞(P=0.013 3)高浸润(图1B)。而与AC患者肿瘤组织相比,MAC患者肿瘤组织呈现CD8+T细胞(P=0.049 3)、激活态CD4+T(P=0.004 0)、辅助性T细胞(P=0.022 0)、Tregs(P=0.036 2)、静息态DC(P=0.002 3)低浸润,M0巨噬细胞(P=0.015 3)、激活态肥大细胞(P=0.020 9)和中性粒细胞(P=0.000 1)高浸润的特点(图1C)。以上结果均揭示,MAC肿瘤组织具有特异的免疫细胞浸润特征。

A:MAC中TIICs热图;B:MAC肿瘤组织与癌旁组织TIICs柱状图;C:MAC与AC肿瘤组织TIICs柱状图。MAC:黏液腺癌;TIICs:肿瘤浸润免疫细胞;AC:普通腺癌。aP<0.05,bP<0.01。
2.2 Tregs、M0巨噬细胞和激活态DC的肿瘤浸润程度是MAC患者预后的独立危险因素
基于MAC肿瘤组织不同丰度的免疫细胞浸润与预后的Kaplan-Meier生存分析,可以观察到Tregs(P=0.003 3)和M0巨噬细胞(P=0.002 2)浸润程度与患者预后呈负相关,而M1巨噬细胞(P=0.000 9)和激活态CD4+记忆T细胞(P=0.044 0)浸润程度与患者预后呈正相关(图2A)。LASSO回归分析显示,Tregs(P=0.005 7)、激活态DC(P=0.036 8)、激活态肥大细胞(P=0.045 4)和嗜酸性粒细胞(P=0.047 5)与患者预后相关(图2B)。单因素Cox回归分析示,Tregs(P=0.023 4)和M0巨噬细胞(P=0.007 4)浸润程度与患者预后相关。

A:分别为M0巨噬细胞、M1巨噬细胞、Tregs和激活态CD4+ T细胞浸润水平的Kaplan-Meier生存曲线;B:22种TIICs的LASSO系数路径图及交叉验证曲线;C:多因素Cox回归森林图;D:MAC不同预后的TIICs分布柱状图。Tregs:调节性T细胞;TIICs:肿瘤浸润免疫细胞;LASSO:最小绝对子收缩和选择算子;MAC:黏液腺癌;DC:树突状细胞。aP<0.05,bP<0.01。
将上述筛选的预后因素均纳入多因素Cox回归分析(图2C),最终结果显示Tregs、M0巨噬细胞和激活态DC的浸润程度与预后显著相关[Tregs:HR(95%CI)=21.63(8.93,34.33),P=0.000 8;M0巨噬细胞:HR(95%CI)=9.60(4.14,15.06),P=0.000 6;激活态DC:HR(95%CI)=32.55(4.14,54.20),P=0.002 0],这些因素被确认为MAC患者预后的独立危险因素。
此外,我们按照MAC患者总生存期的中位时间作为截断值,将患者临床分期倾向性匹配后分为预后良好组和预后不良组,组间差异分析结果提示相对预后良好者,预后不良MAC肿瘤组织Tregs、辅助性T细胞和M0巨噬细胞浸润程度较高(Tregs:P=0.000 8;辅助性T细胞:P=0.000 8;M0巨噬细胞:P=0.041 2,图2D)。
2.3 M0巨噬细胞和激活态DC的浸润程度与MAC的临床分期有关
根据TIICs与临床分期的相关性分析结果显示(图3),不同T分期的MAC患者肿瘤组织中M0巨噬细胞(P=0.004 5)和CD8+T细胞(P=0.005 5)的浸润程度存在显著差异。进一步的组内差异分析表明,随着T分期的升高,M0巨噬细胞的浸润程度逐渐增加,而CD8+T细胞的浸润程度逐渐减少。此外,通过M分期的组间比较发现,发生远处转移的MAC患者的原发肿瘤组织中CD8+T细胞(P=0.041 3)、激活态DC(P=0.037 7)和M1巨噬细胞(P=0.006 0)的浸润程度低于未发生转移的患者。

A:T1~T4期MAC肿瘤组织M0巨噬细胞和CD8+ T细胞浸润量;B:M1和M0期MAC肿瘤组织CD8+ T细胞、激活态DC和M1巨噬细胞浸润量。TIICs:肿瘤浸润免疫细胞;MAC:黏液腺癌;DC:树突状细胞。aP<0.05,bP<0.01。
3 讨论
MAC具有特殊的生物学行为和病理学特征,需进一步研究其分子发生机制和肿瘤微环境来改善临床疗效。目前已有两篇关于MAC的全基因组单细胞测序研究,这些研究主要集中在揭示基因及转录组水平上的差异性,但对于免疫浸润细胞的描述尚未得到详尽报道[5-6]。本研究首次利用生物信息学工具探索了MAC的TIICs特征,并发现其与预后具有相关性,这将为结直肠癌肿瘤免疫微环境的研究提供新的视角。
根据疾病预测模型提供的个性化信息制定的治疗方案往往会更有效地改善患者的健康状况。传统的结直肠癌患者预后评估主要依靠TNM分期,但它受到细胞和分子水平信息缺乏的限制,可能导致相同TNM分期的结直肠癌患者临床结局存在相当大的异质性,因此,有必要探索其他潜在的生物标志物。本研究发现Tregs、M0巨噬细胞和激活态DC的肿瘤浸润程度是MAC的独立预后因素,且均与预后负相关,进一步探索这些免疫细胞在肿瘤组织中的分子机制尤为重要。
Tregs主要负责维持免疫系统的平衡和抑制过度免疫反应,对于维持身体稳态、调节和阻止炎症过程以避免自身免疫性疾病至关重要[7]。在肿瘤微环境中,Tregs细胞不仅可以抑制针对自身抗原的异常免疫反应,也可抑制抗肿瘤免疫反应[8-10]。实验室研究发现,Tregs细胞能够通过调节抗原呈递细胞表面的CD80和CD86分子,迫使其他T细胞陷入一种被称为无应答状态的低敏感状态,从而阻碍有效的肿瘤免疫,去除Tregs细胞后,抗肿瘤免疫反应可以重新唤起或增强[11-12]。该系列发现解释了本研究中关于高浸润Tregs细胞与MAC预后负相关的结果。此外,多种肿瘤组织中观察到大量Tregs细胞浸润,且在宫颈癌、肾癌、乳腺癌和黑色素瘤等大多数实体瘤中,Tregs细胞的高浸润通常与不良的临床预后有关[13],这也与本研究发现的结果相一致。然而,有研究发现,高Tregs细胞浸润与结肠癌患者的预后尚存在争议,这种争议目前认为与结肠癌肿瘤组织中不同亚型的Tregs细胞浸润有关[14]。因此,进一步探究MAC肿瘤组织中浸润Tregs细胞的异质性至关重要,以更准确地评估它们对MAC进展和预后的预测价值。
DC是抗原呈递细胞,在桥接先天性和适应性免疫反应中起着至关重要的作用[15]。静息态DC细胞通过摄取抗原转变为激活态DC细胞,并将抗原交叉呈递给幼稚T细胞,激活抗原特异性T细胞。DC细胞是一组异质性免疫细胞,主要分为经典型树突状细胞(conventional dendritic cell,cDC)和浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)。在肿瘤微环境中,cDC专注于细胞内抗原的加工和呈递,并通过将肿瘤相关抗原交叉呈递到CD8+T淋巴细胞来塑造抗肿瘤免疫反应[16]。一些研究报道了不同实体瘤患者cDC组织密度、治疗反应和总生存期之间正相关[17]。然而,在肿瘤微环境中pDC一方面诱导cDC成熟来增强CD8+T细胞和NK细胞的抗肿瘤效能[18],另一方面又通过表达免疫抑制分子(如PD-L1、ICOSL和吲哚胺2,3-双加氧酶)或促进Tregs细胞扩增来促进肿瘤生长[19]。且有研究发现,pDC的浸润程度与卵巢癌和黑色素瘤的预后不良有关[15,20]。这就与本研究发现激活态DC浸润程度与MAC预后负相关相一致,因此,进一步探究MAC肿瘤组织中浸润DC细胞的异质性以及其与肿瘤浸润Treg细胞的相互作用对MAC的发生发展十分必要。
M0巨噬细胞,又称为未刺激活化的巨噬细胞,是单核细胞向M1巨噬细胞或M2巨噬细胞分化的中间状态,具有未分化的特征,通过调节M1和M2巨噬细胞的比例,可以达到调节免疫反应或炎症反应的目的,而其本身在肿瘤发生发展中的作用尚无相关研究[21-24]。本研究发现M0巨噬细胞浸润程度与MAC预后负相关,且随着T分期的升高,M0巨噬细胞的浸润程度逐渐增加。这一发现需要更大规模的样本和更多的实验证据来加以证实,但也可能为理解肿瘤相关巨噬细胞的作用提供了新的视角。
本研究虽然取得了一定进展,但仍存在一些局限性。首先,由于研究对象是少见肿瘤,最终纳入本研究的MAC患者例数较少,且其他数据库也缺乏该肿瘤亚型的样本数据,因此缺乏外部验证,这可能对研究结果的普适性产生一定影响。其次,本研究缺乏实验室验证,因此研究结论在科学实验证据方面的支持相对薄弱。最后,由于数据库原始资料限制,本研究未能纳入患者的治疗信息,这限制了研究成果在临床实践中的直接应用价值。尽管如此,本研究取得的初步结果对相关领域的研究和实践仍具有一定的启发意义。同时,我们也将在本研究的基础上,克服上述局限而进一步开展相关研究,以推动MAC肿瘤的诊治进展。
总之,本研究首次利用生物信息学工具探索了结直肠MAC的TIICs特征,发现Tregs细胞、M0巨噬细胞和激活态DC细胞浸润程度是MAC的独立预后因素。此外,我们还发现TIICs亚群与临床分期密切相关。这些发现揭示了TIICs在MAC中的重要作用,可能对MAC患者术后个性化随访、护理、治疗决策产生影响。
