降糖舒心方抑制内质网应激-过度自噬对糖尿病大鼠心肌病变的影响*
2024-03-26符显昭申亚亚陈佳俊蒋晓凤黄光明
符显昭,申亚亚,陈佳俊,蒋晓凤,黄光明
(右江民族医学院附属医院,广西 百色 533099)
心肌病变是糖尿病慢性并发症之一,其主要表现为心肌细胞丢失及纤维组织增生等病理改变引发的心肌重塑,导致心室扩大及心力衰竭[1]。内质网应激(endoplasmic reticulum stress,ERS)作为多种应激源的共同通路,可通过未折叠蛋白反应(unfolded protein response,UPR)信号与炎症反应偶合,连接代谢异常和凋亡反应过程[2]。过度或持久发生ERS,导致自噬水平持续增加和过度激活,最终导致自噬无能,甚至自噬性细胞死亡(也称为Ⅱ型程序性死亡),致使心肌细胞数量减少,促进心力衰竭的发生发展[3]。根据中医理论,“气阴两虚,瘀毒内蕴”为糖尿病心肌病变的主要病机[4]。前期研究结果表明,以“滋阴益气、活血解毒”为治法治则的降糖舒心方能抑制胰岛素抵抗,减轻氧化应激所导致的炎症反应,降低ERS标志性分子的mRNA及其功能蛋白的表达,减轻“氧化应激-内质网应激-细胞凋亡”的偶联反应,抑制ERS相关凋亡的通路,减少心肌细胞凋亡,从而对心肌组织结构及超微结构起到保护作用[5-6]。本研究侧重糖尿病合并心力衰竭的防治研究,采用腹主动脉缩窄手术方法,增加压力负荷,导致糖尿病合并慢性心力衰竭(chronic heart failure,CHF)产生,引发过度或持久的ERS,使内质网应激与自噬之间的交互作用由适应性、保护性,逐渐转变为持续性、破坏性,最终使心肌细胞自噬无能而死亡,从而建立糖尿病心肌病变大鼠模型。同时本研究利用降糖舒心方进行干预,进一步研究其对糖尿病心肌病变的保护机制。
1 材料与方法
1.1 实验动物 7周龄SPF级雄性SD大鼠100只,体质量220~250 g,由广西医科大学实验动物中心提供,动物生产许可证号:SCXK桂2020-0003,大鼠健康状况均良好,饲养于右江民族医学院动物实验中心,温度20~23 ℃,相对湿度40%~50%,自然采光,不限饮食、水。本实验已通过右江民族医学院实验动物伦理委员会审查,伦理编号:2019030701。
1.2 药物与试剂 降糖舒心方,方药组成:人参10 g,五味子8 g,麦冬15 g,黄芪15 g,生地黄15 g,山药15 g,山茱萸10 g,大黄5 g,黄连8 g,丹参10 g。上述中药购自右江民族医学院附属医院中药房,均符合2020年版《中华人民共和国药典》药品质量控制标准。将上述中药置于约4倍体积量超纯水中,室温浸泡2.0 h后,用不锈钢提桶煎煮1.5 h,浓缩烘干制成浸膏,每1 g浸膏剂量相当于原生药10 g,用保鲜膜密封,放入-20 ℃冰箱保存,灌胃给药时室温下解冻。格列喹酮(批准文号:国药准字H10940258,北京万辉双鹤药业有限责任公司)、贝那普利(批准文号:国药准字H20044840,上海新亚药业闵行有限公司)均购自右江民族医学院附属医院;链脲佐菌素(STZ,批号:10099-141)购自北京华越洋生物科技有限公司;水合氯醛(批号:6037004-1)、HE染色试剂盒(批号:H1120)均购自上海碧云天生物科技有限公司;逆转录试剂盒(批号:K1622)、BCA蛋白浓度检测试剂盒(批号:C0038)均购自美国Thermo Fisher Scientific公司;引物糖调节蛋白78(glucose regulate drotein 78,GRP78)、肌醇需求酶1(inositol requiring enzyme 1,IRE-l)、肿瘤坏死因子相关受体因子-2(tumor necrosis factor receptor-associated factor,TRAF2)均由康为世纪生物科技有限公司合成;LC3-Ⅱ抗体(批号:ab32441)、Beclin 1抗体(批号:ab76039)均购自美国Abcam公司;高脂饲料(普通饲料78.2%,猪油10%,蛋黄粉10%,胆固醇1.5%,猪胆盐0.3%)购自江苏省协同生物工程有限公司。
1.3 主要仪器 飞利浦IE33型超声心动仪(上海继圣医疗器械有限公司);外科手术器械(德州蓝索医疗器械有限公司);ABI-7500型荧光定量PCR仪(美国罗氏公司);BX53M型光学显微镜(日本奥林巴斯公司);5418/5418R型台式高速低温离心机(德国Eppendorf AG公司);Leica EM UC7型切片机(德国Thermo scientific公司);CL-32L型全自动热蒸汽灭菌器(日本ALP公司);HistoCore PEARL型组织脱水机(德国徕卡公司);SJ-CJ-2FDQ型超净工作台(中国苏州医疗设备厂);SIMF140AY65型制冰机(上海金畔生物科技有限公司)。
1.4 造模与分组 大鼠适应性饲养7 d后按随机数字表法分成模型组、西药组、降糖舒心方低剂量组、降糖舒心方高剂量组、假手术组,每组20只。模型组、西药组、降糖舒心方低剂量组、降糖舒心方高剂量组大鼠腹腔单次注射STZ(用柠檬酸缓冲液制备成质量浓度为10 mg/mL的溶液),剂量为50 mg/kg。72 h后,用血糖试纸检测大鼠尾静脉血糖,以连续2次空腹血糖≥16.7 mmol/L为成功构建糖尿病模型的标准,随后用高脂饲料喂养1个月。假手术组大鼠腹腔注射等体积柠檬酸缓冲液,后用普通饲料喂养。糖尿病模型大鼠禁食8 h后,腹腔注射10%水合氯醛(3 mL/kg)麻醉后,打开腹腔,暴露分离腹主动脉,在腹主动脉旁放置7号针,用4-0丝线结扎腹主动脉和7号针,然后再拔针,缩窄腹主动脉60%~70%,术后抗感染治疗,继续高脂饲料饲养。假手术组大鼠只穿线不结扎,普通喂养。术后第28天,大鼠麻醉后备皮,卧位,超声检测心脏功能。射血分数(ejection fraction,EF)≤45%则判定为心力衰竭[7]。
1.5 实验给药 降糖舒心方给药剂量依据人与大鼠体表面积折算,成人临床用量的5.4倍为低剂量,并设高剂量为低剂量的1.2倍原生药量,用已制成的药物流浸膏加入生理盐水进行配制,降糖舒心方低、高剂量组大鼠灌胃给予降糖舒心方药液,剂量分别为1.0、1.2 g/(kg·d);西药组大鼠分别灌胃给予格列喹酮(9.80 mg/kg)和贝那普利(3.30 mg/kg)(按临床用量的5.4倍计算),假手术组和模型组大鼠灌胃给予等容积蒸馏水,1次/d,连续2个月。给药过程中,模型组、西药组、降糖舒心方低剂量组、降糖舒心方高剂量组大鼠继续进行高脂饲料喂养,假手术组大鼠予普通饲料喂养。
1.6 观察指标
1.6.1 样品采集 给药2个月后,禁食8 h,各组大鼠吸入2%异氟烷麻醉后,仰卧固定,超声心动仪探头频率控制在1.0~5.0 MHz,检测心脏左室射血分数(1eft ventricular ejection fraction,LVEF)、舒张末期室间隔厚度(interventricular septal depth,IVSd)、收缩末期室间隔厚度(interventricular septal thickness at end-systole,IVSs)、收缩末期左心室后壁厚度(left ventricular posterior wall systole,LVPWs)与舒张末期左心室后壁厚度(1eft ventricular posterior wall diastole,LVPWd),每一数据均测量3次取平均值。随后处死大鼠,在冰上迅速取心脏,分3部分,一部分心肌组织浸入3%的戊二醛溶液中,置4 ℃冰箱保存,用作电镜观察心肌细胞自噬及心肌组织超微结构的变化;一部分用4%多聚甲醛固定,用于光学显微镜下观察心肌组织病理形态结构;其余组织放入液氮于-80 ℃冷藏,用于RT-PCR检测内质网应激信号分子GRP78 mRNA、IRE-l mRNA、TRAF2 mRNA相对表达量,同时采用Western blotting法检测心肌组织自噬蛋白Beclin 1、LC3-Ⅱ表达水平。
1.6.2 HE染色观察心肌病理学改变情况 心肌组织经逐级乙醇脱水,石蜡包埋,切4 μm薄片,60 ℃烘箱烘烤,二甲苯脱蜡,逐级乙醇脱水,苏木素染色5 min,自来水冲洗5 min,盐酸乙醇分化30 s,自来水浸泡15 min,置伊红液2 min,自来水冲洗,逐级乙醇脱水,使用200倍显微镜进行图像采集。HE半定量分析。0分:无炎症细胞浸润,无心肌坏死;1分:炎症细胞浸润范围、心肌坏死面积<25%;2分:炎症细胞浸润范围、心肌坏死面积为25%~<50%;3分:炎症细胞浸润范围、心肌坏死面积为50%~<75%;4分:炎症细胞浸润范围、心肌坏死面积≥75%。
1.6.3 透射电镜观察心肌自噬超微结构变化 将心肌从3%戊二醛固定液中取出,用1%锇酸溶液固定心肌组织,再吸干锇酸固定液,用0.1 mol/L的PBS(pH=7.0)漂洗心肌样品3次,每次15 min,梯度浓度乙醇溶液(50%、70%、80%、90%和95%)对心肌样品进行脱水,用纯丙酮处理20 min处理,使用812环氧树脂包埋心肌组织,制成心肌组织超薄切片(50~70 nm),用醋酸双氧铀和柠檬酸铅溶液双重染色15 min,透射电镜在加速电压为60~80 kV下使用30 000放大倍率下调节物镜聚焦旋钮至图片清晰,观察拍照。
1.6.4 RT-PCR检测内质网应激信号分子GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量 目的基因:GRP78的上游引物为5'-CTTGGTATTGAAACTGTGGG-3',下游引物为5'-TGTTACGGTGGGC TGAT TAT-3',扩增长度为117 bp;IRE-1的上游引物ATGGGTGGCGTTCATCATCA,下游引物GTAAGGTCTCCGTGTGGGTG,扩增长度为148 bp;TRAF2的上游引物为TCACCATCACACAGACAGGC,下游引物为GCCCTTTCTGA GTACCCCAC,扩增长度为234 bp。内参基因:GAPDH上游引物为5'-GATG GTGAA GGT CGGTGTGA-3',下游引物为5'-TGAACTTGCCGTGGG TAGAG-3',扩增长度114 bp。从-80 ℃冰箱取出心肌组织,在研钵中加入Trizol裂解液研磨,提取总RNA,琼脂糖凝胶电泳,检测其完整性;按照逆转录试剂盒说明操作:42 ℃,15 min;85 ℃,5 min逆转录为cDNA。然后将获得的cDNA扩增为目的基因,步骤按照PCR试剂盒操说明进行,设3个复孔点样,在Real-time PCR仪上进行PCR反应,反应条件:95 ℃,10 min变性;95 ℃,15 s;60 ℃,60 s;40次循环。利用溶解曲线检测引物的特异性,记录达到所设定的阈值所经历的循环数,即CT值,采用2-△△Ct计算表达量,△Ct=Ct目的基因-CtGAPDH,△△Ct=实验组(Ct目的基因-CtGAPDH)-假手术组(Ct目的基因-CtGAPDH),2-△△Ct=2-△Ct实验组/2-△Ct假手术组,具体计算以假手术组表达量为1,比值为实验组相对表达量。
1.6.5 Western blotting法检测心肌组织中Beclin 1、LC3-Ⅱ蛋白相对表达量 取出心肌,解冻,剪碎,加入1 mL冷Lysis Buffer液,在组织匀浆机中进行匀浆,冰上静置,裂解15 min。将匀浆液放入离心管中,12 000 r/min(离心半径为15 cm)离心5 min,取上清液,用BCA试剂盒检测其浓度。在SDS-PAGE进行电泳和转膜后,把PVDF膜放入孵育盒中,用5%脱脂奶粉封闭,摇床振荡1.5 h,用TBST洗膜3次,将膜放入含一抗稀释液的孵育盒中,4 ℃摇床振荡孵育过夜。第2天,室温振荡30 min,吸弃一抗,TBST洗3次,再用5%脱脂奶粉封闭液稀释二抗,室温摇床振荡1 h,回收二抗后,用TBST洗膜3次。在PVDF膜滴加发光试剂混合液,使用ECL成像仪拍照,存储图片,使用Image J软件测定并分析灰度值。
1.7 统计学方法 采用SPSS 25.0统计软件进行处理,计量资料用“均数±标准差”(±s)表示,组间比较采用单因素方差分析,经方差齐性检验后,如果方差齐,采用LSD法,方差不齐用采用Tambanes T2法,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠心功能比较 与假手术组比较,模型组大鼠LVPWs、LVPWd、IVSs、IVSd均明显升高(P<0.01),LVEF明显降低(P<0.01);与模型组比较,各给药组大鼠LVPWs、LVPWd、IVSs、IVSd均明显降低(P<0.05),LVEF均明显升高(P<0.05),且降糖舒心方存在剂量依赖性;降糖舒心方低、高剂量组大鼠LVEF明显高于西药组(P<0.05)。(见表1)
表1 各组大鼠心功能比较 (±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
给药剂量格列喹酮/(mg/kg) 贝那普利/(mg/kg) 降糖舒心方/(g/kg)假手术组 20 0.301±0.004 0.216±0.013 0.341±0.016 0.187±0.017 88.5±7.7模型组 20 0.447±0.006a 0.344±0.014a 0.397±0.015a 0.247±0.015a 61.4±4.0a西药组 20 9.80 3.30 0.341±0.006ab 0.229±0.022ab 0.340±0.021ab 0.209±0.012ab 68.8±1.4ab降糖舒心方低剂量组 20 1.0 0.344±0.005ab 0.236±0.024ab 0.336±0.026ab 0.217±0.011ab 70.7±3.6abc降糖舒心方高剂量组 20 1.2 0.364±0.007ab 0.241±0.021ab 0.351±0.023ab 0.221±0.013ab 72.2±1.7abc F 1 802.654 142.802 29.878 49.494 106.355 P 0.000 0.000 0.000 0.000 0.000组别 n LVPWs/cm LVPWd/cm IVSs/cm IVSd/cm LVEF/%
2.2 各组大鼠心肌组织病理学改变情况 假手术组大鼠心肌组织、心肌纤维形态正常,心肌细胞排列整齐,细胞质丰富,无间质出血,无坏死,无肌丝融解。模型组、西药组、降糖舒心方低剂量组和降糖舒心方高剂量组大鼠心肌组织损伤严重,心肌细胞结构紊乱,细胞肿胀和坏死,肌肉纤维模糊,部分肌丝坏死,形成空泡。与模型组比较,降糖舒心方低剂量组和降糖舒心方高剂量组大鼠心肌损害程度较低,心肌细胞形态较正常,心肌细胞排列较整齐,心肌组织损伤减轻。
与假手术组比较,模型组大鼠心肌组织病理学积分明显升高(P<0.01);与模型组比较,各给药组大鼠心肌组织病理学积分均明显降低(P<0.05);降糖舒心方低、高剂量组大鼠心肌组织病理学积分均明显低于西药组(P<0.05),且具有剂量依赖性。(见表2、图1)

图1 各组大鼠心肌组织病理切片图 (HE,×400)
表2 各组大鼠心肌组织病理学积分比较 (±s)

表2 各组大鼠心肌组织病理学积分比较 (±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
给药剂量格列喹酮/(mg/kg)贝那普利/(mg/kg)降糖舒心方/(g/kg)假手术组 20 0.22±0.05模型组 20 3.51±0.55a西药组 20 9.80 3.30 2.67±0.42a b降糖舒心方低剂量组 20 1.0 1.95±0.31a b c降糖舒心方高剂量组 20 1.2 1.58±0.27a b c F 233.522 P 0.000组别 n 积分/分
2.3 各组大鼠心肌细胞自噬及心肌组织超微结构比较 假手术组大鼠心肌肌原纤维清晰整齐,线粒体形状正常,排列整齐,无间质增生,细胞形态正常,光滑完整,自噬小体少,细胞连接紧密可见,胞体内多见含量不等的内质网。模型组大鼠心肌细胞外形不规则,心肌肌原纤维模糊,排列紊乱,横纹不清晰,线粒体增生且变形,间质纤维增生严重,自噬小体增加,突向腔面或脱落,细胞间连接扩大,内有多个空泡,细胞浆内充满肿胀的线粒体,呈空泡样改变。西药组大鼠心肌细胞数量有所减少,细胞间连接有所扩大,细胞体积部分缩小,部分不规则,有自噬小体和空泡形成,细胞间有纤体增生。降糖舒心方低剂量组大鼠心肌细胞数量基本正常,但细胞体积部分缩小,有自噬小体和空泡形成,胞体部分变形,有纤体增生。降糖舒心方高剂量组大鼠心肌肌原纤维排列整齐,间质增生少,部分细胞形态有所缩小,但胞体大部分光滑完整,胞内有少量自噬小体和空泡。(见图2)

图2 各组大鼠心肌细胞自噬及心肌组织超微结构变化 (电镜,×15 000)
2.4 各组大鼠心肌组织GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量比较 与假手术组比较,模型组大鼠心肌组织GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量均明显升高(P<0.01);与模型组比较,各给药组大鼠心肌组织GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量均明显降低(P<0.05);降糖舒心方高剂量组大鼠心肌组织GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量均明显低于西药组(P<0.05)。(见表3、图3)

图3 各组大鼠心肌组织GRP78、IRE-1 和TRAF2 的扩增曲线和融解曲线图
表3 各组大鼠心肌组织GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA 相对表达量比较 (±s)

表3 各组大鼠心肌组织GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA 相对表达量比较 (±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
给药剂量格列喹酮/(mg/kg) 贝那普利/(mg/kg) 降糖舒心方/(g/kg)假手术组 20 1.04±0.20 1.05±0.25 1.07±0.27模型组 20 7.83±0.26a 7.62±0.31a 7.45±0.35a西药组 20 9.80 3.30 4.82±0.44a b 4.84±0.42a b 4.35±0.41a b降糖舒心方低剂量组 20 1.0 4.81±0.82a b 4.64±0.84a b 4.30±0.51a b降糖舒心方高剂量组 20 1.2 3.31±0.26a b c 3.15±0.25a b c 3.11±0.35a b c F 590.182 528.207 719.619 P 0.000 0.000 0.000组别 n GRP78 mRNA IRE-1 mRNA TRAF2 mRNA
2.5 各组大鼠心肌组织LC3-Ⅱ、Beclin 1蛋白相对表达量比较 与假手术组比较,模型组大鼠心肌组织LC3-Ⅱ、Beclin 1蛋白相对表达量均明显升高(P<0.01);与模型组比较,各给药组大鼠心肌组织LC3-Ⅱ、Beclin 1蛋白相对表达量均明显降低(P<0.05);降糖舒心方低、高剂量组大鼠心肌组织LC3-Ⅱ、Beclin 1蛋白相对表达量均明显低于西药组(P<0.05),且具有剂量依赖性。(见图4~7)

图4 各组大鼠心肌组织Beclin 1 蛋白表达Western blotting 图

图5 各组大鼠心肌组织Beclin 1 蛋白相对表达量比较(±s,n=20)

图6 各组大鼠心肌组织LC3-Ⅱ蛋白表达Western blotting图
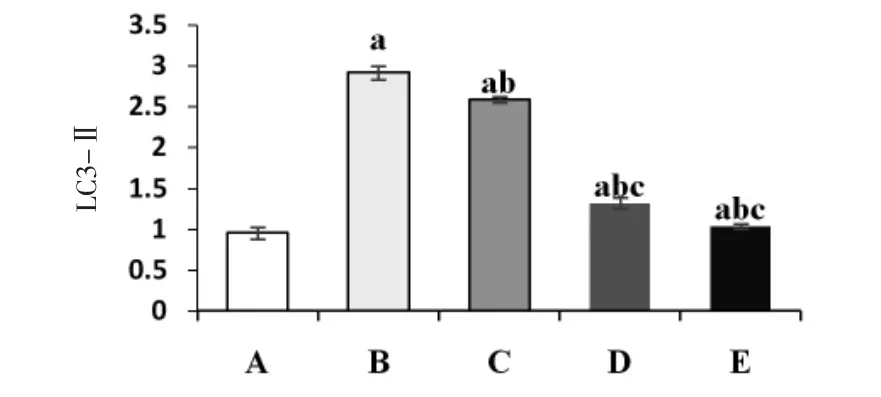
图7 各组大鼠心肌组织LC3-Ⅱ蛋白相对表达量比较(±s,n=20)
3 讨 论
自噬是一个高度保守的由溶酶体介导的细胞内蛋白质和细胞器再循环过程,可给细胞提供降解物质,维持细胞正常代谢,清除细胞内有毒物质,消化受损的细胞器,提高细胞在营养缺乏状态下的生存能力,使受损的细胞得到功能修复[8]。自噬可被细胞内环境改变,如被细胞内压力、饥饿、缺氧、应激等因子诱导。失控的过度自噬在多种疾病的发生发展中发挥重要的作用[9]。心肌细胞内质网又称肌浆网。内质网应激常常发生于代谢旺盛组织细胞,如心肌细胞等,并常常引起这些细胞功能障碍。这些细胞需要内质网处理大量的能量和细胞成分物质,因此对细胞内代谢改变和内质网动态平衡高度敏感。脂肪堆积、葡萄糖浓度增加和免疫细胞因子堆积等均容易产生ERS[10]。ERS发生时,未折叠或错误折叠的蛋白超过内质网的处理能力,自噬就会被诱导激活,作为次级反应降解累积的蛋白质,从而减轻内质网的负荷[11]。ERS与自噬的适度激活形成了机体内适应性、保护性的交互作用。而过度或持久发生ERS,ERS与自噬可发生交互作用,保护作用机制将逐渐转变为一种持续性、破坏性的作用[12]。ERS激活UPR,导致活化转录因子6(activating transcription factor 6,ATF6)、蛋白激酶样内质网应激酶(PRK-like endoplasmic reticulum kinase,PERK)和IRE-l 3个跨膜蛋白从GRP78中解离,随后解离的这3个跨膜蛋白激活自噬信号通路。IRE-1激活后,与TRAF2结合,形成IRE1α-TRAF2复合物,募集凋亡信号调控激酶1(apoptosis signal regulating kinase 1,ASK1),随后激活c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK),进而磷酸化B淋巴细胞瘤-2基因分子(B-cell lymphoma-2,Bcl-2),促进自噬基因Beclin 1与Bcl-2的分离[13]。在自噬的过程中,被降解的蛋白或细胞器转运至具有双层囊泡结构的自噬体中。Beclin l是自噬体形成过程中的一个重要分子,可介导自噬蛋白的定位及吞噬泡的形成,调控自噬体的形成,是参与自噬调控的重要基因。微管相关蛋白LC3(microtubule-associated protein 1 light chain 3,1LC3)的表达强度与自噬泡数量呈正相关[14]。1LC3前体在蛋白水解酶的作用下剪切C末端形成1LC3-I,最后经泛素样加工修饰过程成为与磷脂酰乙醇胺结合的MAP1LC3-1I,靶向定位于自噬体膜[15]。
糖尿病状态导致机体糖代谢正常途径受损,致使代谢旁路过度激活,增强了还原型辅酶Ⅱ(NADPH)氧化酶的活性,在细胞内产生过量活性氧簇(ROS)。ROS的蓄积影响内质网的稳态,使得蛋白质的空间结构折叠受阻致使未折叠蛋白蓄积,诱发ERS[16-17]。另外,病理性免疫反应也是糖尿病致病机制之一,2型糖尿病患者早期就存在细胞免疫失衡。胰岛素抵抗和胰岛素作用的相对不足是2型糖尿病患者体内天然免疫的激活因素,自身免疫系统的激活和慢性炎症参与了2型糖尿病的发生与发展[18]。患者可由于免疫网络调节失控导致糖代谢紊乱。大量因糖代谢紊乱而蓄积的代谢产物又反馈作用于机体免疫系统,加重免疫功能损伤,而异常的免疫应答又进一步加重病情发展,表明免疫紊乱与血糖水平、糖尿病病程有关[19]。因此,糖尿病CHF患者机体既受到普通CHF的免疫紊乱的侵害又受到糖尿病状态下免疫失衡干扰,致使免疫系统与各种神经激素形成的调节网路在新的、较高水平上保持着一种致损性平衡。尽管糖尿病CHF的发病机制复杂,但氧化应激状态、高糖、高脂、炎症反应和免疫失衡等病理状态均与ERS有关。ERS作为多种应激源的共同通路,将糖尿病状态下多种危险因素与心力衰竭发展联系起来,对心肌细胞的内质网应激-自噬交互作用起推动作用。内质网应激中的UPR会被持续过度激活,并通过UPR与自噬进行交互作用产生的持续性破坏作用,导致心肌细胞丢失和心脏重构,促进糖尿病CHF的发生发展[20-21]。
糖尿病(中医称消渴病)发病之初以阴伤为主,迁延日久,阴伤及气,致气阴两虚。燥热为主要兼夹之邪。气阴两虚常贯穿于消渴病发病的始终。气为之血帅,血为气之母,气虚则易至血瘀;阴虚则加剧燥热,进一步耗伤津液。燥热、痰瘀内蕴过久则成毒,因此,治法上应在滋阴益气基础上,配合活血解毒[4]。降糖舒心方由人参、黄芪、麦冬、山茱萸、生地黄、大黄、黄连、丹参、山药、五味子等10味中药组成。其中人参、麦冬、五味子是李杲《内外伤辨惑论》中滋阴、益气、生津、养心的生脉散;山茱萸、山药、生地黄是《景岳全书》治疗真阴不足的左归丸成分;大黄、黄连清热解毒,燥湿祛浊;丹参活血化瘀,养心血;黄芪益气扶正解毒。全方攻补兼施、扶正祛邪,具有滋阴益气、活血解毒之功。前期临床研究发现,降糖舒心方能减轻胰岛素抵抗,调节心肌能量代谢和抑制心肌重构,减轻心室充盈压,缩小左室舒张期末容积(LVEDV)等形态学指标,从而改善心功能[22]。
高血压引起心脏负荷过重是心力衰竭的一个重要原因。本研究显示,腹主动脉缩窄术后,增加压力负荷,产生了糖尿病合并慢性心力衰竭,致使造模成功后,内质网应激信号分子GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量均明显升高,Beclin 1、LC3-Ⅱ蛋白表达量均明显升高,提示心肌细胞中的内质网应激-自噬被激活。电镜显示心肌细胞自噬小体大量增加,空泡形成增多;病理检测显示产生心肌纤维化和心肌重构;心脏彩超显示IVSd、IVSs、LVPWd和LVPWs明显升高。说明高血压引发糖尿病性心肌病变后,心肌细胞过度自噬导致数量减少,心肌间质代偿性增多致使心肌纤维化。降糖舒心方干预后,自噬相关蛋白Beclin 1、LC3-Ⅱ降低,内质网应激标志性分子GRP78 mRNA、IRE-1 mRNA、TRAF2 mRNA相对表达量均明显降低,心肌过度自噬现象得到抑制,纤维增生减轻,心室重构得到改善(IVSd、IVSs、LVPWd、LVPWs均明显降低),由此心功能得到改善(LVEF升高)。表明调节心力衰竭时失控的心肌细胞过度自噬,可减轻心肌细胞因自噬导致的心肌细胞死亡,并抑制心肌重构,有助于心力衰竭的治疗,故调节心肌细胞内质网应激-自噬是治疗心力衰竭的新策略。降糖舒心方具有扶正解毒治疗作用,能干预内质网自噬的相互作用和联系,减轻过度自噬对心肌的损害,从而抑制心肌重构,改善心功能,并且疗效具有剂量依赖性。
