IDH1 基因在肝内胆管癌细胞HuCCT1 增殖与迁移中的作用及其初步机制
2024-03-25林美佳雷宇清叶洲杰朱丽萍王心睿黄雄飞
林美佳,雷宇清,叶洲杰,朱丽萍,王心睿,黄雄飞
1福建医科大学基础医学院病理学系,福建福州 350004;2国家卫健委非人灵长类生育调节技术评价重点实验室/福建省妇幼保健院,福建福州 350000;3福建医科大学妇儿临床医学院,福建福州 350004;4福建省儿童医院心脏外科,福建福州 350011;5福建省妇幼保健院,福建福州 350001;6福建省儿童医院,福建福州 350011;7福建医科大学附属医院福建省妇幼保健院医学研究中心,福建福州 350001;8福建医科大学消化道恶性肿瘤教育部重点实验室,福建福州 350108
肝 内 胆 管 癌(intrahepatic cholangiocarcinoma,iCCA)是指位于肝内二级胆管至最小胆管分支的被覆上皮及管周腺体发生的具有高度侵袭性的恶性肿瘤,占原发性肝癌的10%~20%[1]。近30 多年来,全球iCCA发病率和病死率皆呈上升趋势,目前其治愈的首选是根治性手术,但因早期发现困难,仅约35%的患者具有手术治疗的机会,5 年生存率<20%[2-3]。近年来,iCCA的治疗已逐渐从单纯手术过渡到以手术为基石的多学科综合治疗模式;由于iCCA发病机制尚不明确,晚期患者从综合治疗中的获益仍存在较多争议[4]。
异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)是三羧酸循环的关键酶,包含IDH1、IDH2 和IDH3三个同工酶。其中IDH1位于细胞质和过氧化物酶体中,IDH2和IDH3位于线粒体中[5-6]。iCCA具有较高频率的IDH1和IDH2基因突变[7-9],其中IDH1基因突变更常见,发生率为4.5%~55.6%[8,10-14]。针对IDH1基因突变的靶向药物治疗iCCA的相关临床试验正在进行[15]。晚期iCCA患者的药物治疗尚未出现突破性进展,药物的具体作用机制也不明确。有研究报道,IDH1可能通过诱导乙醛脱氢酶1的表达来促进iCCA细胞增殖、迁移和侵袭[16]。对IDH1基因参与调控的重要基因和信号通路的深入研究,将有助于开发更有效的iCCA靶向药物。本研究采用CRISPR/Cas9基因编辑技术和生物信息学方法探讨iCCA 细胞HuCCT1中IDH1基因的生物学功能及可能的分子机制,旨在为揭示IDH1 基因在iCCA 发病中的作用提供参考。
1 材料与方法
1.1 主要材料与试剂 人iCCA 细胞系HuCCT1 购自河南商城北纳创联生物科技有限公司。CRISPR基因敲除质粒pSpCas9(BB)-2A-Puro(PX459)保存于本实验 室;RPMI 1640 培 养 基(8121083)、胎 牛 血 清(2138109RP)、 0.25% 胰 蛋 白 酶(2192619)、 Opti-MEM® (2120763) T4DNA Ligase(00276732)购自美国赛默飞世尔科技公司;Trizol(338110)购自美国赛默飞Ambion 公司;反转录试剂盒(R323-01)、荧光定量PCR 试 剂 盒(Q511-02/03)、2xPhanta® Max Master Mix(P515-01/02/03)、5 minTMTA/Blunt-Zero Cloning Kit(L/N 7E480H0)购自南京诺唯赞生物科技股份有限公司;StbI3 感受态细胞(WD0443143)购自上海唯地生物技术有限公司;细胞周期检测试剂盒(FKRP9JT6 QT)购自武汉伊莱瑞特生物科技股份有限公司;Puromycin(QLL-38-03A)购自法国InvivoGen 公司;Matrigengel 基底膜基质(082704)购自上海诺娃医药科技有限公司;细胞基因组DNA提取试剂盒(DP304)、DNA 纯化回收试剂盒(DP214)、无内毒素质粒小提中量试剂盒(DP118)购自天根生化科技(北京)有限公司;IDH1 抗体(A13245)购自武汉爱博泰克生物科技有限公司;Wnt3a(AF8352)、β-连环蛋白(β-catenin)(AF0066)抗体购自上海碧云天生物技术有限公司;GAPDH、β-actin、E-钙黏蛋白(E-Cadherin)、N-钙黏蛋白(N-Cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶-9(Matrix metalloproteinase-9,MMP-9)抗体购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 细胞培养 HuCCT1 细胞使用含10% FBS 的RPMI 1640进行培养,培养条件为:37 ℃、5% CO2,并保持一定的湿度。
1.2.2 向导RNA(guide RNA,gRNA)的合成与设计
利用CRISPR 设计网站(http://crispr.mit.edu/)针对IDH1 的基因序列(NM_001282386.1)第4 外显子设计gRNA,在gRNA的上下游5'端分别加上Bbs Ⅰ酶切位点的黏性末端(CACC/AAAC),由福州尚亚生物技术有限公司合成引物。引物序列为:上游5'-CAC CCATGACGACCTATGATGAT-3';下游5'-AAACAT CATCATAGGTCGTCATGC-3'。
1.2.3 重组载体PX459-gRNA 的构建 稀释gRNA 上下游序列浓度至10 μmol/L,反应体系为:gRNA-F 9 μl,gRNA-R 9 μl,10×PCR Buffer 2 μl。退火形成双链,退 火 程 序 为:95 ℃ 10 min,85 ℃ 1 s,25 ℃1 min;降温至4 ℃。用T4连接酶将退火产物与经Bbs Ⅰ酶切并纯化的PX458质粒于22 ℃连接,将连接产物转化入大肠杆菌StbI3感受态细胞中,均匀涂布于含有氨苄青霉素的TB 固体平板上,37 ℃过夜培养。挑取单克隆菌落接种于含有氨苄青霉素的TB液体培养基中,37 ℃恒温振荡培养,将菌液送至福州博尚生物技术有限公司测序。
1.2.4 IDH1敲除细胞株的构建 将HuCCT1细胞铺入6孔板中,待细胞生长至80%融合时,PEI转染法将重组载体转染到细胞中,pLEGFP-N1 质粒作为阳性对照,转染8 h 后更换新鲜培养基。PX459携带嘌呤霉素抗性,转染48 h 后,使用嘌呤霉素筛选转染成功的细胞,以未转染质粒的细胞作为阴性对照。抽提敲除细胞基因组,目的片段PCR 扩增测序鉴定基因敲除情况。根据人IDH1 基因的序列(NM_001282386.1)设计验证引物,引物序列为:上游5'-ACGACCAAGTCACCAAGGA-3';下游5'-CCTATT GTGCAGCCAGTGTT-3'。送至福州博尚生物技术有限公司进行一代测序。有限稀释法获得单克隆细胞,挑取单克隆细胞进行PCR 扩增测序再次验证,5 minTMTA/Blunt-Zero Cloning Kit TA 克隆鉴定敲除株基因型,最后在mRNA和氨基酸水平验证IDH1的表达情况。
1.2.5 qRT-PCR检测 Trizol法提取对数生长期的细胞总RNA进行RNA反转录。实时荧光定量PCR检测基因相对表达量,2-ΔΔCt法对 mRNA 的定量结果进行归一化处理。所用引物序列见表1。
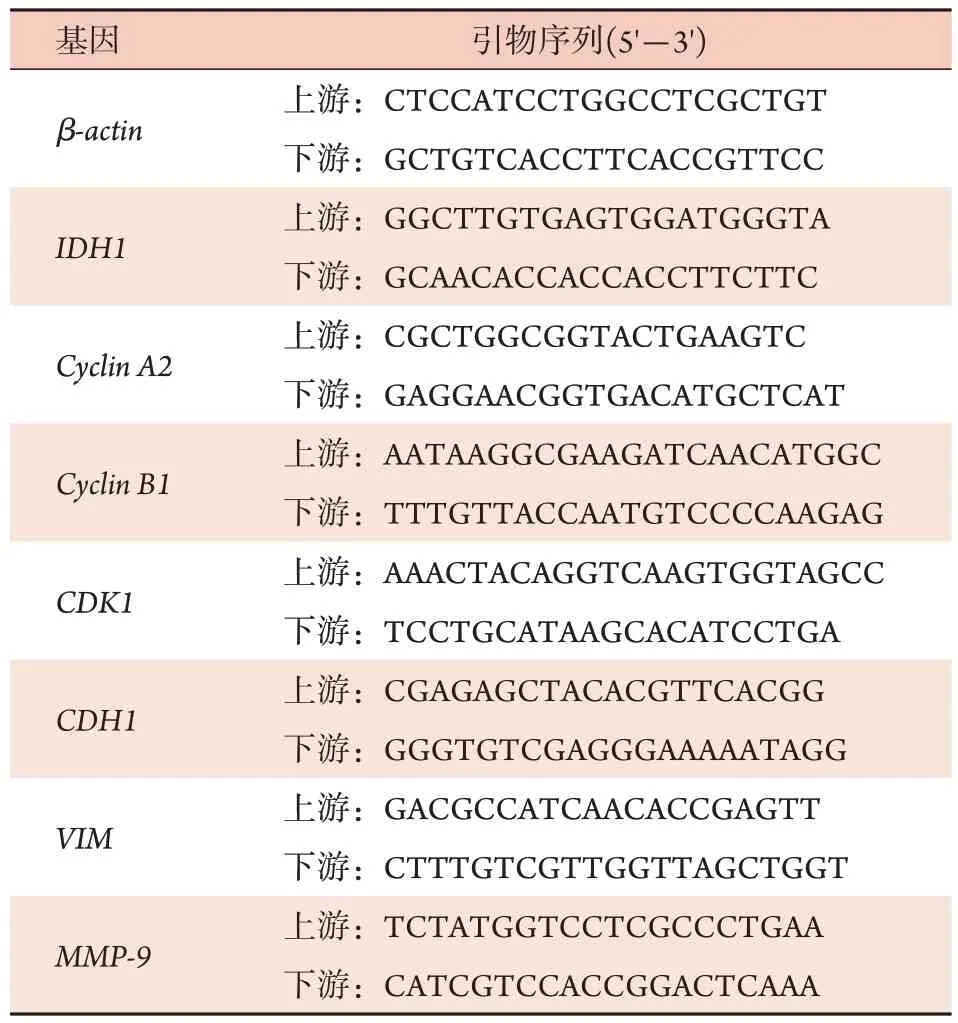
表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.2.6 Western blotting 检测细胞IDH1、E-cadherin、N-cadherin、Vimentin、MMP-9、Wnt3a和β-catenin 蛋白表达水平 收集处于对数生长期的细胞,蛋白裂解液促使细胞沉淀中的蛋白质游离至上清中,吸取上清,蛋白上清与5×上样缓冲液按照4∶1体积混合,96 ℃变性10 min,得到变性后的蛋白样品。随后上样电泳、转膜,转膜后用5%脱脂奶粉室温封闭1 h。一抗4 ℃过夜孵育,TBST 洗膜10 min×3 次,二抗室温孵育2 h,TBST 洗膜10 min×3 次,采用ECL 化学发光法显影。
1.2.7 CCK-8 细胞增殖实验 收集处于对数生长期的细胞,按2000 个细胞/孔接种于96 孔板,每组重复3 次。细胞培养一定时间后加入含10% CCK-8 试剂的RPMI1640培养基,采用酶标仪在450 nm处检测吸光度(OD)值,收集数据,根据记录的数据进行统计分析并绘制细胞生长曲线。
1.2.8 克隆形成实验 取对数生长期的细胞消化重悬,以1000个细胞/孔均匀铺于6孔培养板,正常培养9~10 d,待细胞形成肉眼可见的细胞集落后,PBS清洗,甲醇固定30 min,0.4%结晶紫溶液染色后拍照并计算克隆形成数。
1.2.9 细胞划痕实验 收集处于对数生长期的细胞,胰酶消化后吹打至单细胞悬液,调整细胞密度为5×105/L,接种于12 孔板上,置于37 ℃、5%CO2及饱和湿度条件下的细胞培养箱中培养24 h 至细胞基本融合。弃去培养基,用10 μl无菌枪头在孔板底部中央垂直划线,PBS冲洗脱落细胞,分别于0、8 h进行拍照,观察划痕愈合情况,计算划痕愈合率。划痕愈合率(%)=(0 h划痕距离-8 h划痕距离)/0 h划痕距离×100%。
1.2.10 Transwell 迁移、侵袭实验 (1)细胞迁移实验:收集处于对数生长期的细胞,Transwell 小室中各加入5×104个/孔的细胞及200 μl 1%FBS 培养基,小室外加入500 μl正常培养基。16 h后取出小室,甲醇固定30 min,0.4%结晶紫溶液染色,棉签擦拭小室内未迁移的细胞,自然风干后拍照计数。(2)细胞侵袭实验:使用加入Matrigengel 基底膜基质的Transwell 小室,培养时间为48 h,其余操作同迁移实验。
1.2.11 细胞周期检测 收集处于对数生长期的细胞各5×105个,在冰冷的PBS中洗涤一次,-20 °C、75%乙醇固定过夜。PBS 洗涤细胞后,加入核糖核酸酶(10 μg/ml),室温下用5 μg/ml 碘化丙啶染色30 min。用美国BD 公司的流式细胞仪进行流式细胞术(FCM),用Modfit 软件计算细胞周期分布。实验重复3次。
1.2.12 RNA 抽提与转录组测序 收集HuCCT1WT、HuCCT1IDH1-/-细胞,每个样品1×106个细胞,PBS 磷酸盐缓冲液清洗2 次,离心取细胞沉淀,加入1 ml Trizol重悬裂解细胞,将样品送至上海欧易生物医学科技有限公司进行RNA抽提、建库测序。抽提完成的RNA 样品使用NanoDrop 2000 测定核酸浓度,实验组与对照组各重复3 次。Illumina 建库试剂盒TruSeq Stranded mRNA LTSample Prep Kit 对质检合格的RNA 样品进行建库,构建好的文库用 Agilent 2100 Bioanalyzer 质检合格后,使用Illumina HiSeq X Ten 测序仪进行测序,产生150 bp的双端数据。
1.2.13 差 异 表 达 基 因(differentially expressed genes,DEGs)筛选 将得到的原始测序数据进行过滤筛选,得到高质量的测序数据(clean data)用于后续分析。使用软件RSEM(http://deweylab.github.io/RSEM/)分别对基因和转录本的表达水平进行定量分析,获得基因读数(read counts)后,进行样本间基因的表达差异分析。使用edgeR 根据基因读数进行差异表达水平计算,筛选条件为FDR≤0.01、差异倍数(fold-change,FC)log2|FC|>2。筛选出DEGs。
1.2.14 DEGs 的GO 和KEGG 富集分析 得到DEG后,通过使用g:Profiler 和Goatools 的功能注释工具对DEGs 进行GO 注释,并采用KEGG 数据库进行信号通路富集分析,Bonferroni 校正的P≤0.05,以判定差异基因主要影响的生物学功能或通路。对差异基因进行非监督层次聚类,利用热图的形式展示差异基因在不同样本间的表达模式。
1.3 统计学处理 采用GraphPad Prism9 进行统计分析。符合正态分布的计量资料以±s表示,组间比较采用双侧t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 IDH1基因敲除细胞株HuCCT1IDH1-/-的构建 将PX459-sgRNA 载体转染至HuCCT1 细胞,为检测细胞敲除效率,抽提嘌呤霉素筛选后的细胞基因组DNA,经PCR扩增后测序,在IDH1基因靶点序列出现套峰(图1A)。无限稀释法获得单克隆细胞株,对单克隆细胞基因组DNA 再次验证,结果显示4 号单克隆在sgRNA 序列中插入1 个碱基导致细胞基因组移码突变(图1B)。qRT-PCR 检测结果显示,与HuCCT1 细胞比较,敲除细胞株IDH1 mRNA 表达水平明显下降(P<0.0001,图1C)。Western blotting 结果显示,HuCCT1IDH1-/-细胞IDH1 蛋白相对表达量明显低于HuCCT1WT细胞(P<0.0001,图1D)。
2.2 IDH1基因敲除对HuCCT1细胞增殖的影响 与HuCCT1WT细胞比较,HuCCT1IDH1-/-细胞的增殖和克隆形成数明显减少(P<0.05,图2A、B),阻滞在G2/M期细胞的比例明显增大(P<0.01,图3A-B),且调控G2/M 周期增殖相关基因Cyclin A2、Cyclin B1 和CDK1的表达水平明显降低(P<0.05,图3C)。
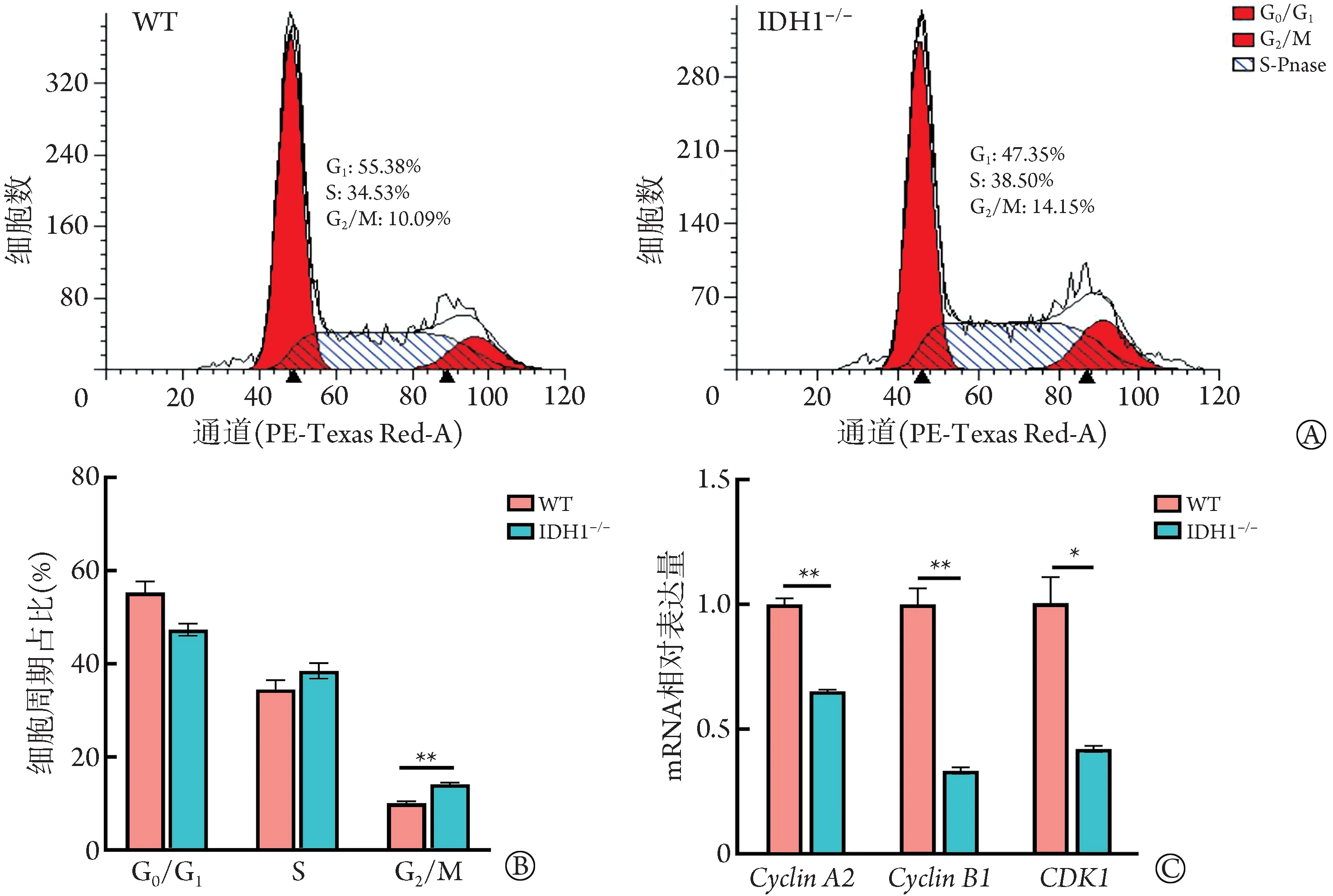
图3 IDH1敲除对HuCCT1细胞周期的影响Fig.3 Effect of IDH1 knockout on cell cycle of HuCCT1 cells
2.3 IDH1基因敲除对HuCCT1迁移、侵袭能力及上皮间质转化(epithelial-mesenchymal transition,EMT)的影响 与HuCCT1WT细胞比较,HuCCT1IDH1-/-细胞的划痕愈合率明显降低(P<0.01,图4A),迁移细胞数(P<0.001)和侵袭细胞数(P<0.05,图4B)明显减少;RT-qPCR 检 测 结 果 显 示,HuCCT1IDH1-/-细 胞EMT 相关基因Vimentin 和MMP-9 表达水平明显降低(P<0.05),编码E-Cadherin的CDH1基因表达水平明显升高(P<0.01,图5A);Western blotting 结 果 显 示,HuCCT1IDH1-/-细胞中E-Cadherin 表达水平明显升高(P<0.05),而N-Cadherin、Vimentin 和MMP-9 蛋白表达水平明显降低(P<0.05,图5B)。
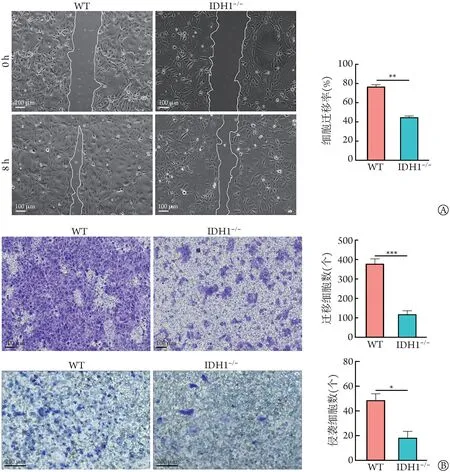
图4 IDH1敲除对HuCCT1细胞迁移、侵袭能力的影响Fig.4 Effect of IDH1 knockout on the migratory and invasive ability of HuCCT1 cells
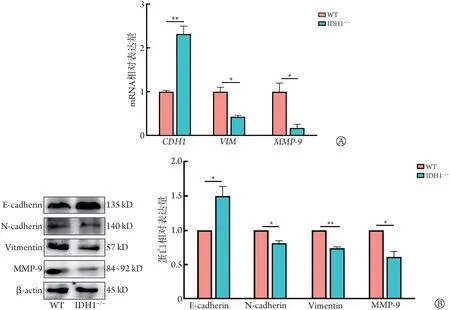
图5 IDH1敲除对HuCCT1细胞EMT的影响Fig.5 Effect of IDH1 knockout on the EMT ability of HuCCT1 cells
2.4 HuCCT1 细胞转录组测序的结果及生物信息学分析
2.4.1 DEGS分析 通过对HuCCT1WT、HuCCT1IDH1-/-细胞的转录组测序数据进行对比分析,构建DEGs的火山图(图6)。以差异倍数>2 且P≤0.01 为筛选条件,共筛选DEGS1476个,包括上调基因563个,下调基因913个。对这两组细胞之间的DEGs进行分层聚类热图分析,结果显示这两组细胞明显区分开(图7)。
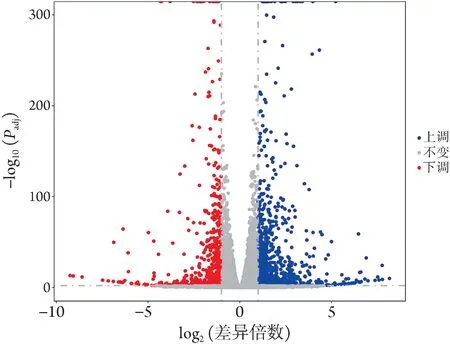
图6 HuCCT1IDH1-/-与HuCCT1WT 细胞的差异表达基因火山图Fig.6 Volcanic map of differentially expressed genes betweenHuCCT1IDH1-/- and HuCCT1WT cell
2.4.2 GO 富集分析 对HuCCT1WT、HuCCT1IDH1-/-细胞进行DEGs的GO功能分析,从基因生物学过程(BP)、细胞组分(CC)和分子功能(MF)3 个功能类单独进行进一步的分类与富集分析。在BP的差异基因主要富集外部封装结构组织、肾脏系统发育、牙齿发育与发育有关的功能;在CC的差异基因主要富集于含细胞外基质的胶原蛋白、肌膜、高尔基内腔、T-小管、细胞体膜等条目;在MF 的DEGs 则主要富集于信号受体激活剂活性、受体-配体活性、细胞因子活性、糖胺聚糖结合、生长因子受体结合等(图8)。
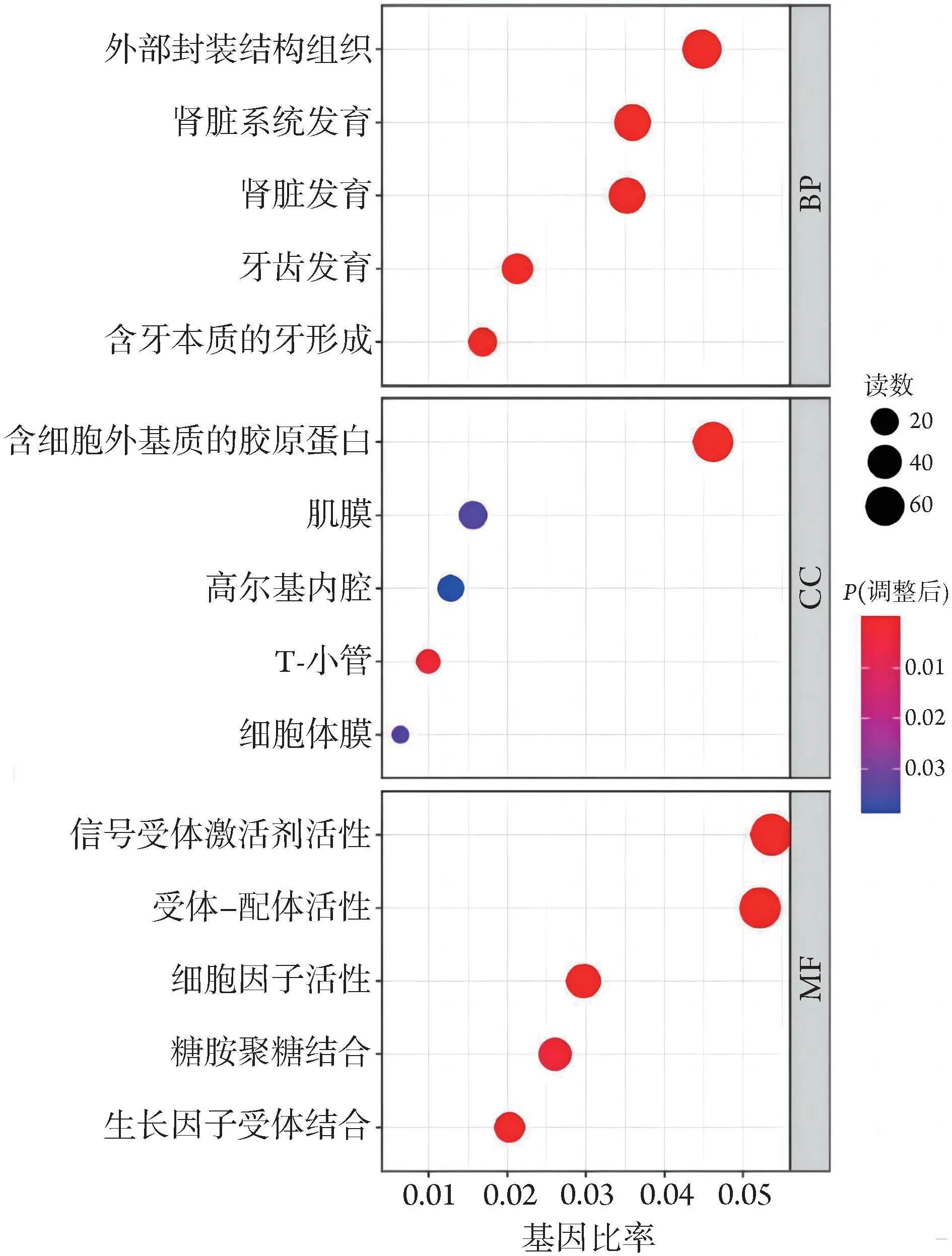
图8 HuCCT1IDH1-/-与HuCCT1WT细胞的差异表达基因GO功能分类Fig.8 GO functional classification of differentially expressed genes between HuCCT1IDH1-/- and HuCCT1WT cell
2.4.3 KEGG 信号通路富集分析 对HuCCT1WT与HuCCT1IDH1-/-细胞DEGs 的KEGG 信号通路分类及富集分析结果显示,显著富集的信号通路有14 条(P≤0.05),富集程度最高的前5个信号通路为有丝分裂 原-活 化 蛋 白 激 酶(mitogen-activated protein kinase,MAPK)信号通路、Rap1 信号通路、Wnt 信号通路、Hippo信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路(图9)。
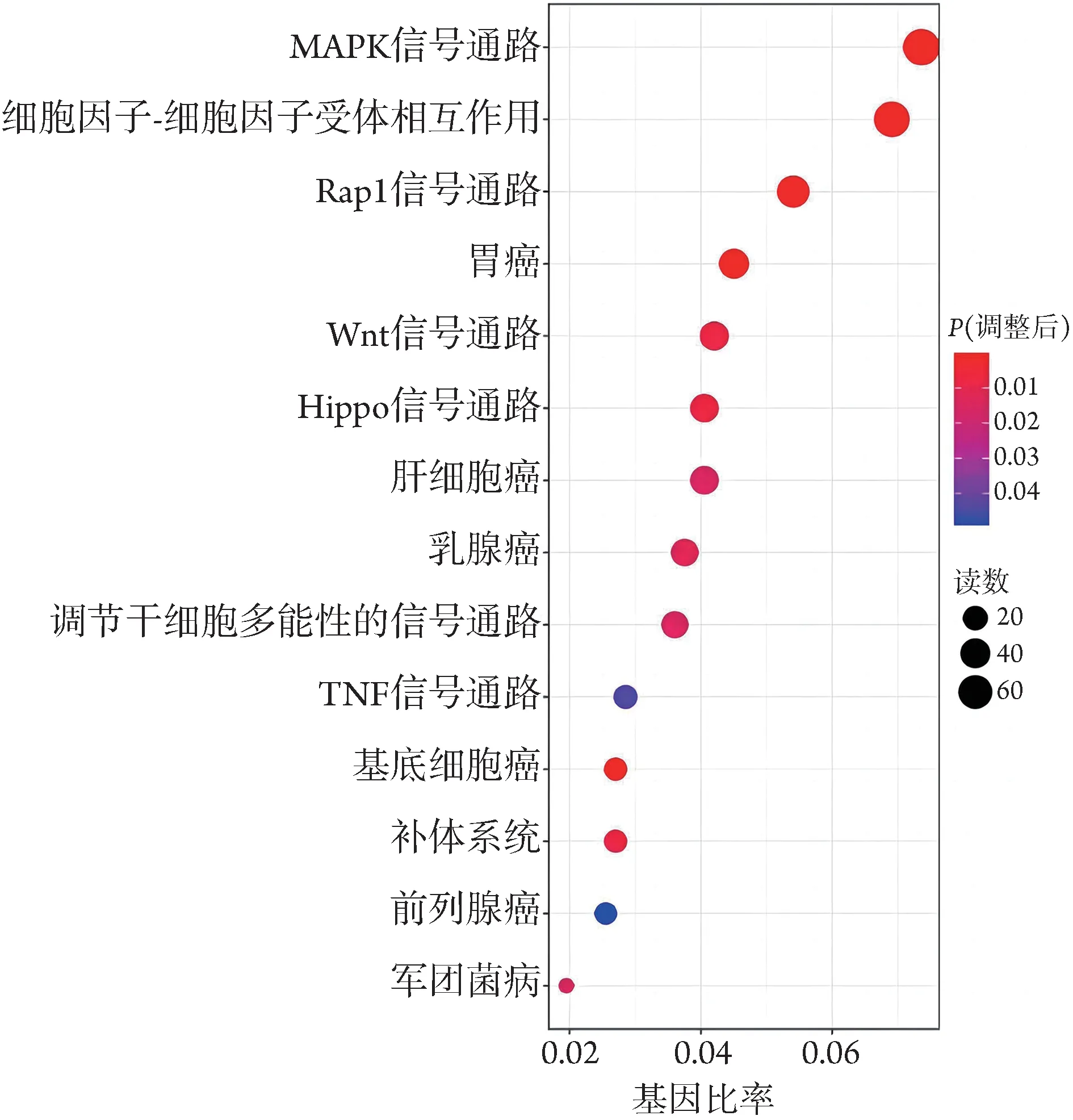
图9 HuCCT1IDH1-/-与HuCCT1WT 细胞的差异表达基因KEGG信号通路分类Fig.9 KEGG biological pathway classification of differentially expressed genes between HuCCT1IDH1-/- and HuCCT1WT cell
2.5 Wnt 信号通路中Wnt3a、β-catenin 蛋白表达情况 随机选取KEGG 分析排名前3 位的与iCCA 密切相关的Wnt信号通路进行验证。Western blotting 检测结果显示,与HuCCT1WT细胞比较,HuCCT1IDH1-/-细胞的Wnt3a 和β-catenin 蛋白表达水平明显降低(P<0.05,图10)。

图10 HuCCT1WT与HuCCT1IDH1-/-细胞的Wnt信号通路Wnt3a和β-catenin蛋白表达水平比较(Western blotting)Fig.10 Comparison of the expression levels of Wnt3a, β-catenin in Wnt signaling pathway between HuCCT1WT and HuCCT1IDH1-/- cell(Western blotting)
3 讨 论
IDH1 和IDH2 可催化异柠檬酸氧化脱羧生成α-酮戊二酸和NADPH,为细胞能量代谢和生物合成提供前体物质[6];且在葡萄糖感知通路、谷氨酰胺代谢、脂肪生成和细胞氧化还原等细胞信号转导过程中发挥重要作用[5]。当IDH1 和IDH2 基因发生突变时IDH 的酶活性也发生改变,导致细胞中肿瘤代谢物2-羟基戊二酸(2-hydroxyglutaric acid,2-HG)大量蓄积[7,17-19],可引起严重的表观遗传调控紊乱和基因表达失调[7,20],从而促进肿瘤发生。IDH1 是调控细胞代谢、表观遗传调控、氧化还原状态和DNA修复的关键酶[21];IDH1基因突变常见于胶质瘤、iCCA、急性髓系白血病(acute myeloid leukemia,AML)等肿瘤细 胞[18,22]。IDH1 R132C 是iCCA 中 常 见 的 突 变 位点[23]。有研究报道,突变型IDH1对于胶质瘤、AML的发生发展具有重要作用,IDH1 突变产物2-HG 可抑制氧戊二酸脱氢酶(oxoglutarate dehydrogenase,OGDH)活性,减少琥珀酰辅酶A(succinyl-coenzyme A,CoA)生成,从而损害血红素的生物合成,阻碍血细胞分化成熟,促进髓系肿瘤发生[24]。Saha 等[9]报道,iCCA中突变的IDH1通过产生D-2羟基戊二酸(D-2-HG)及抑制肝细胞核因子4α(HNF-4α)活性,可阻断肝脏前体细胞向肝细胞分化,促进细胞增殖。IDH1 R132S基因缺失可降低iCCA细胞人肝胆管癌细胞(RBE)的增殖、迁移、侵袭能力及EMT[20]。目前的研究关注IDH1 基因突变的致病机制较多,而IDH1基因缺失对iCCA生物学行为的影响报道较少。
本研究在iCCA 细胞HuCCT1 中利用CRISPR/Cas9基因编辑技术敲除IDH1基因。细胞功能试验显示,IDH1基因缺失可能通过影响细胞周期的调控和EMT 的过程,抑制HuCCT1 细胞的增殖和侵袭迁移。转录组学测序结果显示,HuCCT1WT和HuCCT1IDH1-/-细胞之间DEGs有1476个,显著富集在MAPK、Rap1、Wnt、Hippo、TNF 等与肿瘤细胞增殖与侵袭转移密切相关的信号通路。随机选取KEGG 分析排名前3 位、与iCCA 密切相关的Wnt 信号通路进行验证,Western Blotting检测结果显示,与HuCCT1WT比较,HuCCT1IDH1-/-细胞Wnt 通路的Wnt3a和β-catenin蛋白相对表达量明显降低。这一结果提示,IDH1基因可能通过激活Wnt/β-catenin信号通路参与调控iCCA 细胞HuCCT1 的迁移、侵袭及EMT过程。
EMT是一个复杂、可塑、可逆的细胞过程,是指上皮细胞获得间质细胞的特征,使细胞间的黏附性变弱,迁移能力增强[25]。研究显示,EMT过程参与调控胚胎发育、组织修复肿瘤的侵袭与转移、化疗耐药等恶性表型[26]。Wnt 信号通路包括Wnt/β-catenin,Wnt-PCP 和Wnt-Ca2+3 种信号通路,其中Wnt/β-catenin信号通路在调控细胞增殖、迁移侵袭、EMT 过程、细胞凋亡和自噬中发挥重要作用[27];Wnt3a 为典型Wnt 配体,与肿瘤侵袭转移密切相关[28]。Wei等[29]报道,真核翻译起始因子3H(EIF3H)可通过Wnt/β-catenin 信号通路稳定CCND1 蛋白结构,促进iCCA细胞迁移,并抑制细胞凋亡。本研究结果显示,HuCCT1细胞中IDH1缺失后细胞的迁移和侵袭能力及EMT受到抑制;转录组测序结果显示HuCCT1WT和HuCCT1IDH1-/-细胞的DEGs 在Wnt 通路上显著富集;Western blotting 检测结果显示,与HuCCT1WT比 较,HuCCT1IDH1-/-细 胞Wnt 通 路 的Wnt3a和β-catenin蛋白相对表达量明显降低,以上结果均提示IDH1基因可能通过激活Wnt/β-catenin信号通路参与调控iCCA细胞HuCCT1的增殖、迁移、侵袭及EMT过程。
本研究结果显示,HuCCT1细胞IDH1基因敲除后,细胞增殖受抑制,表现为阻滞于G2/M期。转录组测序结果显示,HuCCT1WT和HuCCT1IDH1-/-细胞的DEGs 在MAPK 通路上显著富集。MAPK 是一组进化高度保守的丝氨酸-苏氨酸激酶,常见的MAPK包括细 胞 外 信 号 调 节 激 酶(extracellular signal-regulated kinase,ERK)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 激酶。MAPK 级联反应参与多种细胞生物学过程,是调控细胞增殖、分化、凋亡及生理与病理性应激反应的关键信号通路[27-29]。已有研究报道,IDH1 基因缺失可通过活性氧激活MAPK包括ERK、JNK和p38信号通路,从而显著抑制卵巢颗粒细胞的增殖、迁移,阻滞细胞于G2/M期,促进细胞衰老[30]。HuCCT1细胞中IDH1基因缺失后是否通过MAPK 通路影响细胞周期的调控而抑制细胞的增殖能力,仍有待进一步研究。
iCCA 起病隐匿、易转移,缺乏特异性诊断指标,多数病例确诊时已属晚期,错过手术时机,加之对常规放化疗不敏感,因此该病缺乏有效的治疗手段,预后差[30-32]。目前针对IDH1基因突变的靶向药物已进入临床Ⅲ期研究,但效果不尽人意,药物的具体作用机制也不明确。本研究显示,IDH1缺失可显著抑制HuCCT1 细胞的迁移、侵袭能力和EMT过程,其机制可能与Wnt/β-catenin 信号通路有关。对IDH1基因功能的深入了解,将有助于开发新的靶向药物,提高晚期iCCA患者的疗效。
