扶正解毒方对病毒性心肌炎大鼠氧化应激及Sirt1/FoxO3a 通路的影响
2024-03-25沈延梅马驯凯
姜 花,沈延梅,马驯凯
(青海红十字医院心内科,青海 西宁 810001)
病毒性心肌炎(viral myocarditis,VMC) 指由病毒感染心脏,引起的心肌实质性或弥漫性病变[1-2],其发病机制还未完全阐明。临床报道发现,VMC 患儿心脏损伤程度与氧化应激损伤程度呈正相关[3],体内外研究证实柯萨奇病毒B3 (CVB3) 入侵心肌细胞,引起的氧化应激、凋亡激活是造成心肌细胞损伤的关键因素之一[4]。沉默信息调节因子2 相关酶1 (Sirt1) 可与叉头蛋白O3a (FoxO3a) 相互作用,抵抗氧化应激损伤,参与疾病的发生发展过程[5],但Sirt1/FoxO3a 通路在VMC 疾病过程中的作用研究较少。
近年来,中医药开始被更多用于病毒性心肌炎的临床治疗,可通过抗病毒、抗炎、抗氧化、调节免疫等机制发挥作用,疗效颇为明显[6-7]。扶正解毒方能够扶助正气,清热解毒,调节患者机体免疫功能,常用于白血病、肝癌、肺癌等肿瘤患者放化疗后的辅助治疗。有研究表明扶正解毒方用于儿童病毒性肺炎也具有较好的疗效[8-9],能够减轻炎症,改善症状,但尚无该方剂用于VMC 的报道。本院前期采用扶正解毒方治疗VMC 取得了较好疗效,但具体机制还不甚明确。因此,本研究建立大鼠VMC 模型,从Sirt1/FoxO3a 通路及氧化应激方面,探究扶正解毒方缓解VMC症状的机制,以期为扶正解毒方的开发应用提供参考。
1 材料
1.1 动物与病毒 Wistar 大鼠90 只,健康雄性,清洁级,6~8 周龄,体质量200 ~220 g,购自吉林大学实验动物中心[实验动物生产许可证号SCXK (吉) 2020-0003]。CVB3 病毒悬液由中国科学院院武汉病毒研究所王汉中教授实验室所馈赠。本实验经本院动物伦理委员会审批通过(伦理号IACUC-105000296),实验过程遵循3R 原则。
1.2 试剂与药物 扶正解毒方(党参20 g、白术15 g、茯苓15 g、黄芪15 g、黄芩12 g、连翘10 g、败酱草15 g、薏苡仁30 g、西洋参10 g、北沙参12 g、白芍12 g、五味子10 g、麦冬15 g、瓜蒌15 g、漏芦10 g、干姜10 g、炙甘草9 g) 药材购自张仲景大药房,参考文献[9] 报道进行常规煎药,浓缩成含生药量2.8、11.2 g/mL 的药液(即成人用量的1、4 倍),备用。HE 染色液(货号G1122,上海信帆生物科技有限公司); TUNEL 染色液(货号XYA114,上海信裕生物科技有限公司); 肌酸激酶同工酶(货号SNDM192,滁州仕诺达生物科技有限公司); 肌钙蛋白(货号MM-0427M1,杭州铂赛生物科技有限公司); 肌红蛋白等ELISA 试剂盒(货号XG-E101848,上海西格生物科技有限公司); 丙二醛(MDA) ELISA 试剂盒(货号YS-E8429,上海研生实业有限公司); 超氧化物歧化酶(SOD) ELISA试剂盒(货号NS7247,上海江莱生物科技有限公司); 晚期氧化蛋白产物(AOPP) ELISA 试剂盒(货号LCS30824,厦门仑昌硕生物科技有限公司); Sirt1、FoxO3a、磷酸化FoxO3a (p-FoxO3a)、SOD、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、细胞周期抑制蛋白p27、半胱氨酸天冬氨酸蛋白水解酶3 (caspase3) 抗体 (货号ab189494、ab109629、ab154786、ab83108、ab256470、ab32572、ab32034、ab184787,英国Abcam 公司)。
1.3 仪器 Gel Doc EZ 型化学发光仪(美国伯乐公司);CX43 荧光显微镜(日本奥林巴斯公司)。
2 方法
2.1 模型建立及分组 参考文献[10] 报道方法制备VMC 模型。通过超声心动图检测大鼠Tie 指数,若Tie 指数高于正常值,则认定造模成功。本研究共75 只大鼠造模成功,随机分为模型组、扶正解毒方低剂量组(28 g/kg)、扶正解毒方高剂量组(112 g/kg)、EX527 组(1 μg/kg)、扶正解毒方+EX527 组 (28 g/kg 扶正解毒方+1 μg/kg EX527),每组15 只,另取15 只大鼠,腹腔注射0.1 mL 生理盐水,作为正常组。扶正解毒方组大鼠灌胃给予2.8、11.2 g/mL 药液,剂量10 mL/kg,每天1 次; EX527 组大鼠尾静脉注射1 μg/kgEX527[10],每3 d 注射1 次; 扶正解毒方+EX527 组在灌胃给予低剂量扶正解毒方的基础上尾静脉注射EX527,各组均连续给药1 周。给药期间,监测大鼠一般状态及死亡数量等。
2.2 心功能检测 大鼠末次给药结束后,麻醉,通过彩色多普勒超声心动图检测心脏等容收缩时间(ICT)、等容舒张时间(IRT) 及射血时间(ET),计算Tei 指数用以评估心肌损伤程度,公式为Tei 指数= (ICT+IRT) /ET。
2.3 血清学指标检测 大鼠麻醉后,腹主动脉采血6 mL,按ELISA 法检测肌酸激酶同工酶、肌钙蛋白、肌红蛋白水平,以及氧化应激指标丙二醛(MDA)、超氧化物歧化酶(SOD)、晚期氧化蛋白产物(AOPP) 水平。
2.4 HE 及TUNEL 法检测心肌组织病理变化和心肌细胞凋亡率 大鼠处死后,迅速解剖获取心脏,一部分装于冻存盒冻存于-80 ℃冰箱; 另一部分采用4%多聚甲醛固定,包埋,制备5 μm 切片。取心肌组织切片,行HE 及TUNEL染色后,于显微镜下观察并拍照,计算细胞凋亡率。
2.5 免疫组化法检测心肌组织Sirt1 表达 取心肌组织切片,经脱蜡、抗原修复等处理后,加入Sirt1 一抗抗体(1 ∶500) 室温孵育3 h,加入山羊抗兔IgG 二抗抗体(1 ∶500) 室温孵育2 h,DAB 显色,于光镜下观察并拍照,通过ImagePro plus 6.0 图像系统检测单位面积内Sirt1 阳性染色(红棕色) 的平均光密度值。
2.6 Western blot 法检测心肌组织相关蛋白表达 取于-80 ℃冰箱保存的心肌组织,解冻、剪碎后匀浆,提取蛋白,BCA 法检测蛋白浓度,取100 μg 蛋白进行电泳、转膜,滴加一抗FoxO3a、p-FoxO3a、SOD、GPx、CAT、p27、caspase-3 (稀释比例均为1 ∶1 000) 及β-actin 内参抗体(1 ∶2 000),4 ℃孵育过夜,次日滴加山羊抗兔IgG 二抗(1 ∶2 000),37 ℃孵育1.5 h,显影曝光,通过Image J 软件对条带相对灰度值进行定量分析。
2.7 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以(±s) 表示,多组间比较采用单因素方差分析,进一步两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
3 结果
3.1 扶正解毒方对VMC 大鼠一般行为的影响 正常组大鼠状态正常,无死亡出现; 模型组及扶正解毒方+EX527 组大鼠有4 只死亡,解剖死亡大鼠发现心脏呈白色点状或条索状病变; 扶正解毒方各剂量组大鼠无死亡,其饮食活动均趋于正常; EX527 组大鼠死亡8 只,死亡大鼠心脏条索状病变加重,其饮食及活动量减少。
3.2 扶正解毒方对VMC 大鼠Tie 指数的影响 与正常组比较,模型组大鼠Tie 指数升高(P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠Tie 指数均降低(P<0.05),EX527 组大鼠Tie 指数进一步升高(P<0.05); 与扶正解毒方低剂量组比较,扶正解毒方+EX527 组Tie 指数升高(P<0.05),见表1。
表1 各组大鼠Tie 指数比较(±s)

表1 各组大鼠Tie 指数比较(±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只Tie 指数正常组150.28±0.01模型组111.82±0.14△扶正解毒方低剂量组150.87±0.10●扶正解毒方高剂量组150.52±0.05●▲EX527 组72.58±0.22●扶正解毒方+EX527 组111.89±0.13▲
3.3 扶正解毒方对VMC 大鼠心肌损伤标志物的影响 与正常组比较,模型组大鼠血清肌酸激酶同工酶、肌红蛋白、肌钙蛋白水平均升高(P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠血清肌酸激酶同工酶、肌红蛋白、肌钙蛋白水平均降低(P<0.05),EX527 组大鼠血清肌酸激酶同工酶、肌红蛋白、肌钙蛋白水平进一步升高(P<0.05);与扶正解毒方低剂量组比较,扶正解毒方+EX527 组大鼠血清肌酸激酶同工酶、肌红蛋白、肌钙蛋白水平均升高(P<0.05),但低于EX527 组,见表2。
表2 各组大鼠心肌损伤标志物水平比较(±s)

表2 各组大鼠心肌损伤标志物水平比较(±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只肌酸激酶同工酶/(U·mL-1)肌红蛋白/(μg·L-1)肌钙蛋白/(μg·L-1)正常组1531.24±1.5482.02±4.3114.23±1.34模型组11126.64±5.02△484.22±20.34△69.37±4.76△扶正解毒方低剂量组1593.39±3.33●303.66±15.31●40.27±3.12●扶正解毒方高剂量组1562.18±2.04●▲163.53±8.36●▲28.82±2.04●▲EX527 组7245.11±8.02●864.39±48.53●89.19±6.13●扶正解毒方+EX527 组11129.23±5.11▲488.09±20.35▲68.15±4.16▲
3.4 扶正解毒方对VMC 大鼠心肌组织病理变化及心肌细胞凋亡率的影响 HE 染色可见模型组大鼠心肌细胞水肿、胞浆疏松、坏死且淡染; TUNEL 染色可见模型组大鼠凋亡细胞核染颜色加深,心肌细胞凋亡率高于正常组 (P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠心肌细胞水肿、坏死缓解,心肌细胞凋亡率降低 (P<0.05),EX527 组大鼠心肌细胞水肿、坏死进一步加重,心肌细胞凋亡率进一步升高(P<0.05); 与扶正解毒方低剂量组比较,扶正解毒方+EX527 组大鼠心肌细胞水肿、坏死缓解,心肌细胞凋亡率升高(P<0.05),但低于EX527 组,见图1、表3。
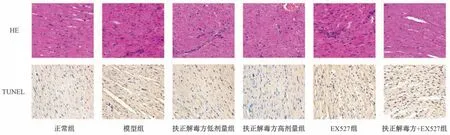
图1 各组大鼠心肌组织HE 及TUNEL 染色图(×200)
表3 各组大鼠心肌细胞凋亡率比较(±s)
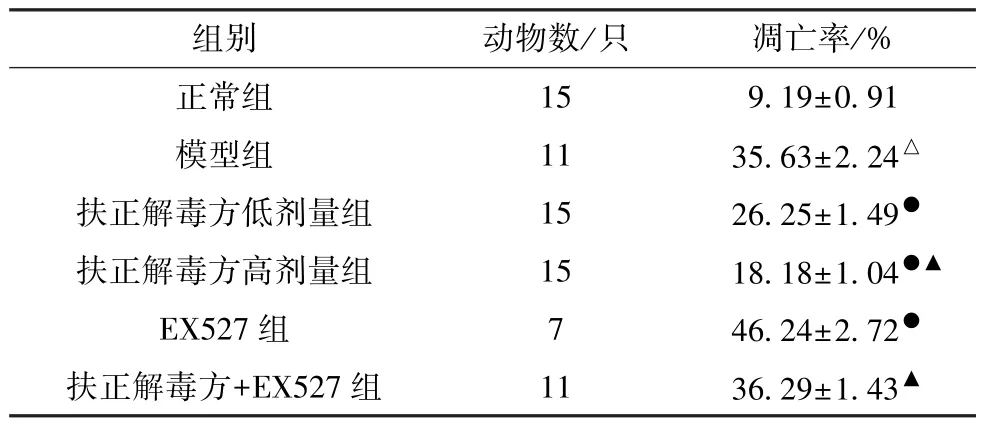
表3 各组大鼠心肌细胞凋亡率比较(±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只凋亡率/%正常组159.19±0.91模型组1135.63±2.24△扶正解毒方低剂量组1526.25±1.49●扶正解毒方高剂量组1518.18±1.04●▲EX527 组746.24±2.72●扶正解毒方+EX527 组1136.29±1.43▲
3.5 扶正解毒方对VMC 大鼠氧化应激水平的影响 与正常组比较,模型组大鼠血清MDA、AOPP 水平升高(P<0.05),SOD 水平降低(P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠血清MDA、AOPP 水平降低(P<0.05),SOD 水平升高(P<0.05),EX527 组大鼠血清MDA、AOPP水平进一步升高(P<0.05),SOD 水平进一步降低(P<0.05); 与扶正解毒方低剂量组比较,扶正解毒方+EX527组血清MDA、AOPP 水平升高(P<0.05),但低于EX527组,SOD 水平降低 (P<0.05),但高于EX527 组 (P<0.05),见表4。
表4 各组大鼠血清MDA、AOPP、SOD 水平比较(ng/mL,±s)
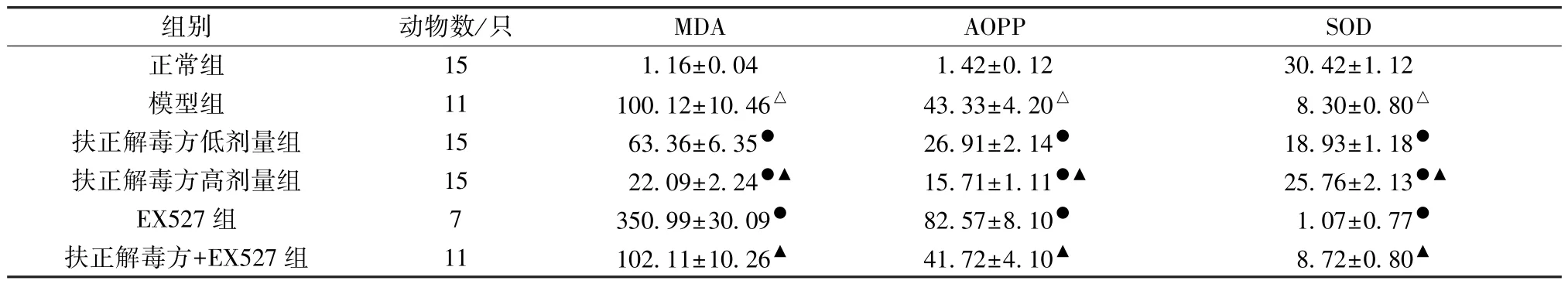
表4 各组大鼠血清MDA、AOPP、SOD 水平比较(ng/mL,±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只MDAAOPPSOD正常组151.16±0.041.42±0.1230.42±1.12模型组11100.12±10.46△43.33±4.20△8.30±0.80△扶正解毒方低剂量组1563.36±6.35●26.91±2.14●18.93±1.18●扶正解毒方高剂量组1522.09±2.24●▲15.71±1.11●▲25.76±2.13●▲EX527 组7350.99±30.09●82.57±8.10●1.07±0.77●扶正解毒方+EX527 组11102.11±10.26▲41.72±4.10▲8.72±0.80▲
3.6 扶正解毒方对VMC 大鼠心肌组织Sirt1 阳性表达的影响 正常组比较,模型组大鼠心肌细胞胞浆中Sirt1 阳性表达降低(P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠心肌细胞Sirt1 阳性表达升高(P<0.05),EX527 组大鼠心肌细胞Sirt1 阳性表达进一步降低(P<0.05); 与扶正解毒方低剂量组比较,大鼠心肌细胞Sirt1 阳性表达降低(P<0.05),但高于EX527 组,见图2、表5。
表5 各组大鼠心肌组织Sirt1 阳性表达比较(±s)

表5 各组大鼠心肌组织Sirt1 阳性表达比较(±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只Sirt1 平均光密度值正常组151.19±0.11模型组110.33±0.04△扶正解毒方低剂量组150.65±0.04●扶正解毒方高剂量组150.92±0.08●▲EX527 组70.14±0.01●扶正解毒方+EX527 组110.39±0.03▲
3.7 扶正解毒方对VMC 大鼠抗氧化应激蛋白表达的影响 与正常组比较,模型组大鼠心肌组织SOD、GPx、CAT蛋白表达降低(P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠心肌组织SOD、GPx、CAT 蛋白表达升高(P<0.05),EX527 组大鼠心肌组织SOD、GPx、CAT 蛋白表达进一步降低(P<0.05); 与扶正解毒方低剂量组比较,扶正解毒方+EX527 组大鼠心肌组织SOD、GPx、CAT 蛋白表达降低(P<0.05),但高于EX527 组,见图3、表6。

图3 各组大鼠心肌组织SOD、GPx、CAT 蛋白表达免疫印迹图
表6 各组大鼠心肌组织SOD、GPx、CAT 蛋白表达比较(±s)
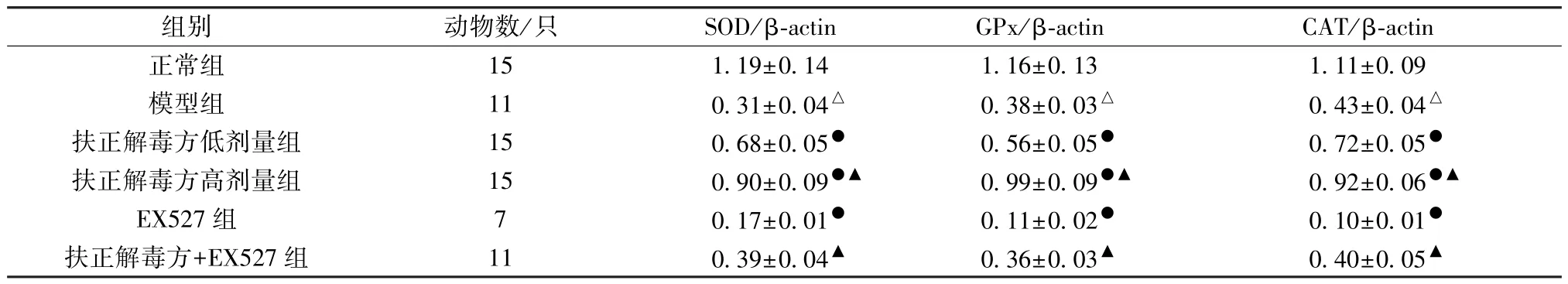
表6 各组大鼠心肌组织SOD、GPx、CAT 蛋白表达比较(±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只SOD/β-actinGPx/β-actinCAT/β-actin正常组151.19±0.141.16±0.131.11±0.09模型组110.31±0.04△0.38±0.03△0.43±0.04△扶正解毒方低剂量组150.68±0.05●0.56±0.05●0.72±0.05●扶正解毒方高剂量组150.90±0.09●▲0.99±0.09●▲0.92±0.06●▲EX527 组70.17±0.01●0.11±0.02●0.10±0.01●扶正解毒方+EX527 组110.39±0.04▲0.36±0.03▲0.40±0.05▲
3.8 扶正解毒方对VMC 大鼠FoxO3a、p-FoxO3a、p27、caspase3 蛋白表达的影响 与正常组比较,模型组大鼠心肌组织p-FoxO3a/FoxO3a、p27 蛋白表达降低 (P<0.05),caspase3 蛋白表达升高(P<0.05); 与模型组比较,扶正解毒方各剂量组大鼠心肌组织p-FoxO3a/FoxO3a、p27 蛋白表达升高(P<0.05),caspase3 蛋白表达降低 (P<0.05),EX527 组大鼠心肌组织p-FoxO3a/FoxO3a、p27 蛋白表达进一步降低(P<0.05),caspase3 蛋白表达进一步升高(P<0.05); 与扶正解毒方低剂量组比较,扶正解毒方+EX527组鼠心肌组织p-FoxO3a/FoxO3a、p27 蛋白表达降低(P<0.05),但高于EX527 组,caspase3 蛋白表达升高 (P<0.05),但低于EX527 组,见图4、表7。
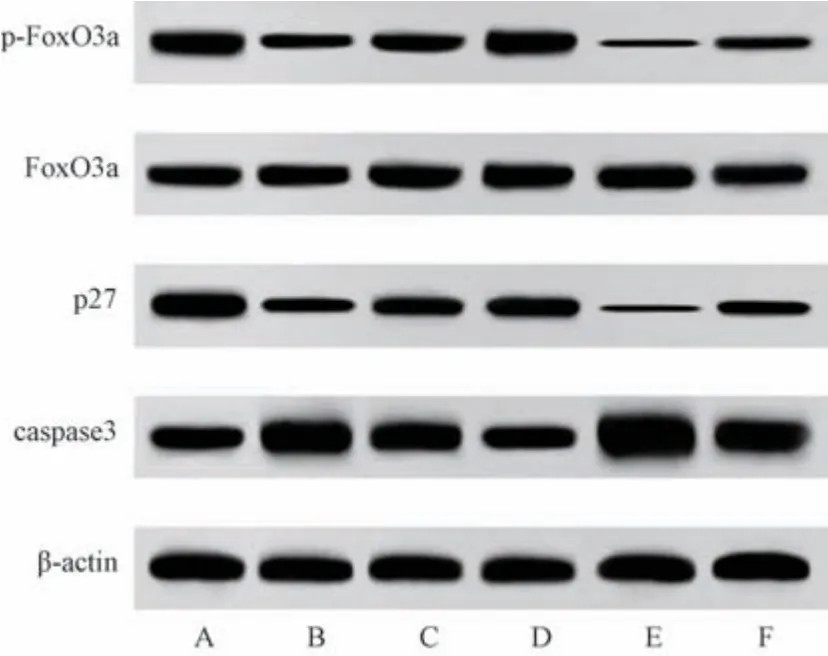
图4 各组大鼠心肌组织FoxO3a、p-FoxO3a、p27、caspase3 蛋白表达免疫印迹图
表7 各组大鼠心肌组织p-FoxO3a/FoxO3a、p27、caspase3 蛋白表达比较(±s)

表7 各组大鼠心肌组织p-FoxO3a/FoxO3a、p27、caspase3 蛋白表达比较(±s)
注: 与正常组比较,△P<0.05; 与模型组比较,●P<0.05; 与扶正解毒方低剂量组比较,▲P<0.05。
组别动物数/只p-FoxO3a/FoxO3ap27/β-actincaspase3/β-actin正常组151.15±0.091.13±0.100.92±0.10模型组110.34±0.03△0.43±0.04△1.99±0.20△扶正解毒方低剂量组150.51±0.06●0.72±0.07●1.62±0.16●扶正解毒方高剂量组150.89±0.09●▲0.96±0.08●▲1.36±0.12●▲EX527 组70.18±0.01●0.10±0.01●2.65±0.22●扶正解毒方+EX527 组110.30±0.03▲0.44±0.04▲2.08±0.20▲
4 讨论
传统医学中,病毒性心肌炎属于“心悸” “怔仲” “心水” 等范畴。本病为本虚标实之证,本虚是气阴两虚,标实是温热毒邪侵袭[11-12]。扶正解毒方中党参、黄芪补中益气; 白术、茯苓、薏苡仁、干姜健脾燥湿; 黄芩、连翘、败酱草、漏芦四药合用,清热解毒; 北沙参、西洋参补气养阴; 白芍、五味子、麦冬滋阴敛阴、养血柔肝; 炙甘草调和诸药。上述药物相互配伍,扶正与驱邪兼顾,治疗病毒性心肌炎尤为合适。
CVB3 病毒直接侵犯心肌细胞,引起细胞水肿、破裂、坏死,是引起VMC 发生的重要病因体[13-14]。Tei 指数可综合评价心肌收缩和舒张功能,在评估VMC 患儿心肌损伤程度中具有较高的应用价值[15-16]。VMC 造模后,大鼠出现死亡、心肌细胞坏死及凋亡严重现象,Tei 指数异常升高,且心肌损伤标志物水平异常升高,提示造模成功。扶正解毒方中黄芩、连翘、败酱草等具有清热解毒作用,石哲玮等[17]已证实黄芩中的活性成分汉黄芩苷可抑制CVB3 病毒引起的VMC 小鼠心肌炎症反应; 曹灿等[18]证实连翘、败酱草为治疗新冠病毒方剂中使用频率较高的中药,提示扶正解毒方在治疗VMC 领域有潜在的价值。本研究建立VMC模型后采用扶正解毒方进行干预,发现扶正解毒方可抑制VMC 大鼠死亡,缓解心肌细胞水肿、死亡及凋亡现象,扶正解毒方剂量越高,心肌损伤标志物水平释放及Tei 指数降低越显著,提示扶正解毒方可缓解VMC 大鼠心肌损伤程度。
CVB3 除直接引起心肌细胞损伤外,还促进心肌细胞内氧自由基释放,通过激活氧化应激反应来加重心肌细胞损伤[19]。匡秀锋等[3]发现VMC 患者血清中氧化应激产物MDA、AOPP 水平与Tei 指数升高成正比,并认为氧化应激指标与VMC 病情程度关系密切。本研究发现,模型组大鼠心肌细胞组织中氧化应激产物MDA、AOPP 水平升高,而抗氧化物SOD、GPx、CAT 等水平降低,提示VMC 大鼠心肌组织中存在氧化应激反应。扶正解毒方各剂量组大鼠心肌组织抗氧化应激水平升高、氧化应激产物分泌减少,且高剂量效果更佳,提示扶正解毒方可能通过提高抗氧化应激反应来缓解VMC 大鼠心肌损伤作用。
Sirt1/FoxO3a 通路与细胞氧化应激损伤及凋亡关系密切[20]。Sirt1 能够去乙酰化或磷酸化蛋白并调控多种转录因子,参与细胞氧化应激、凋亡、DNA 损伤修复等过程的调控[21]; FoxO3a 蛋白可被Sirt1 磷酸化、乙酰化和泛素化修饰降解,调控抗氧化应激指标SOD 及细胞周期抑制蛋白如p27 等表达,参与细胞氧化应激过程[22]。Sirt1 上调能够促进FoxO3a 磷酸化,进而增强抗氧化应激、抗凋亡反应,缓解组织及细胞损伤[23]。但Sirt1/FoxO3a 是否参与VMC 心肌损伤过程,还未见报道。本研究发现,Sirt1 在VMC 大鼠心肌细胞胞浆中呈弱阳性表达,FoxO3a 磷酸化水平也降低,其介导的抗氧化应激相关蛋白表达降低,心肌细胞凋亡率及凋亡相关蛋白表达异常升高; 进一步抑制Sirt1 表达后,大鼠死亡增加,心肌损伤程度、氧化应激反应及凋亡反应进一步加重,提示Sirt1/FoxO3a 通路介导的抗氧化、抗凋亡途径抑制,可能是加重VMC 大鼠心肌损伤的关键机制。扶正解毒方剂量越高,大鼠Sirt1/FoxO3a 通路激活越显著,抗氧化应激、抗凋亡效果越明显,提示扶正解毒方可通过激活Sirt1/FoxO3a 介导的抗氧化、抗凋亡途径,缓解VMC大鼠心肌氧化应激损伤。
综上所述,扶正解毒方可通过促进Sirt1/FoxO3a 介导的抗氧化、抗凋亡途径激活,缓解VMC 大鼠心肌氧化应激损伤,本研究为阐明扶正解毒方治疗VMC 的可能机制提供一定的参考。但VMC 心肌损伤机制复杂,Sirt1/FoxO3a 通路还可能与心肌细胞自噬有关,扶正解毒方缓解VMC 的其他可能机制还有待进一步探究。
