小型化抗体偶联药物及类似物的研究进展
2024-03-25余悦陈豫马宁宁
余悦,陈豫,马宁宁
(沈阳药科大学无涯创新学院,辽宁 沈阳 110016)
1 概述
肿瘤化疗源自于20世纪40年代,发展初期,药学研究者采用氮芥和叶酸拮抗剂治疗血液系统恶性肿瘤,在随后几年里发展出使用烷化药物和抗代谢物等化疗药物的疗法。癌症化疗虽然能延长肿瘤患者的缓解持续时间(duration of response,DOR),但仍面临药物非特异性毒性高、治疗窗过窄以及肿瘤耐药性增加等限制因素。20世纪70年代,基于单克隆抗体(monocloning antibody,mAb)的疗法开始出现,其结构如图1 A所示, mAb可以特异性结合癌细胞上的抗原,靶向肿瘤细胞,减少非特异性毒性,通过改变信号传导模式或引起免疫反应发挥疗效。同时,在接下来十几年中也有研究尝试将抗体与细胞毒性药物、放射性药物或免疫毒素等进行偶联,构建抗体偶联药物(antibody drug conjugate,ADC),通过抗体部分实现对肿瘤组织的精准靶向,将毒素递送至肿瘤组织,减少全身暴露和毒性,提高疗效[1]。目前,有100多种ADC正在进行临床试验,但只有14种ADC被美国食品药品监督管理局(FDA)批准用于临床。在14种批准的药物中,7种用于治疗血液系统恶性肿瘤,7种用于治疗实体瘤。由于靶向毒性、脱靶毒性和疗效不足等情况,大多数ADC在临床阶段被终止[2]。

图1 不同偶联物骨架结构图Figure 1 Skeleton structures of different conjugates
一直以来,药物在实体瘤中的穿透性都是影响药效的重要因素。抗体和ADC在给药后,药物在肿瘤中的摄取剂量峰值不足给药剂量的0.1%[3],未达到该类药物的预期效果。一项关于表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体ch806的Ⅰ期临床试验研究表明,患者在药物注射5~ 7 d后,肿瘤摄取才达到峰值[4],存在肿瘤摄取慢的问题。其原因可能是抗体等大分子药物穿透实体瘤,需要克服血管屏障、细胞外基质屏障和抗原细胞屏障这三重障碍,即病理情况下实体瘤内血流不畅,造成有效灌注量过少;间质中细胞外基质过于致密,导致血浆对流转运速率降低;同时,靶点在肿瘤组织中的表达异常高,需要大剂量ADC去饱和肿瘤边缘形成的“结合部位屏障”(binding site barrier,BSB)[5],采用相对分子质量较小的骨架偶联毒素药物是解决该问题的一种出路,已有模型比较mAb(相对分子质量150000)、抗原结合片段(fragment of antigen binding,Fab)(相对分子质量50000,其骨架如图1C所示)、F(ab)2(相对分子质量100000)以及单链抗体(single chain variable fragment,scFv)(相对分子质量27000,其骨架如图1D所示)在不同组织中的穿透性,结果显示穿透性与其分子大小呈负相关,但模型未比较他们在实体瘤中的穿透情况[6],也有研究采用异种移植小鼠肿瘤模型考察分子量对于渗透性的影响,比较scFv、sc(Fv)2、mAb的渗透性,观察到scFv摄取和渗透最快,mAb最慢[7]。以双环肽(Bicycle)(见图1 I)为骨架的多肽偶联药物(peptide drug conjugates,PDC)BT5528在临床前研究中显示出比免疫球蛋白G(immunoglobulin G,IgG)型抗体MEDI-547 更快的肿瘤蓄积,其达峰时间仅为8 h,远低于IgG型ADC近24 h的达峰时间;且BT5528肿瘤与血浆药物浓度比可达100 : 1以上,而IgG型ADC该比值始终低于1 : 1;同时在异种移植小鼠肿瘤模型中显示,当肿瘤体积大于1000 mm3时,PDC能实现完全抑制,而IgG型ADC仅能实现部分抑制[8]。根据临床前结果显示,降低靶向偶联物的相对分子质量,可以增加其实体瘤的穿透能力,提高肿瘤组织与血浆组织药物浓度比值,降低不良反应的程度。
除了穿透性不同,IgG型ADC与相对分子质量更小的偶联物在药物代谢动力学(pharmacokinetic,PK)上也有明显的差异。IgG型抗体由于新生儿Fc受体(the neonatal Fc receptor,FcRn)的转运和保护机制,血浆半衰期得到延长[9],而片段化抗体,由于无Fc结构,半衰期主要取决于流体动力学直径(hydrodynamic diameter,HD),HD小于5 ~ 6 nm的蛋白会随尿液快速代谢;相对分子质量在30000左右的scFv,HD为5.3 nm,有74%经肾代谢,血浆半衰期为11 min, 全身半衰期为1.4 h;相对分子质量为60000的Fab,HD为6.0,仅有9%经肾代谢,血浆半衰期为28 min,全身半衰期为1.4 h;相对分子质量为60000的sc(Fv)2和相对分子质量为120000的(sc(Fv)2)2HD均大于6 nm,高于肾脏排泄阈值,血浆半衰期分别为78和170 min,全身半衰期分别为5.1和8.9 h,均低于IgG型抗体的330 min和730 h[10],PDC类药物主要利用肾进行代谢,在人体内的半衰期不超过4 h。IgG型ADC的较长半衰期,确保了更高的生物利用度,但也引起了更多负面影响,其 PK曲线类似平台期,可以在非靶器官中引起毒素释放和毒性。ADC通常通过肝代谢消除,导致在肝和胃肠道中也会存在有效载荷的释放,引起剂量限制性毒性[11]。而以PDC为代表的低分子量药物,利用肾代谢,其血浆半衰期短,可能会引起生物利用度过低,但系统暴露度低、不良反应小。PDC的较短的血浆半衰期与该类分子的高肿瘤穿透性相结合,能达到高肿瘤蓄积比,即高肿瘤内药物浓度和低血浆药物浓度。PDC药物BT5528,在临床前和临床研究中证明了其相比于同靶点IgG型ADC药物 MEDI-527,在治疗指数上明显提高[12]。除了ADC和PDC 2种极端代谢谱,小分子量偶联物可以通过白蛋白结合域融合等技术调节半衰期,在实现高肿瘤蓄积比,拓宽ADC药物的治疗窗的同时,提高生物利用度。
对于作用于实体瘤的药物来说,穿透性和PK都是需要考虑的因素,其变化都会对药物的治疗窗产生影响,本文总结了目前报道的用于治疗实体瘤的各类小片段偶联物的靶向部分的设计、毒素、偶联技术、半衰期延长手段,以及该类药物现有的临床前药效学和药代动力学结果,以期为小型化抗体偶联药物及类似物的研发提供参考。
2 小片段偶联技术
2.1 抗体片段偶联物
抗体片段偶联物(antibody fragment drug conjugate,AFDC),是scFv、Nb、Fab、diabody等通过基因工程方式改造抗体的抗体片段与毒性药物偶联构建的药物。从偶联工艺方面,AFDC的偶联技术主要集中在以下几类:1)通过连接子上的苄基鸟嘌呤(O6-benzylguanine,BG)与末端SNAP标签(O6-甲基鸟嘌呤-DNA甲基转移酶改造的蛋白)偶联;2)通过分选酶A(sortase A),将带NH2-GGG的连接子与末端带LPETG-COOH的AFDC偶联,形成LPETGGG的结构;3)使用二硫键桥连的连接技术进行偶联,即还原抗体中的二硫键后,采用与半胱氨酸选择性反应的试剂如二硫代马来酰亚胺(dithiomaleimide,DTM)对AFDC的二硫键进行重新桥连的同时引入细胞毒性药物;4)利用AFDC末端的半胱氨酸与马来酰亚胺偶联。除此之外,也有利用非天然氨基酸引入叠氮进行偶联和使用带[乙二胺铂(Ⅱ)]2+连接子与末端二硫键反应的相关报道。除抗体片段上赖氨酸与胺基进行随机偶联的非定点偶联技术外,AFDC的定点偶联部位大多集中在抗体C末端,目前AFDC涵盖有放疗药物、光疗法药物和小分子毒素偶联物,多种连接子均有报道,部分药物汇总可见表1。
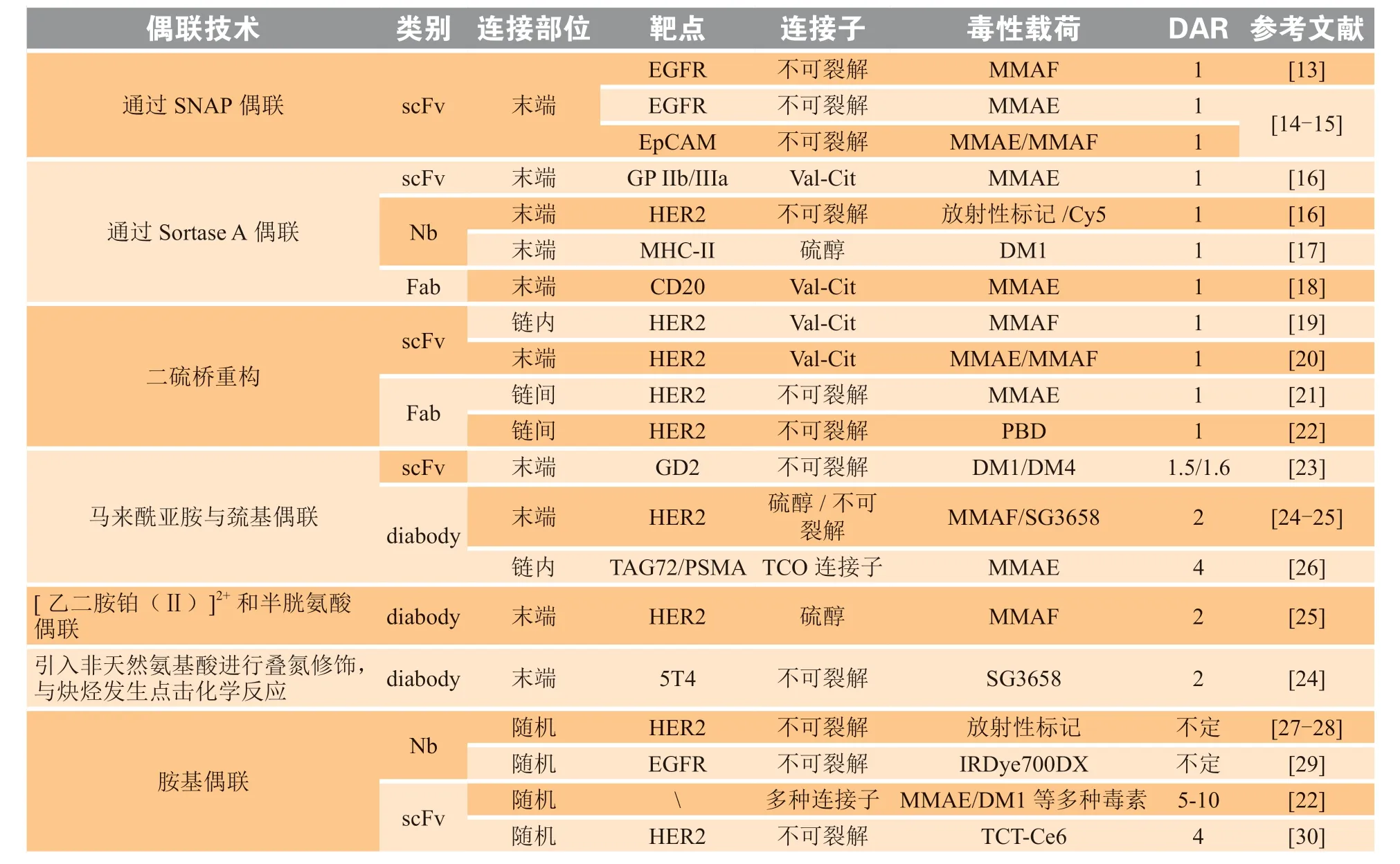
表1 部分抗体片段偶联物信息汇总Table 1 Summary of AFDC information
关于体内抗肿瘤活性方面,比较 AFDC与IgG型ADC抗肿瘤活性的研究较少,目前已报道Fab与IgG-ADC的比较中,Fab并没有显示出更强的抗肿瘤活性,DAR值为2.8的曲妥珠全长抗体偶联物与DAR值为1的Fab偶联物进行BT474小鼠肿瘤模型的药效分析时发现,Fab肿瘤抑制效果不如前者,并且在治疗后期出现肿瘤复发[21],在CD20相关抗体的小鼠肿瘤模型中也发生了类似的现象[18],这可能与Fab在血浆中代谢较快相关。
关于AFDC的半衰期延长(half-life extension,HLE)策略,常见为以下几种方式——融合人血清白蛋白(human serum albumin,HSA)、融合白蛋白结合结构域(albumin binding domian,ABD)、对抗体进行聚乙二醇化,三者利用的原理有所区别。融合HSA的结构可见图1J,延长半衰期的基本原理为,HSA 结构域Ⅲ与FcRn相互作用,从而延长半衰期[31],也有报道称HSA不会被肾小球滤过[10];ABD融合结构可见图1K,半衰期延长基本原理为融合ABD的抗体与人血清白蛋白发生动态结合,通过白蛋白参与FcRn 介导的再循环,从而延长体内半衰期[32];而抗体的聚乙二醇化主要通过改变电荷或增加分子大小,来降低肾清除率,从而改善PK[33]。Li等[24]考察了diabody与ABD 融合和聚乙二醇化2种HLE方式,两种HLE均能将抗体偶联物的半衰期从几分钟延长到几天,其在乳腺癌异种移植模型的体内研究结果表明,ABD融合偶联物比聚乙二醇化偶联物具有更高的体内肿瘤生长抑制活性和更好的耐受性,前者在19 nmol · kg-1剂量下,显示出96%的肿瘤抑制率。Xenaki等[25]考查了单剂量给药下ABD融合的AFDC 11A4-ABD-mal-AF、11A4-ABD-Lx-AF和非融合形式的11A4-mal-AF、11A4-Lx-AF的体内活性,前两者半衰期较后者提高了14.8倍,出现明显肿瘤抑制,而未融合组肿瘤持续增大,且生存期明显短于前两者,说明HLE可以在一定程度上增强小鼠肿瘤模型的药效。除了上述HLE方式,使用赖氨酸偶联方法构建高DAR值的AFDC也可能引起肾代谢变化,半衰期最高可增加10倍,但其体内药效没有报道[22]。目前上述HLE改造的偶联物均处于临床前阶段,临床表现有待进一步研究。
2.2 非抗体支架蛋白药物偶联物
2.2.1 亲和体偶联物亲和体是一类由58 个氨基酸构成的、具有反平行的三螺旋折叠的小分子量蛋白,是一种非免疫球蛋白形式的亲和蛋白,其相对分子质量为6500左右[34],结果如图1 H所示。目前,采用第一代Affibody支架构建设计的靶向人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2)的正电子发射型计算机断层显像(positron emission computed tomography,PET)诊断试剂ABY-025已进入Ⅱ期临床阶段[35]。由于相对分子质量较小,这类药物可以实现在肿瘤中快速分布和在肾脏中的快速代谢,是一类理想的靶向诊断试剂,但作为治疗性药物来说,存在着肾小管重吸收的问题[36],如果制备成偶联物,可能会增加其肾脏不良反应。在构建Affibody为骨架的靶向放疗药物时,Affibody AB公司的研发团队将Affibody骨架与ABD融合,从而延长血浆半衰期并减少肾脏的摄取[37],同时将其中的ZHER2:324优化为第二代支架ZHER2:2891,可增加其亲水性和热稳定性[34],且比较了2种在ZHER2:2891C端融合ABD的药物——放射性药物[177Lu]Lu偶联在C末端的ABY-027和偶联在ABD第14位的ABY-271,筛选出肿瘤肾脏分布比更高的[177Lu]Lu -ABY-027[38],目前正在进行与曲妥珠联合用药的体内活性研究[39],除此之外,根据Affibody AB官网显示[35],[177Lu]Lu-ABY-271正在临床申报阶段[35]。瑞典乌普萨拉大学Orlova团队也利用该类骨架,开发Affibody偶联物,在骨架末端引入半胱氨酸,制备美登木素生物碱1(mertansine DM1,DM1)、一甲基澳瑞他汀E(monomethyl auristatin E,MMAE)和一甲基澳瑞他汀F(monomethyl auristatin F,MMAF)偶联药物[40],与ABD进行融合,将部分肾脏代谢转变为肝代谢[40];在骨架末端半胱氨酸前,使用3个谷氨酸作为间隔以降低动物体内肝摄取[41-42],构建DAR为1和3的Affibody偶联物,目前DAR 为3的药物虽体内药效较好,但肝、脾、骨的非特异性摄取更多;也考察了不同结构域排列[43]、骨架与ABD间不同蛋白连接肽连接子长度的影响[44],目前,该偶联物还在进行临床前优化阶段,没有明确的最优分子。
2.2.2 预设计锚蛋白重复蛋白偶联物DARPins是一类小的单结构域蛋白(相对分子质量为14000 ~21000),其利用天然存在的锚定重复蛋白设计而成[45],其结构如图1E所示。DARPins可借助大型文库筛选,从而得到高稳定性、高可溶性和高产量的蛋白序列,其结构不需要翻译后修饰,可直接采用大肠杆菌表达[45]。根据Molecular Partners官网显示,其产量能达到15 g · L-1,稳定性能支持其在4℃环境放置数年[46]。目前,该公司研发的以血管内皮生长因子(vascular endothelial growth factor,VEGF)为靶点的非偶联DARPin药物Abicipar,由于给药后观察到的眼内炎症率相比于其他同靶点药物更高,其上市申请在2020年被美国FDA驳回[47],同时,新型冠状病毒感染期间FDA对ensovibep的紧急使用授权(Emergency Use Authorization,EUA)申请已于2023年1月25日被撤回,退回到临床开发阶段,除此之外,MP0317、MP05332个药物正在进行Ⅰ期临床试验[48]。关于DARPin偶联的放疗药物,Molecular Partners公司在2021年已与诺华合作,团队于2023年欧洲核医学协会(European Association of Nuclear Medicine,EANM)年会和美国癌症研究协会(American Association for Cancer Research,AACR)年会上公布了其研究结果,其在DARPins骨架部分进行优化,可显著降低肾小管重吸收,将肾代谢药时曲线下面积(area under curve,AUC)降低76%,同时对肿瘤内药物浓度无明显影响[49], Molecular Partners也公布了3种HLE改造DARPins的结果,但目前没有公布其HLE方式,其中,与未改造蛋白相比,最佳分布的DARPin HLE 4 h肿瘤摄取量由3.4% ID · g-1升高至8.5% ID · g-1,血浆含量由0.02%ID · g-1升高至22.9 % ID · g-1;24 h肿瘤摄取量由2.9% ID · g-1升高至19.1% ID · g-1,血浆含量由0.01% ID · g-1升高至22.9 % ID · g-1[50]。此外,关于DARPins偶联物,2019年 ImmunoGen公司在2019年的AACR会议上公布了抗EGFR DARPins PSC009、PSC106特异性偶联DGN549的结果,显示其在5 mg · kg-1的剂量下,对异种移植模型的肿瘤抑制率能达到100%,且体重减少小于20%[51],目前,该类药物偶联物均处于临床前研究阶段,无临床进展。
2.2.3 Centyrin偶联物Centyrin是一种相对分子质量为10000的无硫醇支架,基于Ⅲ型纤连蛋白结构域设计,具有高亲和力、高热稳定性和化学稳定性[52],其结构如图1G所示。目前,该支架报道的偶联物仅有抗EGFR支架偶联物,Goldberg等[53]向Centyrin支架中引入半胱氨酸,实现与MMAF的偶联,目前,该支架偶联物主要用于递送寡核苷酸药物,无体内实验结果的相关报道。
2.2.4 Abdurin偶联物Abdurins 是一种基于工程化IgG CH2结构域的小型抗体样支架,具有与FcRn受体结合的能力,有较长的循环半衰期,相对分子质量仅为15000。利用该平台筛选的抗肾上腺素A型受体2(tyrosine protein kinase receptor A2,EphA2)支架在注射4 h后即可定位于异种移植模型肿瘤中,并在肿瘤中持续积累长达 48 h以上[54]。但该支架偶联后存在一定问题,2019年蛋白工程峰会上,Peretti公布了载荷为vcMMAE的Abdurin偶联物,显示DAR为1的抗体在PC3肿瘤异种移植模型中的抑制能力较差,将DAR提高到2后,偶联物与靶标以及FcRn的亲和力出现明显的下降[55],此后无该非抗体支架偶联物的进展公布。
2.3 多肽偶联物
根据FDA定义,多肽为40个或更少的氨基酸组成的、相对分子质量为500 ~ 5000的聚合物。多肽偶联物(peptide drug conjugates,PDC)为多肽与细胞毒性药物偶联产生的一种治疗性药物或诊断试剂,根据其作用机制可分为细胞穿透肽(cellpenetrating peptides,CPP)和细胞靶向肽(celltargeting peptides,CTP),也有少部分的PDC(如欧洲上市的Melflufen)同时具有CPP和CTP的特性[55]。Cybrexa Theraputics公司的alphalexTM技术为CPP的一个成功代表,目前该平台下的SN-38偶联物候选分子CBX-12已进入临床阶段[56],该技术利用肽在低pH环境下和正常pH环境下结构不同引起的细胞穿透能力的差异,即肽在低pH下形成α-螺旋,可以穿透细胞膜,将毒素如MMAE、DM1、拓扑异构酶抑制剂等带入到细胞内,正常pH环境下不具有穿透能力[57];Melflufen这类药物发挥作用的主要机制为利用亲脂性的药物穿透细胞膜,进入肿瘤细胞后,分子上氨肽酶结合域能作为底物,和肿瘤细胞特异性表达的氨肽酶和酯酶反应,释放亲水烷基化剂,引起细胞毒性[58],这2类药物虽具有一定的靶向性,但作用机制和本文讨论的与ADC作用机制类似的小片段偶联物作用机制差别较大,故本文不再进行讨论,仅对CTP进行讨论。
从归巢肽部分的来源来看,可将CTP分为2类,一类为使用天然配体多肽或天然配体多肽改造的稳定类似物构建的传统PDC,目前进入临床阶段的PDC大部分都属于该类;另一类为通过噬菌体库等手段,筛选出的非天然多肽与毒素偶联构建的PDC。
使用天然配体多肽或将其改造为稳定类似物构建的PDC靶点主要集中在整合素(integrins)、生长抑素受体(somatostatin receptors ,SSTRs)、促性腺激素释放受体(gonadotropin-releasing hormone receptor,GnRH-R)、铃蟾肽受体[bombesin(Bn)receptor,Bn receptor][59],也有少部分低密度脂蛋白受体相关蛋白-1(lipoprotein receptor-related protein 1,LRP-1)[60],分拣蛋白1(sortilin-receptor 1,SORT1)相关药物正在研究[61],这些靶点对应的多肽和药物如表2所示。该类PDC有部分存在亲和谱较大的情况,如目前常用来靶向整合素αvβ3的由精氨酸-甘氨酸-天冬氨酸组成的序列多肽(RGD)基序,在纤维蛋白原、纤维连接蛋白、凝血酶原、替纳辛和其他糖蛋白中都有存在,可以和超过24种整合素结合[59];目前已进入临床的靶向SSTR2的PDC PEN-221,其骨架奥曲肽为SST类似物,对SSTR2的亲和力高达16 pmol · L-1,但其同样对同家族的SSTR1、SSTR3、SSTR5也具有纳摩尔级别的亲和力(310、19.8和9.6 nmol · L-1)[62],这可能是目前该类多肽选择与低毒性药物(如紫杉醇、阿霉素)或放疗药物(如177Lu、18F、68Ga、90Y、99mTc、111In)偶联的原因。
使用菌体库、肽库筛选抗体,计算机辅助药物设计的方法发现抗体,或将上述方式相结合,可能得到选择性更好的多肽,同时也能实现对不同靶点的定向筛选,使PDC不止局限在上述靶点中,如Bicycle Theraputics公司采用噬菌体库筛选的偶联DM1的BT1718和偶联MMAE的BT5528、BT8009,对人、大鼠、小鼠和灵长类动物的目标蛋白均有纳摩尔级亲和力,对同家族其他蛋白无亲和力,降低了脱靶毒性,且在临床前研究中证明,与IgG型ADC不同,上述3种药物在1000 mm3肿瘤大小的小鼠肿瘤模型中均有良好的抗肿瘤活性[63-66],目前,这3种药物均进入Ⅰ/Ⅱ期临床阶段[12]。同样也有利用文库或从头设计方法得到的多肽处于临床前研究阶段,Wang等[67]使用商业化OBOC肽库筛选出LLC2B多肽,通过二硫化物或马来酰亚胺连接子与DM1偶联,构建LLC2B-SS-DM1和LLC2B-Mal-DM1,在小鼠肿瘤模型中,DM1当量为2.0和4.0 mg ·kg-1的LLC2B-Mal-DM1和当量为0.5 mg · kg-1的LLC2B-SS-DM1都具有明显的抗肿瘤作用,在2种PDC中,LLC2B-SS-DM1比LLC2B-Mal-DM1具有更好的抗肿瘤效果,但没有采用1000 mm3肿瘤对其进行进一步验证;Geng等[68]采用计算机辅助药物设计和肽库相结合进行定向筛选的方式,设计出16聚肽库基本骨架,将筛选库库容缩小到72个肽序列,后利用该肽库筛选出亲和力为18.6 nmol · L-1的抗HER2多肽,并证明其在BT474体内外模型中的高穿透性;Zhou等[69]直接利用HER2与曲妥珠的共结晶结构从头设计多肽偶联物,筛选出亲和力为2.555 μmol · L-1的多肽,将其偶联喜树碱抑制剂,设计出有杀伤毒性的PDC。
3 结语与展望
治疗窗窄是制约ADC药物发展的一个主要因素,而实体瘤的低通透性是造成ADC药物治疗窗窄的一个重要原因。实体瘤的低通透性一方面造成仅有极少量药物达到作用部位,限制了药效;另一方面,为促进药物进入肿瘤组织,ADC需要长期保持高血药浓度,增加了正常组织的暴露度,对ADC药物形成剂量限制。降低传统ADC药物的分子量和水动力半径,是提高实体瘤通透性的一个有效手段。
目前,在小型化ADC及其类似物中只有靶向放疗药物上市,但临床和临床前药物开发呈现出百花齐放的趋势,关于AFDC的研发出现了针对不同靶点、采用不同偶联工艺、选择不同HLE方式的偶联物;以Affibody和DARPins为首的非抗体支架偶联物目前也处于积极研发中,经ABD融合的Affibody相关放疗药物已进入临床申报阶段,同时,DARPins偶联物在体外稳定性和体内分布上也展示出其肿瘤快速摄取和快速代谢的能力,且不同HLE展现出不同临床前效果;关于PDC,以Bicycle 为首的小片段偶联药物在临床前多个维度和部分临床结果上展露出靶向实体瘤的独特优势,相信不久的将来,能出现更多新的蛋白设计、偶联方式以及使用不同半衰期调节技术的小片段偶联药物,造福更多的患者。
