抗体药物在肿瘤治疗中的应用与进展
2024-03-25秦雨婷泮明珠张娟
秦雨婷,泮明珠,张娟
(中国药科大学生命科学与技术学院,江苏 南京 211198)
癌症是严重威胁人类健康和生命的疾病之一。近年来由于提前筛查及癌症治疗方法的改进,特别是抗肿瘤抗体药物等免疫疗法的进展,癌症总体死亡率逐步下降[1]。
抗体药物相较于传统化疗、放疗具有特异性高、不良反应小和预后效果良好等优点,在多种肿瘤治疗中展现出优越的抗肿瘤效果。20世纪末,Köhler等[2]利用杂交瘤技术制备了鼠源单克隆抗体,就此拉开了单抗开发的序幕。1986年,全球首个鼠源单抗药物Muromonab-分化簇3(cluster of differentiation 3,CD3)经美国食品药品监督管理局(FDA)获批上市[3]。然而由于鼠源单克隆抗体免疫原性强、半衰期短等问题,单克隆抗体药物很快进入人源化改造时期。随着抗体人源化技术、噬菌体展示技术、酵母展示技术和单B细胞技术等的快速发展,抗体逐步发展为人鼠嵌合抗体、人源化抗体以及全人源抗体[4]。抗体药物的结构模式也逐渐多样化,出现了双特异性抗体(bispecific antibody,BsAb)、抗体药物偶联物(antibody drug conjugates,ADCs)以及小分子抗体片段等多种形式。目前,抗体药物已成为全球生物药发展最快的领域之一,诞生了如阿达木单抗(商品名:修美乐)在内的数个年销售额超百亿美元的“重磅炸弹药物”。截至2023年10月,美国FDA累计批准上市的抗体药物已达130款,其中近50%的抗体疗法获批用于抗肿瘤治疗,批准的抗体疗法数量也呈现不断上涨的趋势(每年6 ~ 13个)。2022年,全球抗体药物市场规模达2200亿美元。全球抗肿瘤抗体药物市场规模在2021年达460亿美元,预计到2026年底将增长至近800亿美元[5]。
抗体药物具有极大的发展前景,本文将聚焦抗体药物在肿瘤治疗领域的最新进展,介绍不同类型抗体药物的结构类型和作用机制(mechanism of action,MOA),并总结抗体药物上市与临床应用现状,提出抗体药物在肿瘤治疗领域的发展趋势。
1 单克隆抗体药物
单克隆抗体是由单一B淋巴细胞产生、仅针对某一特定抗原表位的具有高度均一性的抗体。单克隆抗体的作用机制广泛,包括抑制受体和配体的结合[6]、直接细胞毒作用[5]、利用抗体Fc段介导免疫效应功能,主要包括抗体依赖细胞介导的细胞毒性(antibody dependent cell-mediated cytotoxicity,ADCC)、抗体依赖细胞介导的吞噬作用(antibody dependent cellular phagocytosis,ADCP)和补体依赖的细胞毒作用(complement dependent cytotoxicity,CDC)等[7],以及利用抗体阻断免疫检查点受体介导免疫激活从而发挥抗肿瘤作用等[8]。单抗药物的类型针对不同的靶点有不同的选择,当前多数单抗药物的开发都选用具有较高构象稳定性的IgG1亚型,针对表达在效应细胞上的靶点,临床上多选用不易引起ADCC、ADCP和CDC效应的IgG4亚型,如靶向T细胞的PD-1单抗。
截至2023年10月,FDA及欧盟批准上市的抗肿瘤单抗药物累计共36款(见表1)[9],覆盖20多个靶点,针对如程序性死亡受体-1(programmed death-1,PD-1)和其配体程序性死亡受体配体-1(programmed death-ligand 1,PD-L1)、细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)、上皮生长因子受体(epidermal growth factor receptor,EGFR)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、CD3、CD19、CD20等热门靶点的抗体药物占据绝大部分的市场份额。其中最热门的靶点是抑制性免疫检查点PD-1/PD-L1,在获批的35款单抗中,抗PD-1/PD-L1抗体共8款,占比近1/4。Keytruda作为全球第2款获批上市的PD-1药物,已在18个瘤种中获批30多个适应证,如黑色素瘤、经典霍奇金淋巴瘤(classic Hodgkin lymphoma,cHL)、非小细胞肺癌(non-small cell lung cancer,NSCLC)、头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)等,2022年Keytruda销售额达209.37亿元,有望超越修美乐成为新一代“药王”。CTLA-4也是当前研究最为广泛的抑制性免疫检查点之一,它能抑制T细胞的活化,下调免疫系统的应答[10]。当前全球共有2款CTLA-4抑制剂上市,2011年,首个CTLA-4抑制剂伊匹木单抗(ipilimumab)获批上市引领了免疫检查点抑制剂(immune checkpoint inhibitors,ICI)开发新浪潮。2022年10月,由阿斯利康开发的CTLA-4抑制剂Imjudo获美国FDA批准,与抗PD-L1抗体联用治疗肿瘤部位不可切除的肝细胞癌患者。
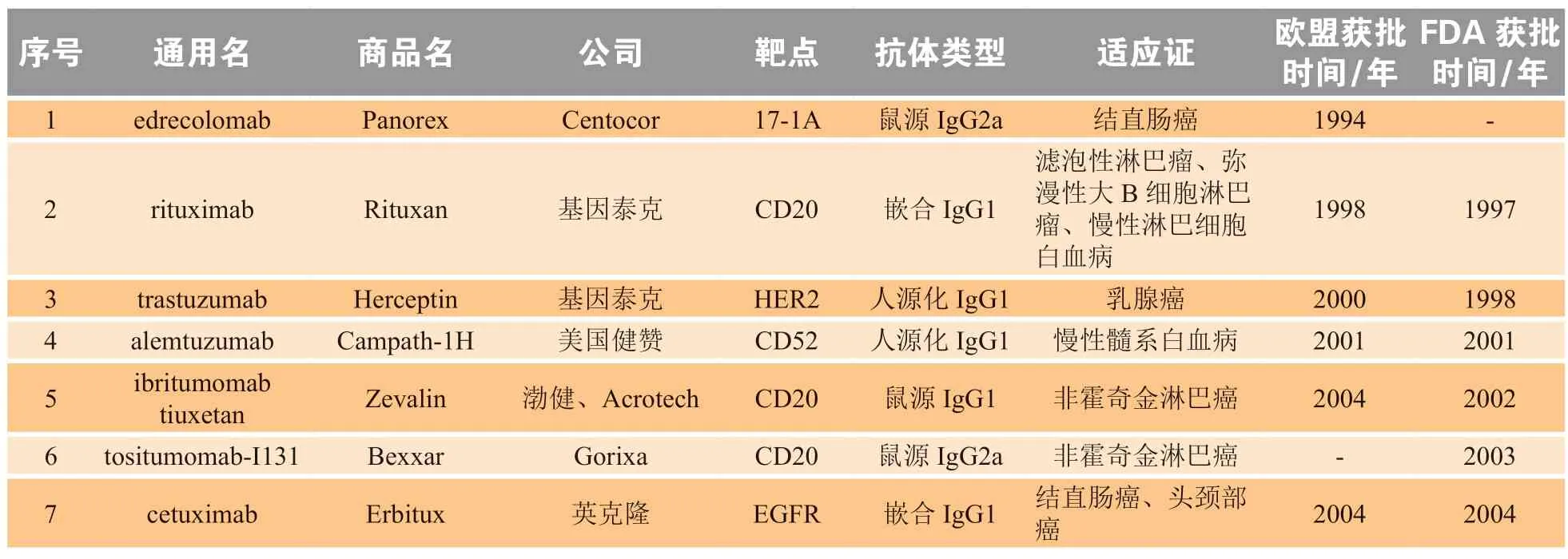
表1 FDA和欧盟批准上市用于抗肿瘤治疗的36款单抗药物Table 136 monoclonal antibodies approved for tumor therapy in the United States and EU

续表1
ICI在多个癌种中展现出强大的抗肿瘤活性。然而,即使最有效的PD-1/PD-L1单抗在临床上仅有约20%的患者响应。谁是下一代ICI成为全球关注的焦点。LAG-3、T细胞免疫球蛋白和黏蛋白结构域-3(T cell immunoglobulin and mucin domain-containing 3,TIM-3)、T细胞免疫球蛋白和免疫受体酪氨酸抑制基序结构域蛋白(T-cell immunoglobulin and immune receptor tyrosine inhibitory motif domain protein,TIGIT)、肿瘤坏死因子受体超家族成员9(tumor necrosis factor receptor super family member 9,TNFRSF9,也称为CD137或4-1BB)、肿瘤坏死因子受体超家族成员4(tumor necrosis factor receptor super family member 4,OX40)、CD47等新免疫检查点等陆续被关注,但多数分子单药给药未能超越现有PD-1和CTLA-4单抗,目前的开发均以联合用药或设计BsAb为临床应用目标[11-12]。表2总结了当前部分ICI联用抗PD-1/PD-L1抑制剂联合疗法的临床进展。比如,由百时美施贵宝公司开发的联合抗LAG-3抗体relatlimab(160 mg)和抗PD-1抗体nivolumab(480 mg,Opdivo)的固定剂量复方制剂,作为首款LAG-3单抗组合疗法于2022年3月获美国FDA批准,用于治疗不可切除或转移性黑色素瘤患者,中位无进展生存期(median progressionfree survival,mPFS)延长1倍。继CTLA-4和PD-1之后LAG-3和PD-1的联合再次肯定了双免疫疗法对肿瘤治疗可以在保证安全性的基础上表现出更优的药效[13-14]。同样,由默沙东公司开发的抗LAG-3单抗favezelimab(MK-4280)与PD-1单抗Keytruda联合疗法用于治疗复发或难治性cHL,目前正处于Ⅲ期临床(NCT05508867),据其披露的Ⅰ/Ⅱ期临床数据显示,在未接受过PD-1抑制剂治疗的患者中,favezelimab与Keytruda的联合疗法客观缓解率达73%,完全缓解率为23%,无进展生存期(progression-free survival,PFS)为19个月,展现出良好的抗肿瘤活性和可耐受的安全性[15],LAG-3与PD-1双免疫检查点抑制剂的联用组合无疑成为新的明星组合。另一个第2代免疫检查点TIGIT作为一种抑制性免疫检查点在T细胞和自然杀伤细胞(natural killer cell,NK)上表达。目前,罗氏正开发靶向TIGIT的单抗tiragolumab(MTIG7192A),尝试通过联合抗PD-1/PD-L1抗体从而协同激活T细胞,增强NK细胞介导的抗肿瘤活性[16]。Tiragolumab联合阿替利珠单抗和贝伐单抗用于治疗不可切除、局部晚期或转移性肝细胞癌(unresectable hepatocellular carcinoma,uHCC)患者的临床试验。MORPHEUS目前正处于Ⅰb/Ⅱ期临床试验(NCT04524871)[16],根据2023年美国临床肿瘤学会(ASCO)年会上公布的临床结果显示,针对uHCC的肝癌患者同时联用tiragolumab能进一步提高现有一线治疗方案(阿替利珠单抗和贝伐单抗联用)的疗效,显示出更高的客观缓解率(42.5%vs. 11.1%)和更长的PFS(11.1个月vs. 4.2个月),提示ICI和抗血管生成抑制剂的联用组合或能从不同的MOA角度产生良好的抗肿瘤效果。国内如信达生物、君实生物、百奥泰、复宏汉霖等公司也有布局TIGIT抗体,但大多处于Ⅰ期临床或临床前阶段。

表2 部分免疫检查点抑制剂联用抗PD-1/PD-L1抑制剂联合疗法临床进展Table 2 Clinical progress of immune checkpoint inhibitors combined with anti-PD-1/PD-L1 inhibitors
2 双特异性抗体药物
BsAb是指通过化学偶联、重组DNA或细胞融合的方式制备的能同时特异性结合2种抗原分子或同一抗原的2个不同表位的抗体[17]。这种混合单价抗体片段以产生多特异性抗体的思路由Nisonoff等[18]于 20世纪60年代首次提出。由于癌症的发病机制较为复杂,多种介质参与了癌症相关信号通路的激活,仅针对单一靶点特异性的癌症治疗在临床上受到较多限制[17]。针对上述问题,BsAb由于能结合2种不同的抗原或同一抗原的不同表位,理论上可产生比单抗药物更佳的疗效,作为治疗性药物迅速受到了较大的关注,以期能解决当前未得到满足的临床需求。但BsAb的稳定性和装配影响其产业化。随着抗体工程技术的跳跃式发展,不同结构模式的BsAb得以走向临床,在癌症治疗方面显示出巨大的潜力。
2.1 双特异性抗体抗肿瘤作用机制与结构
BsAb通过不同机制在癌症免疫治疗中发挥作用[19-20],包括但不限于:1)结合T细胞或其他免疫细胞,如NK细胞,以增强对靶细胞的杀伤作用,特异性地清除肿瘤细胞;2)桥接受体以阻断或激活协同信号通路,抑制或激活免疫细胞;3)靶向肿瘤细胞上的多个肿瘤抗原或不同的抗原表位以增强BsAb的结合特异性,同时减少脱靶毒性带来的不良反应。
BsAb的结构可以分为2大类:IgG样抗体形式(具有Fc结构域)和非IgG样抗体形式(没有Fc结构域)。全长的IgG样BsAb含有1个Fc结构域,可结合新生儿Fc受体(FcRn),较抗体片段具有更好的药代动力学特性,并表现出多种抗肿瘤机制,如由Fc介导的ADCC、CDC和ADCP等[21]。其设计策略主要包括杵臼结构(Knob in Hole,KIH)、CrossMab和DVD-Ig等,使不同的抗体重链和轻链能够正确配对[22-24]。与全长IgG样BsAb相比,非IgG样BsAb由于缺乏Fc结构域具有更低的相对分子质量,能更好地穿透进实体瘤发挥作用,但同时也由于缺乏Fc结构域,其血清半衰期相对较短,且缺乏Fc介导的效应功能,可以潜在地用于预防先天免疫系统的非特异性激活以及Fc介导的ADCC或CDC,这对于减轻免疫细胞参与所产生的不良反应至关重要[17]。
2.2 肿瘤免疫双特异性抗体药物研发概览
自2009年Trion Pharma公司研发的全球首款BsAb药物卡妥索单抗Removab (CD3×EpCAM)获批上市,用于治疗结直肠癌恶性腹水,它同时桥接了T细胞和肿瘤细胞,代表了BsAb治疗的一个里程碑[25],然而惨淡的销售数据使其于2017年退市。此后的10年间仅有一款BsAb上市,2014年12月安进公司研发的靶向CD3/CD19的BsAb药物Blincyto获美国FDA批准,用于治疗费城染色体阴性的复发或难治性前体B细胞急性淋巴细胞白血病[26],自此BsAb药物逐渐打开生物制药市场,进入蓬勃发展。2021年,由强生公司开发的全球第4款BsAb 药物Rybrevant获美国FDA批准上市,该BsAb靶向EGFR/细胞间质表皮转化因子(cellular-mesenchymal to epithelial transition factor,cMet),用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性NSCLC[27]。从2022年至今,BsAb药物迎来“高光”时刻,仅1年多时间里美国FDA批准上市的BsAb药物就多达8款,BsAb药物市场迎来热潮[9]。根据抗体协会(The Antibody Society)数据统计[9],截至2023年10月,FDA及欧盟批准上市的BsAb药物累计共12款,其中有10款BsAb药物用于抗肿瘤治疗(见表3)[9]。

表3 FDA和欧盟批准上市用于抗肿瘤治疗的双特异性抗体药物Table 3 Bispecific antibodies approved for tumor therapy in the United States and EU
在BsAb的开发上,主流的BsAb靶点组合可以分为3大类,即T细胞重定向类、靶向免疫检查点类(如PD-1/PD-L1、4-1BB、CD47等)以及其他类(如HER2、EGFR、VEGF等)。表4列举了目前处于临床阶段用于抗肿瘤治疗的部分BsAb药物。从在研BsAb品种的靶点组合选择来看,CD3作为能特异性靶向T细胞的靶点,成为当前最为热门的BsAb组合选择。2022年至2023年10月,美国FDA批准上市的8款BsAb药物中,有7款包含CD3靶点。与CD3组合形成BsAb的靶点以成熟靶点为主,包括CD20、B细胞成熟抗原(B cell maturation antigen,BCMA,也称为CD269)、CD19、CD33等。CD3×CD20作为目前竞争最为激烈的BsAb靶点组合之一,当前进展最快的为再生元和再鼎医药联合开发的REGN1979,用于治疗弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)和滤泡性淋巴瘤(follicular lymphoma,FL)。
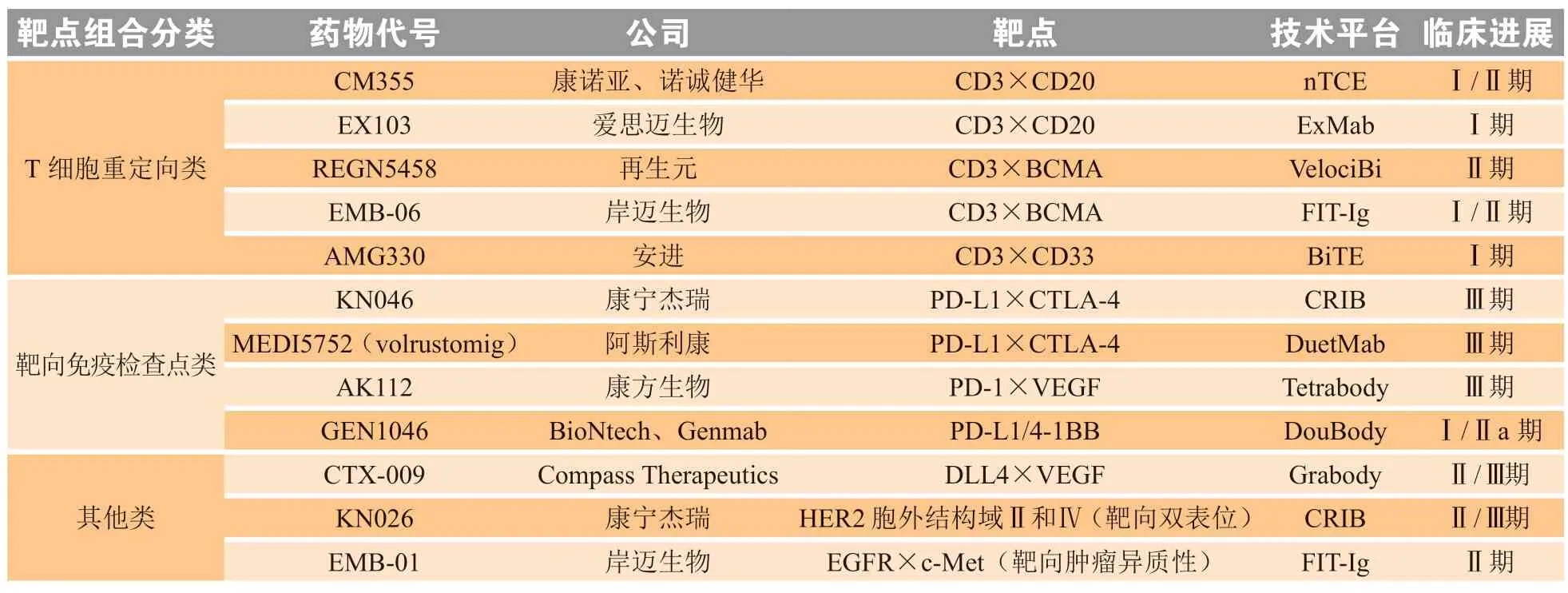
表4 部分处于临床阶段用于抗肿瘤治疗的双特异性抗体药物Table 4 Some bispecific antibodies for tumor therapy currently under clinical trials
针对靶向免疫检查点类BsAb药物的开发也是目前BsAb开发的主流方向之一,由康方生物研发的靶向PD-1/CTLA-4的BsAb卡度尼利单抗已获国家药品监督管理局(NMPA)批准上市,用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者[28]。MEDI5752是一款由阿斯利康开发的同时靶向PD-L1和CTLA-4的BsAb药物,目前针对该BsAb的多项临床试验正在进行中,适应证覆盖局部晚期或转移性非小细胞肺癌、晚期肾细胞癌、晚期胆道癌、局部晚期胃或胃食管交界处腺癌、软组织肉瘤等。靶向PD-1/VEGF的BsAb(AK112)联合化疗在治疗转移性晚期NSCLC的II期临床试验中(NCT04736823)展现出了良好的抗肿瘤活性[29]。由康宁杰瑞公司开发的同时靶向HER2胞外结构域Ⅱ和Ⅳ的 2个非重叠表位的BsAb KN026目前正在中国、美国开展多项不同阶段临床试验,适应证包括HER2阳性的转移性乳腺癌(metastatic breast cancer,MBC)[30]、晚期表达HER2的胃或胃食道结合部癌等[31]。
未来,会有更多BsAb药物进入商业化或临床开发阶段,在肿瘤治疗领域发挥越来越重要的作用。
3 抗体药物偶联物
ADCs由针对肿瘤抗原的抗体和通过连接子共价偶联的细胞毒有效载荷组成,有“魔法子弹”之称[32]。ADC在进入体内后识别并结合肿瘤细胞表面的靶抗原,ADC-抗原复合物通过受体介导的内吞作用内化进入溶酶体后,该复合物在溶酶体降解过程中释放细胞毒有效载荷破坏DNA或以其他方式抑制细胞分裂,最终杀死肿瘤细胞[33]。
3.1 抗体药物偶联物药物研发要素
在ADC药物的研究中,抗体部分主要负责将ADC的细胞毒有效载荷分子精准递送至靶细胞表面,人源化或全人源的抗体是首选的药物递送介质,其可确保高特异性靶向能力、长循环半衰期以及最小的免疫原性[32]。为了实现细胞毒有效载荷的精准递送,常规的ADC药物设计时在靶标抗原的选择上,需遵循以下几点: 1)靶标抗原主要在靶细胞上高表达,而在正常细胞上低表达或不表达; 2)靶标抗原能够将ADC药物快速内化到癌细胞中[5,34]。这些要求使ADC药物在治疗开发上能供选择的靶点有限。 目前虽然已有50多种此类靶标抗原被用作ADC临床前或临床研究[17],但研究主要集中在如实体肿瘤中的HER2、人滋养细胞表面抗原2(trophoblast cell-surface antigen 2,Trop2)、EGFR、c-Met、细胞黏附分子-4(nectin cell adhesion molecule 4,Nectin-4),以及血液肿瘤中的BCMA、CD22、CD30、CD19等几种靶点[35-37]。为了消除对高抗原表达的依赖,避免潜在的低效内化,研究人员利用实体瘤肿瘤相关细胞外基质开发了非内化ADC药物。当非内化ADC药物与内化较差的抗原或其他肿瘤成分结合时,细胞外蛋白酶和细胞外基质的其他成分(如酸性介质或还原性谷胱甘肽)可有效切割连接子释放细胞毒有效载荷,发挥抗肿瘤作用。这极大地拓展了癌症靶点的选择范围[38]。由Abbvie公司研发的ABBV-085就是一款靶向肿瘤和其基质共享抗原富含亮氨酸重复蛋白15(leucine rich repeat containing 15,LRRC15)的非内化ADC,其连接子能在肿瘤微环境的特殊理化环境中响应断裂,释放药物到肿瘤细胞外基质中,在多个动物模型中展示出优越的抗肿瘤药效[39]。
ADC的细胞毒有效载荷是一种能够有效杀死细胞的强效药物,通常选择对癌细胞具有高效力但脱靶毒性较低的细胞毒性化学制剂[16],其主要分为2大类:1)DNA损伤剂。可结合DNA中的小凹槽,通过DNA切割、DNA烷基化或中断DNA复制导致细胞死亡,如卡奇霉素、SN-38、Dxd、吡咯苯二氮卓(pyrrolo benzodiazepines,PBD)等[40-43];2)微管蛋白抑制剂。可抑制微管蛋白聚合,引发G2/M期细胞周期阻滞和随后的细胞凋亡,包括一甲基澳瑞他汀E(monomethyl auristatin E,MMAE)、一甲基澳瑞他汀F(monomethyl auristatin F,MMAF)、美登素(mertansine,DM1)等[44-46]。但随着第一三共和阿斯利康共同开发的ADC药物优赫得(Enhertu)的巨大成功[47],越来越多低毒性的小分子进入到了ADC领域,如针对拓扑异构酶的喜树碱类[42]、RNA聚合酶抑制剂等[48]。
将细胞毒有效载荷与抗体共价结合的连接子也是ADC的重要组成部分。根据细胞毒有效载荷的释放机制,连接子分为可切割连接子和不可切割连接子。可切割连接子能有条件地响应肿瘤微环境或细胞内环境,如低pH值、蛋白质水解或高谷胱甘肽浓度,从而在肿瘤细胞内被快速裂解,如腙键、二硫键和肽类接头等[17]。而不可切割的连接子依赖于抗体的完全溶酶体降解来释放细胞毒有效载荷,常见的如硫醚连接子[49]。理想的连接子应具有较好的稳定性,并能在ADC进入肿瘤细胞后快速释放有效载荷。连接子还需要保持适当的亲水性,在与疏水性的有效载荷偶联后避免ADC药物的聚化[32]。针对连接子水溶性低导致的药物聚化、偶联效率低、脱靶毒性等问题,在连接子中引入具有高水溶性的聚乙二醇(polyethylene glycol,PEG)链或聚肌氨酸(polysarcosine,pSAR)链是当前连接子优化的一个方向。
将抗体与细胞毒有效载荷偶联的方法主要有随机偶联和定点偶联。偶联方式直接决定了药物的药物抗体比值(drug-to-antibody ratio,DAR)、载药分布、产物稳定性、均一性等属性。随机偶联主要通过化学手段将小分子毒素与抗体上的赖氨酸残基或半胱氨酸残基进行偶联,所得偶联物为混合物,DAR值不均一,批间差异较大[50-51]。而目前常用的定点偶联方式通过化学修饰、酶修饰或基因工程技术进行位点特异性偶联,产物均一性较好,DAR值分布高度集中,如ThiomabTM技术[52]、SMARTagTM技术[53]、ThioBridge®技术[54]等。
3.2 抗体药物偶联物药物研发概览
2000年,首款ADC药物Mylotarg获批上市[55],用于治疗CD33阳性的急性髓系白血病,但因其安全性问题,于2010年从美国撤市,随后在2017年以降低剂量的方式被FDA批准重新上市。时隔11年之后第2款ADC药物Adcetris于2011年被美国FDA获批上市,用于治疗霍奇金淋巴瘤以及全身性间变性大细胞淋巴瘤。此后十余年ADC药物获得快速发展,多款ADC药物陆续获批上市,作为一种新型治疗药物在抗肿瘤治疗领域获得广泛认可,也被认为是全球生物医药领域研发热点之一。2019年,由日本第一三共公司开发上市的第2款靶向HER2的ADC药物德曲妥珠单抗[trastuzumab deruxtecan,DS-8201,Enhertu]的上市掀起了ADC药物开发的热潮。截至2023年10月,全球共有15款ADC药物获批上市(见表5)[9],2020年以后就有7款获批,其中有7款ADC药物适应证为血液瘤,靶点包括CD19、CD22、CD30、CD33、CD79b和BCMA;8款ADC药物适应证为实体瘤,靶点包括HER2、Nectin-4、Trop2、EGFR、组织因子(tissue factor,TF)和叶酸受体α(folate receptor alpha,FRα)。2022年ADC药物全球销售额达到67.8亿美元,超过140个ADC药物处于临床试验阶段[56],具有广阔的发展前景,国内外各大药企争相布局。
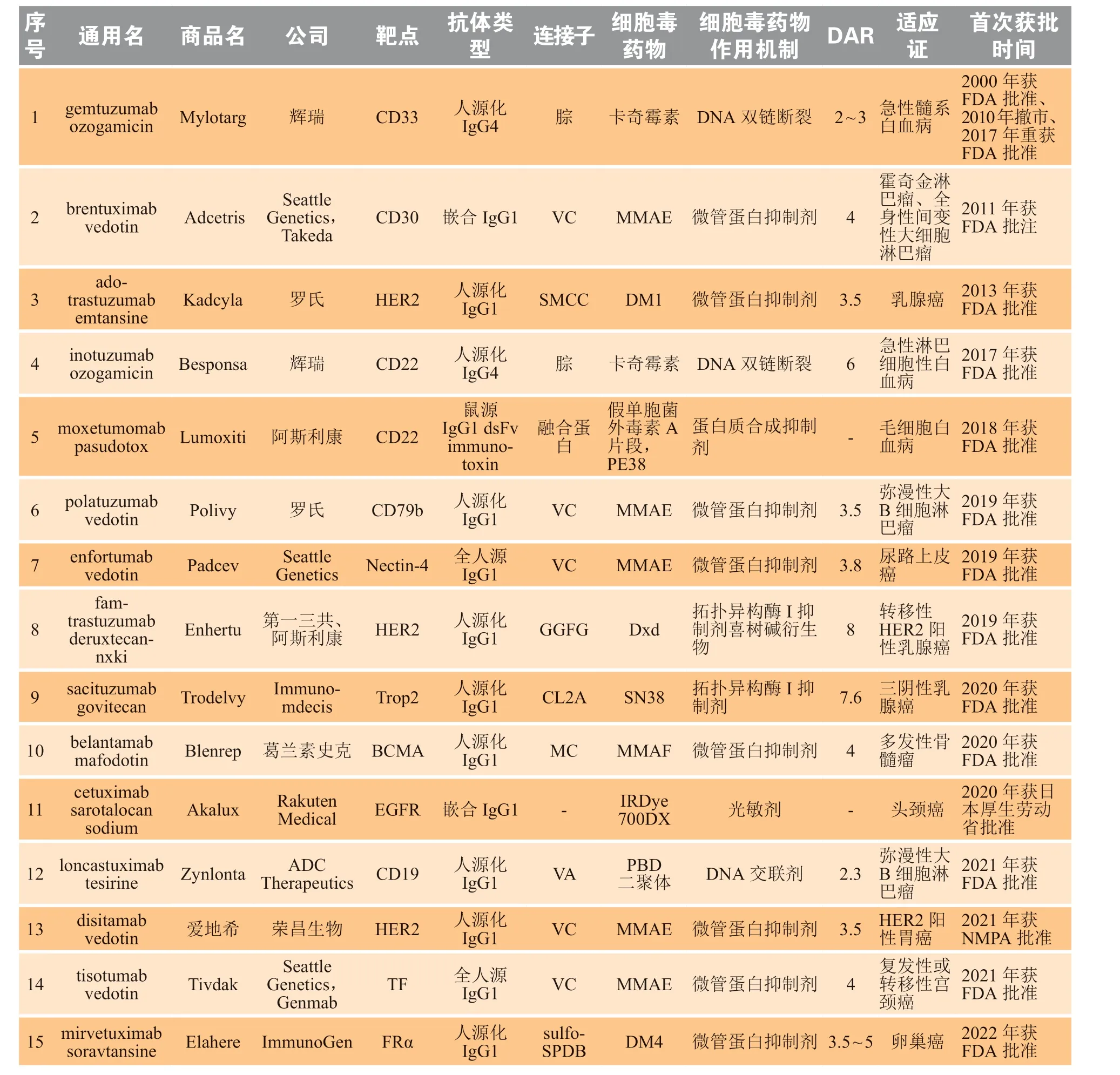
表5 全球已上市抗肿瘤治疗ADC药物Table 5 ADCs approved for cancer therapy around the globe
Enhertu是最受瞩目的新一代ADC药物,2019年12月21日,基于DESTINY-Breast01的研究数据[57],Enhertu首次被美国FDA获批上市,用于HER2阳性乳腺癌的后线治疗。Enhertu由人源化抗HER2单克隆抗体、亲水可裂解的四肽连接子(glycine-glycine-phenylalanine-glycine,GGFG)和拓扑异构酶Ⅰ抑制剂喜树碱衍生物DXd组成,其小分子毒素DXd能结合拓扑异构酶I和DNA形成稳定复合体,诱导DNA损伤并导致肿瘤细胞凋亡,同时还具有极强的膜穿透性,能穿透至邻近细胞进行杀伤从而发挥旁观者效应[58-59]。Enhertu是目前唯一DAR值达到理论最高值8的ADC,具备精准靶向和高效低毒双重优势,后续FDA又逐步批准其用于其他适应证治疗,包括HER2阳性局部晚期或转移性胃癌和胃食管结合部腺癌[59]、不可切除或转移性HER2低表达乳腺癌[60]、HER2阳性非小细胞肺癌[61]等。由荣昌生物开发的爱地希作为我国首款ADC药物于2021年6月获NMPA批准上市,用于治疗HER2阳性的胃癌[62]。
现阶段针对ADC药物的开发主要围绕HER2、Trop2、EGFR、BCMA、FRα、Claudin18.2、cMet、Nectin-4和CD家族等相对成熟的靶点,主要用于抗肿瘤治疗。表6列举了部分正处于临床研究阶段的用于抗肿瘤治疗的ADC药物,HER2-ADC仍然是最热门的赛道,Trop2紧随其后。由第一三共和阿斯利康联合开发的靶向Trop2的ADC药物DS-1062目前正处于Ⅲ期临床。由艾伯维开发的靶向c-Met的ADC药物ABBV-399在联合第1代EGFR靶向药厄洛替尼治疗携带有c-Met突变、EGFR突变/EGFR野生型的NSCLC患者的临床试验中展现出了良好的抗肿瘤活性和较好的安全性(NCT02099058)[63]。针对ADC药物研发HER2赛道内卷的束缚,我国多个企业如荣昌生物、多禧生物、礼新医药等也正进行ADC药物差异化研发布局。

表6 部分处于临床阶段用于抗肿瘤治疗的ADC药物Table 6 Some ADCs for tumor therapy currently under clinical trials
3.3 抗体药物偶联物联合疗法
ADC药物在抗肿瘤治疗领域展现出优越的前景,但由于耐药机制,ADC药物与大多数细胞毒药物一样作为单一疗法发挥临床效果的持续时间有限。因此,寻求ADC药物联合疗法也是当前研究的热点。ADC药物的联合疗法主要包括4种[64]:1)能导致细胞周期停滞或抑制DNA修复的化疗药物。此类药物能损伤DNA活性,抑制细胞周期进程,能与具有细胞毒性有效载荷的ADC药物发挥协同作用,化疗也可能导致ADC靶向的表面抗原上调;2)分子靶向药物。联合使用ADC药物和分子靶向药物可以同时阻断多条致癌通路,或双重阻断一条特定途径,从而更有效地抑制下游信号传导;3)抗血管生成药物。此类药物可以导致肿瘤血管正常化,有助于提高ADC药物在肿瘤内的传递;4)免疫治疗。ADC药物携带的细胞毒药物通过不同的机制更倾向于免疫监视而不是免疫耐受,包括巨噬细胞重编程、树突状细胞和T细胞激活以及PD-L1表达的增加等,基于这些变化,将抗PD-1/PD-L1抗体、抗CTLA-4抗体等ICI与ADC药物组合可增加这些免疫治疗药物的疗效。在一项关于靶向Nectin-4的ADC药物enfortumab vedotin(Padcev)联合PD-1抑制剂一线治疗顺铂不耐受的局部或晚期转移性尿路上皮癌的临床试验EV-103中,有93%的患者在接受了该联合疗法后,肿瘤发生消退[65]。一项BEGONIA的临床研究中Enhertu联合PD-L1抑制剂也显示出较好的抗肿瘤效果以及良好的安全性[66]。多种ADC药物与化疗药物联用,如一款靶向FRα的ADC药物Elahere与卡铂在卵巢癌模型中联合疗法取得成功[67]。Enhertu与DNA损伤修复抑制剂联用的相关临床研究正在进行中,如Enhertu与共济失调毛细血管扩张突变基因Rad3相关激酶(ataxia-telangiectasia and Rad3-related,ATR)抑制剂AZD6738(NCT04704661)[68]的联用组合。
4 结语与展望
抗体药物以其高特异性、高有效性、长半衰期以及相比于小分子药物更高的安全性等独特的优势在近十几年迅速崛起,已成为全球药物研发的热点领域。抗体药物市场表现亮眼,2021年全球抗体药物市场达到2173亿美元,预计在未来10年内将以约15%的年增长率增长,是当前制药市场增长最快的细分市场之一。
从首款单克隆抗体药物上市至今的数十年间,单克隆抗体药物以其独特的作用机制和高效性,在恶性肿瘤的治疗中发挥着重要的作用,其中以PD-1/PD-L1、CTLA-4等靶点最为亮眼,产生了多款“重磅炸弹”级别的药物。但从单抗药物发展整体上看,适合成药的抗体靶标十分有限,且多数靶点的单抗药物单药疗效无法超越现有PD-1/PD-L1和CTLA-4单抗,因此,针对老靶点的深度开发、寻求单抗药物新靶点和新适应证、以单抗药物为基础进行如BsAb药物设计是目前单抗药物研发所需要追求的目标。同时尝试单抗药物和其他免疫疗法的联用组合也是未来5 ~ 10年间单抗药物发展的主要趋势,如ICI联用抗血管生成抑制剂、ADC药物或开发其他联用可能,进行靶向治疗升级版,延长如PD-1/PD-L1抑制剂此类“重磅炸弹”单抗药物的生命周期,寻求单抗药物发展新的突破。未来也期待基础科研人员和各大科研院所对抗体药物进行更多的机制研究,从而为临床用药提供更有力的支持。
BsAb药物市场于近几年迎来蓬勃发展,美国FDA批准的9款BsAb药物中有8款于近3年获批,其市场具有较大发展前景。在BsAb药物的临床设计上,需充分挖掘BsAb药物较单抗产品、单抗联合用药的临床优势,选择创新优势靶点组合。同时创新多种结构模式的BsAb药物,力求实现新突破。多特异性抗体药物也是抗体药物领域未来发展的方向之一,国内外多个企业均有布局。
ADC药物对临床肿瘤的治疗格局已产生深远的影响,以Enhertu为代表的药物带动ADC市场规模的快速扩大,未来5~10年内,ADC药物无论从数量还是质量上都将有较大飞跃。非内化ADC扩大了癌症靶点的选择范围,可避免潜在的低效内化,是未来ADC药物发展的另一种选择。双抗ADC结合了BsAb和ADC的优势,具有更低的脱靶毒性和更高的特异性。近期,由百利天恒公司开发EGFR/HER3双抗ADC(BL-B01D1)作为国内首款双抗ADC新药出海成功,将与百时美施贵宝合作推动BL-B01D1的开发和商业化,其潜在总交易额最高可达84亿美元,双抗ADC药物也是未来值得关注的方向之一。在ADC药物小分子毒素的创新上,除当前常规应用的微管蛋白抑制剂和DNA烷化剂外,开发具有不同作用机制的有效载荷如拓扑异构酶抑制、RNA转录抑制、免疫刺激、小核酸分子等有望在ADC领域的未来发展中发挥关键作用。建立在ADC药物成功的基础上,抗体-寡核苷酸偶联物(antibody oligonucleotide conjugates,AOCs)相比于单一的寡核苷酸药物更具精准靶向能力和更好的药代动力学特性,其发展前景也令人期待。
抗体药物发展至今已成为生物药领域至关重要的分支之一,未来的研发仍将聚焦尚未满足的临床需求,拓展更多新的靶标以及适应证,为更多患者带来福音。
