基于细菌双组分系统的生物传感器的研究进展
2024-03-22赵静宇张健祁庆生王倩
赵静宇,张健,祁庆生,王倩
(山东大学,国家糖工程技术研究中心,微生物技术国家重点实验室,山东 青岛 266237)
微生物是地球上适应性最强、变化性最多样的有机体。为应对不同的环境变化,微生物演化出了多种细胞信号转导途径。磷酸化介导的信号转导途径几乎存在于所有的细胞中。微生物依赖不同激酶的催化完成以应对环境、细胞代谢及细胞周期等变化过程。其中,真核细胞常利用丝氨酸、苏氨酸激酶或酪氨酸激酶的催化,而原核细胞主要利用组氨酸和天冬氨酸的磷酸化介导的信号转导系统,也称为“双组分系统”。双组分系统通常由感受信号的组氨酸激酶(histidine kinase, SK)和与其邻接的反应调节子(response regulator,RR)组成。组氨酸激酶在感知外界信号后会迅速二聚化,导致催化ATP依赖的特定的组氨酸残基自我磷酸化,然后反应调节子催化组氨酸的磷酸基团转移到它自身的天冬氨酸残基上,反应调控子的磷酸化激活效应器结构域,从而与下游基因的启动子或蛋白作用,产生调控应答反应。双组分系统广泛分布于细菌中,参与其为应对环境刺激而作出反应的多种信号转导过程[1]。Ulrich等[2]在1087个细菌中检测到了63 259种双组分系统,平均每个细菌的基因组约有30种双组分信号系统。
基因编码的生物传感器通常以微生物细胞作为生物传感的基础,利用体内广泛存在的蛋白质或核酸元件,使收集的待测分子信息诱导蛋白质或核糖开关发生变构效应,从而调控下游报告基因的表达。报告基因的表达通常可转换为供定量或定性检测的输出信号(荧光信号、电信号、生长速率信号或者光、代谢通路表达水平信号),信号强度与待测物含量成比例关系,从而实现对细胞内外的待测物进行定量或定性动态监测。合成生物学家则利用生物传感器设计基因回路对细胞进行编程程序化控制工程细胞。基因编码的生物传感器因其可检测的代谢物的广泛性,已被应用于生物技术的许多领域,如诊断学、生物医学、食品安全及环境监测等[3]。
基因编码的细胞生物传感器根据识别元件的不同主要分为基于转录因子的生物传感器、基于核糖开关的生物传感器(二者可合称为单组分生物传感器)和双组分系统生物传感器。单组分生物传感器是一类被研究得相对较为透彻的传感器家族,其中LacI、TetR、AraC、LuxR等转录因子经常被用作经典的模式传感器。近来随着基因组挖掘、蛋白质工程、定向进化和计算机设计等技术的发展及运用,新的单组分生物传感器层出不穷,例如一些能够检测与宿主生理变化相关的输入的传感器[4]。目前核糖开关的基因调节域可通过合理设计、定向进化和机器学习等来检测未知的输入[5]。
基于单组分的生物传感器感应的主要是胞内信号分子的浓度。与单组分系统相比,双组分系统可以对更为广泛的输入作出反应,尤其是细胞外和周质空间的信号刺激。双组分系统能将这些信号传递到细胞内从而对转录输出产生影响,因此它能被设计为检测胞外信号的生物传感器[6],从而弥补单组分生物传感器无法实现的功能,这使其在合成生物学中具有不可替代的优势。
近年来,随着对细菌双组分信号转导系统的发掘,以及对其组分蛋白结构和应答机制的深入研究,基于双组分系统的生物传感器也被越来越多地开发出来。例如,响应重金属和有机污染物的双组分系统生物传感器已经被开发出来,利用CusRS双组分系统感应环境中的铜离子,通过融合铜结合肽(copper-binding peptide, CBP)到膜蛋白OmpC上实现了对细菌表面铜离子的检测和去除[7]。一些检测硫代硫酸盐、连四硫酸盐和酸性pH值的双组分系统已被用于检测肠道炎症等[8]。双组分系统还被设计用来响应一些高附加值化学品以用于筛选高产菌株[9]。综上,双组分系统有希望成为合成生物学中的一类重要生物传感器,实现其在环境探测、疾病监测治疗和微生物化学品生产等领域的广泛应用。本文将着重对双组分系统生物传感器近年来的研究进展作简要介绍,为未来双组分系统生物传感器设计构建与应用提供参考。
1 基于细菌双组分系统的生物传感器
1.1 双组分系统生物传感器的组成及其信号转导机制
典型的双组分系统包含两个蛋白:传感器组氨酸激酶(SK)和响应调节因子(RR)。典型的SK通常是同源二聚体,由周质传感结构域、两个跨膜螺旋、信号传递域和胞质信号域组成。胞质信号域由催化域、ATP结构域(可合称为CA域,catalytic and adenosine triphosphate domain)和二聚组氨酸磷酸化转移结构域(dimerization and histidine phosphotransfer domain, DHp域)组成。RR包括磷酸化接收域和DNA结合域(DNA binding domain, DBD)(也称为效应器结构域)两部分[10]。在一般的双组分系统的信号传递中,SK由于感应信号刺激(一般是细胞外的)而发生构象改变,这种构象变化被传递到胞质信号域,CA结构域便催化磷酸基团从ATP转移到DHp域内保守的组氨酸残基上使SK磷酸化,磷酸化的SK与RR相互作用,将磷酸基团转移到保守的RR天冬氨酸上磷酸化激活RR,驱动它调节一个或多个启动子的转录输出(图1)。

图1 细菌双组分调控系统的结构Fig. 1 Structure of bacterial two-component regulatory systems
目前利用双组分系统的信号传递系统构建生物传感器的报道已有不少。例如,Choi Jong-il等[11]通过将来自动性球菌(Planococcussp.)PAMC21323的SK DegS的周质传感结构域与来自大肠杆菌(Escherichia coli)的胞质信号域EnvZ融合,以绿色荧光蛋白(GFP)作为报告基因,构建了一个用于检测L-谷氨酸的嵌合DegSZ双组分生物传感器。最近,杨慧勤等[10]以大肠杆菌内的dcuS-dcuR双组分系统为基础,设计了一种能够响应胞外富马酸的双组分生物传感器。目前双组分系统已被开发用于感知许多不同的输入。已知的双组分系统的输入种类包括光、温度、pH、金属、可获得性的养分、呼吸电子受体、氧化剂、小分子代谢物、细菌间通信信号、抗生素、抗菌肽、低聚糖、蛋白质、激素和其他信号(表1)。
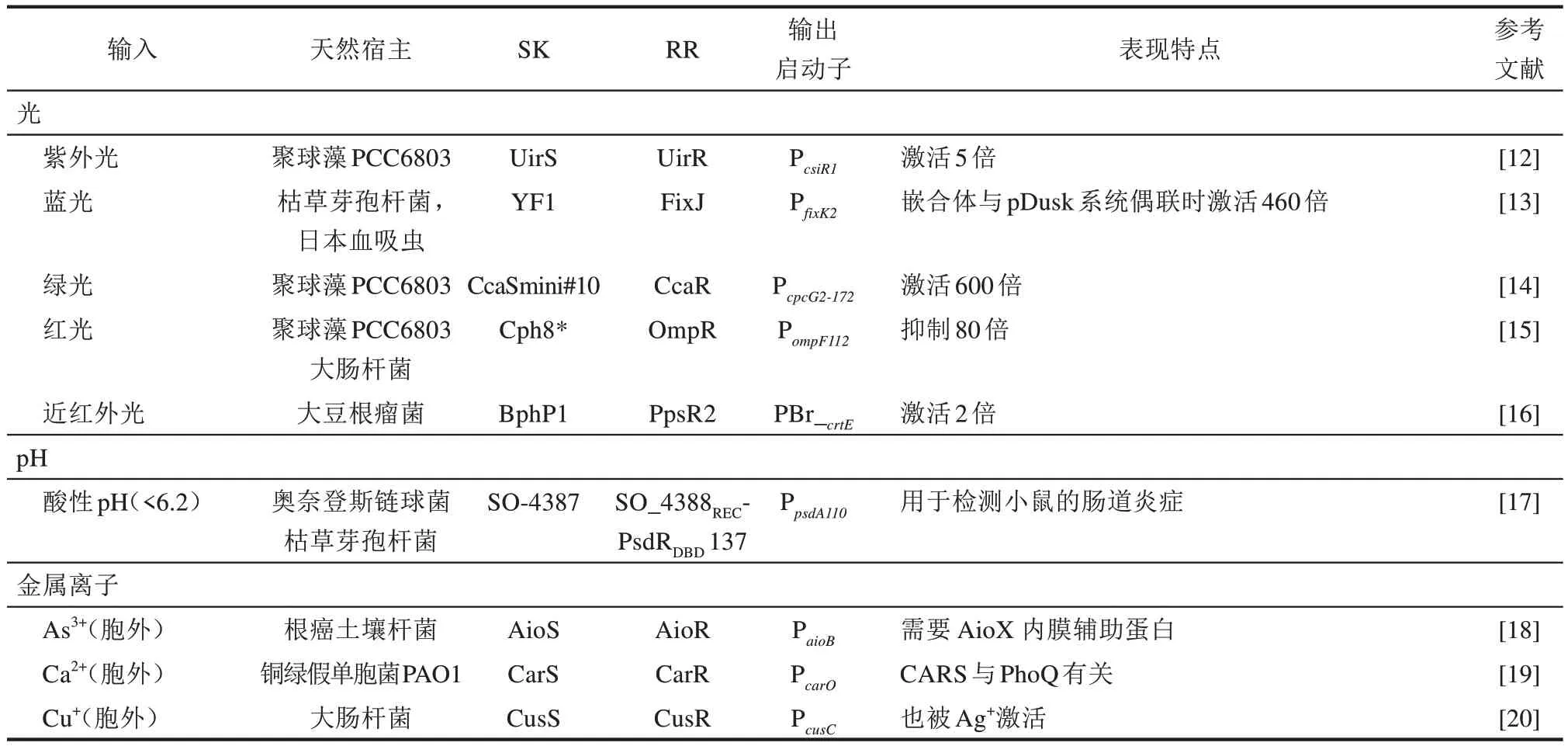
表1 基于双组分系统设计和构建的生物传感器Table 1 Biosensors designed and developed based on bacterial two-component systems
1.2 双组分系统生物传感器的优势
尽管自然界中存在的单组分系统更简单、更丰富,但双组分系统在合成生物学中具有独特的优势。
首先,双组分系统中的SK可以存在于细胞膜上或位于细胞内,而单组分系统几乎完全位于细胞内。因此,双组分系统可以感知细胞外、膜内或细胞内的输入,而单组分系统通常只能感知细胞内的输入。如果作为输入信号的配体无法自主进入胞内,则必须表达转运蛋白[61]。由于许多化合物(如大分子物质)的转运蛋白并不容易获得,双组分系统往往比单组分系统感知到的输入更广泛。
其次,很多SK对某一输入具有高度特异性。例如,希瓦氏菌(Shewanella oneidensis)中的ThsS被硫代硫酸盐激活,但不受与其相关的化合物[如连四硫酸盐]影响[27]。
最后,大多数双组分系统中的SK还具有独特的双功能酶活性,即激酶和磷酸酶活性,可以同时磷酸化或去磷酸化同源RR。SK的这种双功能酶活性使得双组分系统的输出对SK和RR表达水平的变化相对不敏感[62],因此这种内置的稳健性可以缓冲由于基因表达噪声或由生长条件变化导致的SK和RR表达波动对双组分系统传感器的影响。最近有研究证明SK的磷酸酶活性可以作为调节双组分系统检测阈值的“内置旋钮”[63]。通过引入特定降低SK磷酸酶活性的传感器域突变,使得双组分系统生物传感器可以在更低的输入信号浓度下(低两个数量级)做出明确响应。同时,作者还通过对SK序列比对发现,64%的SK存在一个保守的GXGXG基序,其中第一个可变残基X可以突变为不同的疏水残基来调节双组分系统的检测阈值。单组分系统灵敏度的调优通常通过计算机设计和定向进化来实现,而双组分系统中的这种磷酸酶活性调节方法比上述两种策略更容易实现检测阈值的调整。
2 基于双组分系统生物传感器的设计与构建
2.1 重构双组分系统生物传感器
双组分系统中SK和RR通常受多种途径相互调控[10],而且双组分系统的调节网络也可能对自身传感功能不利[12]。因此在构建双组分系统生物传感器时,通常需要基于其调控机制通过构建人工可控的双组分功能蛋白来重构双组分传感系统(图2)。一般的策略是使用在目的菌株中发挥良好特性的启动子、核糖体结合位点和终止子取代原有的表达元件。尽管双组分系统对其组成蛋白的表达水平的变化相对不敏感,但在重构过程中优化SK和RR的表达水平仍然很重要。双组分系统通常对RR蛋白的表达水平比SK蛋白的表达水平更敏感。如果RR表达水平太低,那么磷酸化的RR将不足以与输出启动子结合并激活转录;相反,如果RR表达水平过高,在没有输入的情况下,输出启动子往往会表现出强烈的活性。这可能是由于在没有输入的情况下,残留的SK激酶活性或非同源SK[64]对输出启动子产生了影响。此外,较低或较高的SK表达经常也会影响双组分系统的功能。SK和RR的表达水平可以通过使用诱导剂(如IPTG、aTc)诱导表达系统、不同强度的组成型启动子或核糖体结合位点库进行共同优化[65]。例如,Nicholas T. Ong等[16]分别利用aTc和IPTG诱导BphP1和PpsR2的表达,使BphP1/PpsR2系统对红外光的响应动态范围从0增加到2.35倍。
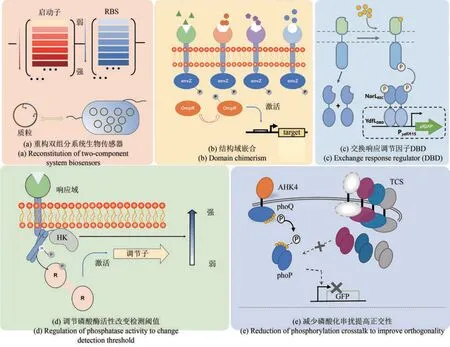
图2 基于双组分系统的设计与构建Fig. 2 Performance tuning strategies based on bacterial two-component systems
2.2 嵌合非同源的SK传感器域和传递域设计生物传感器
双组分系统的传感和调节机制相对独立,因此双组分系统最适合创建响应新配体的定制生物传感器。然而,许多双组分系统的输出启动子只能在很小的程度上被激活,此外,双组分系统的输出启动子通常被其他途径交叉调控,或在异源宿主中保持沉默[65]。这些都是双组分系统生物传感器构建中面临的挑战,可通过在输出启动子中引入突变或截短来去除不需要的调控位点或可能泄露表达的组成型启动子来解决。双组分系统还可以被重新构建到具有优越性能的非同源输出器上。传统的双组分系统重构的方法是在目的SK传感器域和非同源传输域之间进行嵌合。原理是嵌合的SK控制非同源RR的磷酸化,从而使非同源输出启动子转录。该策略已被用于构建包含趋化性蛋白的嵌合双组分系统。例如Tsr、Tar、Trg和Aer这几种可以识别特定化学物质的周质趋化性受体,它们可以与EnvZ的细胞质结构域耦合,允许信号转导[66]。
EnvZ是研究最多的SK蛋白,它可以响应渗透压变化调控OmpR的磷酸化状态。OmpR是一个RR蛋白,负责控制膜孔蛋白基因ompF和ompC的表达。由于EnvZ-OmpR双组分系统在细菌中广泛分布,因此EnvZ的DHp和CA结构域常被运用于结构域交换策略中。例如,Tar是一种可以检测L-天冬氨酸的化学受体跨膜蛋白。通过将Tar的胞质信号域替换为EnvZ的胞质激酶域,杂交蛋白既能实现Tar对L-天冬氨酸的感知能力,又能实现EnvZ对OmpR的调控能力,从而激活ompC基因的表达。这一策略也适用于Trg和EnvZ的杂合,从而能够识别核糖体结合肽,激活ompC的表达。除了利用趋化受体跟EnvZ杂合,SK的周质传感结构域还被设计与EnvZ的胞质结构域嵌合,参与C4-二羧酸、糖、L-天冬氨酸和酸性氨基酸的感应(表1)。通过此种方法构建的新型双组分生物传感器不仅可以用于菌株的高通量筛选,也为发现响应新信号的双组分生物传感器提供了思路。
2.3 通过交换响应调节因子的DBD设计生物传感器
虽然传感器域交换策略已被用于设计大量的双组分系统传感器,但是传感域和输出域之间的信号传递机制错综复杂,未被明确解析。因此,通过交换双组分系统的传感器域作为常规策略来设计生物传感器仍然有一定的困难。基于SK-RR界面交换和蛋白质支架的策略可以将SK重定向到非同源RR,也显示了双组分系统重新布线的前景[67]。
最近,Schmidl等[28]开发了一种通用的方法,通过模块化交换RR的DBD来将双组分系统重新构建到特征良好的输出模块上。他们证明了OmpR/PhoB或NarL/FixJ家族的RR的DBD可以被其他结构相关但功能不相关的RR的DBD所取代。这两个家族的双组分系统可以高成功率地重新构建到其他输出模块上(OmpR/PhoB家族的RR的CcaR DBD及其PcpcG2-172输出启动子,以及NarL/FixJ家族的RR的YdfI DBD及其PydfJ115输出启动子)。OmpR/PhoB和NarL/FixJ包含了70%以上的RR[68],这表明使用这种方法可以构建数千个双组分系统传感器。
2.4 调节SK传感器域磷酸酶活性来改变检测阈值
在双组分系统的生物传感器的性能优化过程中,响应阈值的调整非常重要。一般的策略是突变SK传感器域以调整其磷酸酶活性,SK的磷酸酶活性会影响双组分传感器的检测阈值。典型案例为硝酸盐生物传感器,使用不同的诱导剂组合,在恒定的SK总表达水平下,使NarX/NarXC415R突变体的表达比率在0%~100%进行调整,随着NarXC415R比例的增加,传感器的检测阈值从1138 μmol/L降至12 μmol/L。较低的阈值表明了响应灵敏度的提高,这为创建具有不同阈值和灵敏度的双组分生物传感器提供了有用的策略[63]。
2.5 通过减少双组分系统间磷酸化串扰提高正交性
由于不同双组分系统的SK和RR在相互作用界面的序列和结构相似,它们可能在同一细胞内相互串扰。这种磷酸化信号串扰可能会损害双组分系统传感器在复杂细胞环境中的正交性。然而,McClune等[60]的工作已经证明,由于序列空间很大,相互作用界面新的氨基酸序列很容易引入,并且发生串扰的概率很低。这一结果表明,合成生物学家可以在一个细胞中使用多个双组分系统传感器,而不会有很高的磷酸化信号串扰风险。在磷酸化串扰问题的情况下,该小组还证明了SK和RR相互作用的接口可以用不与其他双组分串扰的绝缘版本来取代。作者使用这种方法设计了一个基于PhoQ的传感器结构域交换版本的系统,该系统能够对植物细胞分裂素反式玉米素做出响应,并且不与大肠杆菌中的任何天然双组分系统串扰[60](表1)。
2.6 将双组分系统生物传感器应用在真核生物系统中
研究者对利用双组分系统赋予真核细胞新的传感能力非常感兴趣。在早期工作中,研究者利用工程大肠杆菌Trg PhoR系统与拟南芥中计算机设计的细胞外辅助蛋白TNT.R3相互作用来检测2,4,6-三硝基甲苯[8]。为了在植物中实现转录调控,RR PhoB被融合到一个VP64反转录激活域,并用于激活一个包含多个Pho操作位点的最小植物启动子。然而,将双组分系统更广泛地应用到植物中仍然是一个挑战。在其他的研究工作中,Hansen等[69]在哺乳动物细胞中表达了大肠杆菌的双组分系统EnvZ-OmpR、NarXNarL和DcuS-DcuR。类似的RR反式激活子结构域融合和真核合成输出启动子设计策略被用来控制转录。虽然这三种双组分系统能够进行磷酸化信号传递而实现转录激活,但它们对同源输入没有响应。推测可能是由于细菌SK跨膜区域和真核细胞膜之间不相容。在后续的研究中,该小组将两个NarX传递器域突变体融合到了配体存在下能够异源二聚的G-蛋白偶联受体-β-抑制蛋白对上[70]。这一工程途径使哺乳动物细胞对这些配体产生了巨大的转录反应。它在设计不与内源性系统串扰的合成哺乳动物信号通路方面可能有巨大的潜力。
3 基于细菌双组分系统的生物传感器的应用
3.1 双组分系统生物传感器在生物修复中的设计与应用
双组分系统可以检测一些重金属和有机污染物。一些双组分系统的环境生物传感器已经被开发出来,包括响应重金属和有机污染物的生物传感器(图3)。细菌使用双组分系统来感知特定的重金属,然后调节这些金属阳离子的稳态。在大肠杆菌中,双组分系统HydHG(又称ZraSR)在好氧条件下通过组氨酸激酶HydH感知高浓度Zn2+和Pb2+并将HydG磷酸化,从而上调负责锌离子外排的zraP基因的表达。为此,研究人员利用双组分HydHG和锌结合肽建立了大肠杆菌细胞表面的锌吸附体系。为了在大肠杆菌表面展示锌结合肽,研究使用OmpC作为锚定基序,将该锌结合肽与ompC的嵌合构建在双组分HydHG控制的ZraP启动子下,使得该吸附系统在响应外源锌时被激活,并将锌吸附在其表面。该系统对低浓度(0.001 mmol/L)的锌也敏感[71]。

图3 双组分生物传感器在生物修复和微生物生物炼制中的应用Fig. 3 Applications of bacterial two-component biosensors in microbial bioremediation and biorefinery.
同样,大肠杆菌K-12中的双组分系统CusRS(ylcA,ybcZ)能够对Cu2+做出响应,控制pco操纵子的表达,从而激活铜排出系统,允许多余的Cu2+排出细胞。与以上的锌吸附系统类似,研究者通过利用双组分系统CusRS,将CBP与膜蛋白OmpC融合表达,CuSR通过感应Cu2+诱导嵌合体OmpCCBP的表达,该融合蛋白表达在细胞表面可以吸附Cu2+[7](表1),从而实现了对细菌表面铜离子的检测和去除。该系统是开发具多功能合成系统的极佳范例。因此,结合生物吸附系统构建重金属生物传感器的策略可以运用于重金属分析检测领域中,实现对工业环境中金属污染物的快速监测和消除。这一策略可以被拓展应用于目标化合物的有效去除和回收。
芳香族化合物是最大量的有机污染物。对大多数细菌来说,芳香族污染物是有害的,但由于细菌遗传和代谢的灵活性,一些微生物可以利用有机污染物作为唯一碳源进行生长。例如,恶臭假单胞菌的双组分系统TodST可以由不同的芳香底物如甲苯、二甲苯、苯和乙苯诱导而激活。双组分系统调节tod基因的表达,tod基因编码分解代谢这些芳香族化合物的酶[72]。
3.2 双组分系统生物传感器的在微生物化学品生产中的设计与应用
代谢工程策略已经被系统地应用于生物炼制过程中,以代谢工程微生物作为宿主菌株,从可再生资源中生产生物基燃料、化学品和聚合物。将基于双组分系统的生物传感器应用于微生物的代谢工程领域中去响应高附加值化学品具有很大的应用潜力。Jack W. Rutter等[73]构建了一种对乙酰乙酸酯敏感并可以在几种大肠杆菌宿主菌株中使用的新型生物传感器AtoSC。
双组分系统生物传感器在代谢工程中主要用于高产菌株的筛选(图3)。富马酸生物传感器DcuSZ是一个基于EnvZ/OmpR的嵌合双组分系统,它是通过融合DcuS SK传感结构域和EnvZ的细胞质结构域而构建的。嵌合的DcuSZ对富马酸具有高度的特异性,在OmpR调节的启动子PompC控制下的GFP表达与培养基中富马酸浓度成比例[24]。苹果酸和L-天冬氨酸的双组分生物传感器同样是基于EnvZ/OmpR构建的嵌合双组分系统,将MalK和AauS的SK感受域融合到EnvZ催化结构域来分别检测高产苹果酸和L-天冬氨酸的菌株而构建的。Choi Jong-il等[11]通过将来自动性球菌PAMC21323的SK DegS的N端结构域与来自大肠杆菌EnvZ的催化结构域融合,构建了一个用于高通量筛选产L-谷氨酸菌株的嵌合DegSZ双组分生物传感器。通过外源添加不同浓度的L-谷氨酸,荧光强度与L-谷氨酸浓度呈线性相关。
未来,这些双组分生物传感器可与FACS联合运用来评估筛选多达上亿个细胞的文库[9]。这一策略可以进一步扩展到合成其他具工业价值的产品,有望筛选出催化相关产物形成的新酶,从而加速用于高价值化学品生产的下一代细胞工厂的发展。
3.3 双组分系统生物传感器在疾病监测和治疗中的应用
双组分生物传感器作为分析肠道通路的工具具有极高的开发潜力。很多细菌已经进化出大量与肠道相关的分子传感器,这些传感器被重新设计并用于控制报告基因的表达,从而能够对肠道代谢物进行检测(图4)。研究人员对利用肠道中的代谢物硫代硫酸盐和连四硫酸盐研究肠道硫代谢和炎症之间的联系非常感兴趣。Kristina等设计了第一个硫代硫酸盐生物传感器和一个改进的连四硫酸盐生物传感器,这两个双组分系统都来自希瓦氏菌。将它们转入大肠杆菌益生菌菌株E. coliNissle 1917中,以口服/灌胃的方式定植于肠道,使用流式细胞术检测结肠和粪便样本中的工程细菌,并量化传感器输出,最终证明了构建的硫代硫酸盐传感器能够被结肠炎症相关因子激活,表明硫代硫酸盐可能是一种新的疾病标志物。这两种传感器均可应用于疾病诊断或治疗,还可以用于开发广泛的细菌传感器,使肠道菌群路径的微创研究成为可能[27]。
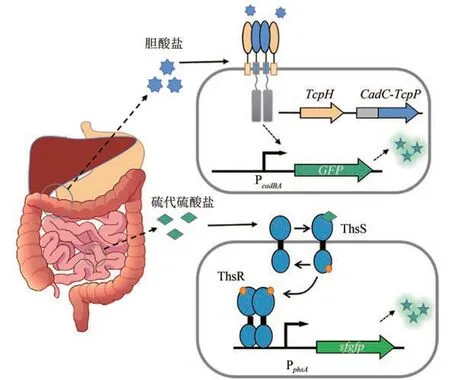
图4 双组分系统在疾病检测中的应用Fig. 4 Applications of bacterial two-component systems in disease detection
然而,由于缺乏系统编程配体检测的合成生物学方法,限制了细菌双组分系统生物传感器在疾病诊断或治疗中的应用。Jerome Bonnet等开发了一种新颖且与临床相关的传感模式,以模块化的方式引入双组分生物传感器。研究利用了一个称为EMeRALD(通过配体诱导二聚体激活的工程模块化受体)的受体平台,该平台支持传感模块以模块化组装到具高性能基因表达控制的大肠杆菌信号系统中。为了在大肠杆菌中设计一个基于EMeRALD的胆酸盐受体,将霍乱弧菌(Vibrio cholerae)TcpP胆酸盐传感模块及其跨膜区(TM)融合到CadC的DBD上,利用CadC的靶启动子PcadBA控制sfGFP的表达,用于检测肝功能障碍的生物标志物——胆酸盐。同时,通过定向进化,提高了传感器的灵敏度,降低了检测阈值。最后,基于此设计了一种比色细菌传感器,用于检测肝移植患者血清中的病理胆酸盐水平,从而形成肉眼可检测到的输出[74]。
4 展 望
合成生物学的迅速发展为我们提供了新的用于多层次人工控制生物系统的技术与工具。双组分系统生物传感器的设计与应用工作已取得了较大的突破,极具开创性。本文中,我们首先介绍了双组分系统生物传感器的基本组成、信号转导机制,以及其区别于单组分生物传感器的功能特点。接着我们针对双组分系统生物传感器的设计与构建进行了描述,包括重构双组分系统生物传感器、结构域嵌合、交换响应调节因子DBD、调节磷酸酶活性改变检测阈值及减少磷酸化串扰提高正交性等。最后我们对双组分系统生物传感器的在环境监测、疾病监测和微生物化学品生产等领域的应用进行了介绍。
目前对双组分系统生物传感器的研究仍有很多不足,需要研究者们继续发掘新的策略。尽管双组分系统比单组分系统更为复杂,但它同时具备很多优势。首先,由于大多数SK具跨膜结构,双组分系统可以感知单组分系统不可感应的胞外信号输入。其次,双组分系统的磷酸化传递机制提高了传感器在不同组分蛋白表达水平下功能的稳健性,同时也提供了一个内置的旋钮,用于调节双组分系统以响应不同浓度的输入,细菌可利用该特征来更好地适应不同的环境条件。此外,越来越多的合成生物学家利用这些特性来人工赋予细菌新的感知和响应能力,以满足新的工程应用。
细菌基因组中存在数以千计的双组分系统,其中大量系统未被鉴定且输入无法预测。随着合成生物学的发展,双组分系统可被应用到模式菌株中,如大肠杆菌或枯草芽孢杆菌,这可以加快关于它们输入的速度[27]。例如,若双组分系统的输出启动子未知,可以使用结构域嵌合或DBD交换策略替换它来达到目的。再者,可以构建来自人类肠道微生物组的双组分系统文库,对肠道中发现的疾病生物标记物进行筛选。如果发现了对生物标记物有反应的双组分系统,就可以利用双组分系统性能调节策略将其转化为高性能的生物传感器,此外,这些生物传感器的检测阈值可按照诸如诊断和治疗疾病的工程细菌等应用的需求进行调整[63]。
目前针对真核生物双组分系统的功能挖掘仍然是一个重要的挑战,需要新的生物学方法和新的工程策略来解决。在未来,随着科学领域的发展,双组分系统的工程方法可与大规模的基因合成、高通量筛选等相结合,以加速和帮助合成生物学家发现许多未确定特征输入的双组分系统,并开发新的对广泛的刺激做出反应的基因编码生物传感器,拓展双组分生物传感器在不同领域的应用。总而言之,双组分系统因其可感知输入的广度、性能的稳健性和可编程性,将成为未来合成生物学领域一类重要的生物传感器家族。
