双探针PET-CT在阿尔茨海默病中的临床应用价值
2024-03-22娜姿伊力哈木张奇洲秦永德李肖红
娜姿·伊力哈木 张奇洲 秦永德 李肖红
(新疆医科大学第一附属医院核医学科,新疆 乌鲁木齐 830054)
2018年国际阿尔茨海默病(AD)协会(ADI)的最新报告指出,在2050年,全球痴呆人口将从2018年的5 000万增长至1.52亿人〔1〕。痴呆人口中,60%~80%为AD〔2〕。中国作为老龄化大国,至2050年,AD患者将占全世界AD人口的近一半〔1〕,对AD早期诊断和干预成为世界医学界的重要课题之一。AD典型的病理改变是:(1)细胞外β-淀粉样蛋白(Aβ)沉积形成的老年斑(SP);(2)细胞内Tau蛋白磷酸化形成的神经元纤维缠结(NFTs);(3)大脑内特定区域突触丢失、炎症改变及神经细胞死亡〔3,4〕。主要临床症状为从出现认知功能障碍,到逐渐丧失生活能力,最终出现精神行为异常。AD不仅降低生活能力,还会缩短寿命,在确诊10年内死亡〔5,6〕。AD在出现临床症状前数十年就已发生病理改变,借助诊断技术,可做到早发现、早诊断、早干预。目前AD诊断的金标准为脑部尸检,随着2007年国际工作组织(IWG)首次提出了AD相关性生物标志物,从而开启了临床对AD的早识别、早诊断、早干预的三级预防体系,世界各国也采用此方法作为AD的诊断标准。2018年美国国立老化研究所与阿尔茨海默病协会(NIA-AA)对AD的诊断标准中,提出并巩固了生物标志物与正电子发射型断层显像(PET)相结合在诊断中的作用,包括Aβ-PET、Tau-PET、氟脱氧葡萄糖(FDG)-PET〔7,8〕。正电子发射型计算机断层显像(PET-CT)可用不同示踪剂反映AD相关生物标志物在脑部的分布状态,包括Aβ示踪剂:11C-PiB、18F-氟贝他吡(AV45);Tau蛋白示踪剂:18F-THK523、18F-AV1451;神经变性或损伤示踪剂:18F-FDG。18F-FDG为临床广泛应用于AD检查的示踪剂,显像技术及影像分析较为成熟;18F-AV45为近几年广泛用于国内外临床研究并进行AD诊断的Aβ示踪剂之一,在AD早期诊断的价值高于Tau蛋白示踪剂,临床应用也优于11C-PiB〔9,10〕。本研究探讨18F-AV45联合18F-FDG PET-CT在AD中的临床应用价值。
1 对象与方法
1.1研究对象 回顾性纳入2022年3~5月在新疆医科大学第一附属医院诊断为AD的患者(AD组)14例(男8例,女6例),年龄61~83岁及健康对照者(HC组)8例(男3例,女5例),年龄65~76岁。收集临床基本资料及检验资料,包括身高、体质量、糖化血红蛋白、空腹葡萄糖及血清钙测定。均进行简易智力状态检查(MMSE)量表及蒙特利尔认知评估(MoCA)量表评分,MMSE量表评分≥26分、MoCA量表评分≥23分为认知功能正常。均完善脑部磁共振成像(MRI),以除外脑部占位性病变。本研究经医院伦理审查委员会批准(K202102-11),PET-CT 检查前受试者或家属签署知情同意书。
1.2设备与方法 AV45前体由北京师范大学国家重点实验室提供;18F-FDG与18F-AV45均由新疆医科大学第一附属医院核医学科自行制备。PET-CT扫描仪来自GE公司Discovery型号。18F-FDG PET显像:要求患者空腹4~6 h,糖尿病患者血糖水平<10 mmol/L,按3.70~5.55 MBq/kg 静脉注射示踪剂,40~60 min后进行头部扫描。18F-AV45 PET显像:按3.70~5.55 MBq/kg静脉注射示踪剂,于30 min后进行头部扫描。两种检查间隔<7 d。
1.3影像分析 由两位高级职称的核医学科诊断医师,分别对18F-FDG及18F-AV45 PET-CT图像,根据不同显像剂的最大标准化摄取值(SUVmax)、标准摄取分数比值(SUVR)、CT及PET特征进行视觉及半定量分析,并给出诊断意见,当意见不一致时,由第3位高年资医师或小组共同讨论后,给出诊断意见。18F-FDG PET显像阴性标准:大脑灰质放射性分布均匀对称,明显高于脑白质摄取。阳性标准:一个或多个脑区灰质放射性分布稀疏减低或增高浓聚。18F-AV45 PET显像阴性标准:脑白质放射性分布高于脑灰质,灰白质对比清晰。阳性标准:一个或多个脑区脑灰质放射性分布增高,等或高于脑白质。半定量法:在7个脑区(分别为额叶、顶叶、颞叶、楔前叶、后扣带回、枕叶、小脑)测量SUVmax,以小脑为参考,计算出SUVR值。
1.4统计学方法 采用SPSS22.0软件进行t检验、χ2检验、Pearson相关性分析,采用受试者工作特征(ROC)曲线评估不同示踪剂的诊断价值。
2 结 果
2.1两组临床资料比较 两组空腹葡萄糖、三酰甘油(TG)水平及MMSE、MoCA评分差异均有统计学意义(P<0.05)。两组性别、年龄、体质量指数(BMI)、糖化血红蛋白、血清钙离子、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等差异均无统计学意义(P>0.05)。见表1。
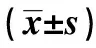
表1 两组基线资料比较
2.2基线资料Pearson相关性分析与Logistic单因素分析 AD与空腹葡萄糖水平、TG呈明显正相关(r=0.430、0.425,P=0.046、0.049),与MMSE、MoCA评分呈明显负相关(r=-0.779、-0.848,均P<0.001)。 以是否为AD为因变量,存在相关的空腹葡萄糖水平、TG、MMSE与MoCA评分为自变量,Logistic单因素分析显示以上指标均无统计学差异(P>0.05)。
2.3图像分析18F-FDG:AD组在各脑区均可见放射性分布不同程度减低,其中额叶AD组阳性例数/AD组总例数(两组总阳性例数/两组总例数)为13/14(15/22)例,顶叶10/14(10/22)例,楔前叶5/14(5/22)例,后扣带回7/14(7/22)例,颞叶10/14(12/22)例,枕叶8/14(8/22)例。临床诊断重度AD则显示为全脑FDG代谢弥漫性减低,包括基底节,18F-AV45:AD组在各脑区脑灰质见不同程度的放射性分布增高,其中额叶12/14(13/22),顶叶12/14(13/22),楔前叶12/14(12/22),后扣带回10/14(10/22),颞叶10/14(10/22),枕叶13/14(13/22),见图1。
2.418F-FDG与18F-AV45 SUVR值比较及诊断价值18F-FDG PET显像中两组间SUVR值在额叶、顶叶、楔前叶、后扣带回、颞叶及枕叶有统计学差异(P<0.05),在基底节无统计学差异(P>0.05)。在各脑区的临界值分别为:额叶(SUVR<1.11)、顶叶(SUVR<0.93)、楔前叶(SUVR<0.82)、后扣带回(SUVR<0.89)、颞叶(SUVR<1.06)及枕叶(SUVR<1.00)。额叶、顶叶及颞叶的曲线下面积(AUC)均大于0.85(P<0.001),有很好的鉴别诊断价值。各脑区SUVR值联合诊断AD有很好的诊断价值(AUC为0.946,95%CI:0.640~1.038,P<0.001)。18F-AV45 PET显像中两组间SUVR值在额叶、顶叶、楔前叶、后扣带回、颞叶、枕叶及基底节均有统计学差异(P<0.05)。见表2。在各脑区的临界值分别为:额叶(SUVR>1.02)、顶叶(SUVR>1.13)、楔前叶(SUVR>0.92)、后扣带回(SUVR>1.03)、颞叶(SUVR>1.01)、枕叶(SUVR>1.03)及基底节(SUVR>0.98)。顶叶、颞叶及楔前叶的AUC均大于0.90(P<0.001),有很好的鉴别诊断价值。各脑区SUVR值联合诊断AD的AUC最大(AUC为0.958,95%CI:0.887~1.000,P<0.001)。AD组18F-FDG 在各脑区的SUVR值与18F-AV45在各脑区的SUVR值无相关性(均P>0.05)。见表3。


图1 两组脑部18F-FPG、18F-AV45显像
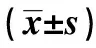
表2 两组各脑区18F-FDG、18F-AV45 SUVR值比较
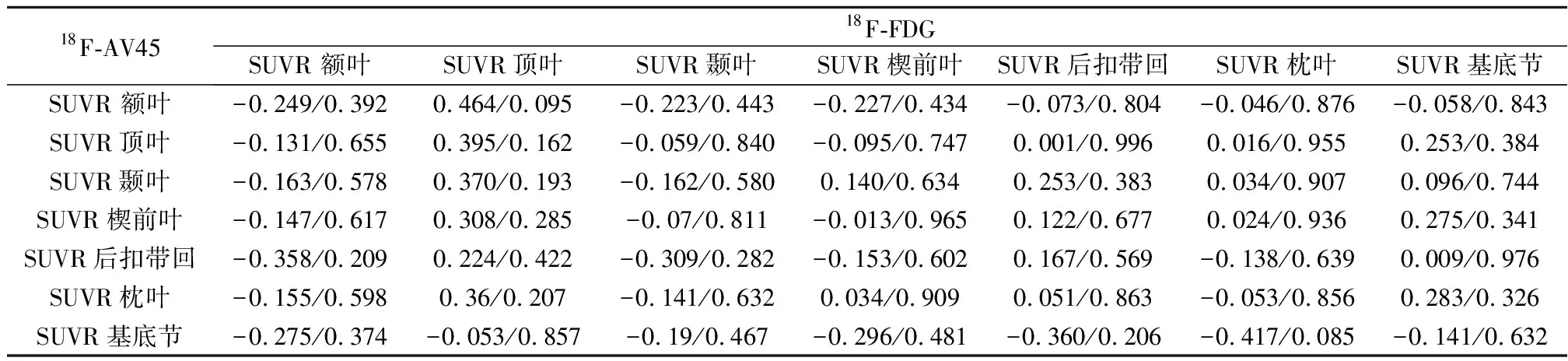
表3 18F-AV45与18F-FDG各脑区相关性(r/P值)
3 讨 论
AD是较为常见的与年龄相关性退行性疾病,而随着年龄增长及新陈代谢减慢,身体各项代谢将出现不同程度的紊乱。林丹等〔11〕、吕晓静等〔12〕研究显示,糖代谢与脂代谢异常可加重认知障碍,TG水平增高可增加神经细胞退行性改变,进而增加Aβ沉积;血糖水平增高可加速NFTs,导致AD发生。本研究结果与上述研究一致。
糖化血红蛋白反映8~12 w平均血糖水平,本研究中虽然两组间糖化血红蛋白值无统计学差异,但是AD组高于HC组,也间接反映AD组糖代谢功能的降低更为显著。故糖代谢异常人群,尤其是糖尿病患者需对AD提高警惕。
AD患者中血液脂质含量增加将会促进病情进展,包括促进大脑Aβ斑块形成及海马与内嗅皮层萎缩〔13〕。TC、TG、LDL-C水平增高和HDL-C水平降低,会增加AD患者中Aβ斑块沉积,而HDL-C水平增高则是AD的保护因素〔14〕。本研究结果与上述研究一致。 AD组血脂水平增高,将加速病情的进一步恶化;而健康人群血脂增高,将会带来相关的并发症,包括心脑血管病等,也会间接影响认知水平,促进AD相关病理标志物出现。若早期对高血脂进行干预,并调节饮食结构、工作生活模式,将会避免或延缓AD发生。
BMI与LDL-C是AD的影响因素〔15,16〕,但本研究两者在组间对比没有统计学差异,考虑与样本量低有关。国外研究显示,AD的诊断应限于生物标志物呈阳性并伴有特定AD表型的患者,而生物标志物呈阳性的认知无障碍者应仅被视为有发展为AD的风险〔17〕。
18F-FDG在AD中的早期表现包含在楔前叶、后扣带回及顶叶的不对称性减低,逐步在双侧顶颞叶呈对称性稀疏减低,进展累及双侧额叶。18F-AV45在大脑灰质的摄取主要在颞叶、枕叶、额叶、顶叶、后扣带回及楔前叶,其中楔前叶的特异度高,枕叶的摄取增高与临床晚期AD有相关性〔18,19〕。本研究发现,18F-FDG SUVR值在额、顶、颞叶有较高的诊断价值;18F-AV45 SUVR值在顶、颞叶及楔前叶有很好的诊断价值。18F-AV45在13例表现为枕叶放射性摄取增高,根据MMSE评分标准,临床分期与18F-AV45摄取不符,可能原因有:(1)临床分期存在偏差。与诊断医师的临床经验及水平;医患沟通的技巧;早中期患者为间歇性发病,不同时期的检测结果不同有关。(2)轻度及中度AD患者,18F-AV45在枕叶的摄取增高,可能预示着病情将在较短时间内进展为重度。(3)18F-AV45在枕叶的摄取增高,不是重度AD所特有表现,轻中度也可表现为放射性摄取增高。
两种放射性药物之间的相关性研究存在争议。Ottoy等〔20〕认为,两者之间存在相关性,Jing等〔21〕认为两者之间无相关性。本研究结果符合后者研究内容。两种示踪剂代谢路径与成像方式各不相同,对AD的诊断途径不同,两者可相辅相成,但不可替代。18F-FDG是判定脑部葡萄糖代谢较为灵敏的示踪剂,其在AD脑部的分布特征,被广泛应用于临床诊断及分期的判定;18F-AV45,可用于体外观察Aβ沉积,对AD早期诊断具有较高的意义。联合两种分子探针,在AD早期诊断具有较高的价值。
