定量CT评估肌肉减少症和脂肪组织含量与肝癌TACE联合PD-1单抗治疗预后的相关性
2024-03-21熊柏柱侯昌龙高飞王传彬付宝月吴昱霖周磊
熊柏柱,侯昌龙,高飞,王传彬,付宝月,吴昱霖,周磊
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最常见的恶性肿瘤之一[1]。对于中晚期HCC经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是主要治疗方法,TACE对肿瘤造成的缺血性和细胞毒性损伤有助于激发针对肿瘤相关抗原的T细胞反应,使程序性死亡受体1(programmed death receptor 1,PD-1)单抗活性增强[2]。因此,TACE联合PD-1单抗被认为是HCC治疗的新方法[3]。鉴于中晚期HCC治疗方式的多样化,早期评估预后对HCC患者临床个体化方案的制定有重要价值。既往研究表明,大多数肝癌患者会因为年龄、肝硬化及肿瘤的消耗引起身体体质的变化,继而引发肌肉减少症和脂肪消耗等并发症,肿瘤患者的营养状态尤其是脂肪组织的含量可能会影响免疫治疗的预后[4]。定量CT(quantitative computed tomography,QCT)作为一种无创且快速的检查手段,可以与常规CT检查结合,满足影像诊断同时准确测量肌肉和脂肪组织含量[5]。本研究回顾性分析TACE联合PD-1单抗治疗的HCC患者临床和影像资料,探讨QCT评估治疗前肌肉和脂肪组织含量与治疗预后的关系。
材料与方法
1.研究对象
回顾性收集2019年1月-2022年1月于中国科学技术大学附属第一医院TACE联合PD-1单抗治疗的HCC患者96例,所有患者首次联合治疗前1个月内接受CT扫描。纳入标准:①巴塞罗那分期(barcelona clinic liver cancer,BCLC)为B/C期;② 存在一个或多个在CT/MRI动脉期成像增强的病灶作为靶病灶。排除标准:①CT检查范围未包括L3椎体平面(n=15);②成像质量无法测量身体成分面积(n=4)。研究最终纳入77例患者。
2.扫描方法和身体成分的测量
所有患者在TACE联合PD-1单抗治疗前采用GE Discovery 750 HD CT扫描,扫描参数:管电压120 kV,管电流250 mAs,旋转时间0.8 s,螺距1.375,扫描层厚5 mm,视野50 cm×50 cm。扫描完成后,将图像上传至QCT Pro工作站(Mindways,USA)。使用QCT Pro软件中“Tissue composition”功能的“Auto snake”自动获得L3水平总脂肪面积(total adipose tissue area,TATA)、皮下脂肪面积(subcutaneous adipose tissue area,SATA)和内脏脂肪面积(visceral adipose tissue area,VATA)。在同一层面手动划分所有骨骼肌(腰大肌、竖脊肌、腰方肌、腹横肌、腹外斜肌和腹内斜肌)的总面积[6],即L3层面骨骼肌横截面积(L3 skeletal muscle area,L3 SMA),见图1。上述测量过程由1名影像科主治医师独立测量,并经1名影像科高级职称医生评估测量过程无误。将TATA、SATA、VATA和L3 SMA除以身高的平方标准化,得到总脂肪指数(total adipose tissue index,TATI)、皮下脂肪指数(subcutaneous adipose tissue index,SATI)、内脏脂肪指数(visceral adipose tissue index,VATI)和骨骼肌指数(skeletal muscle index,SMI)。肌肉减少症(sarcopenia,SA)采用Martin等[7]的标准,其定义为:女性,SMI<41 cm2/m2;男性,BMI<25 kg/m2时,SMI<43 cm2/m2,BMI≥25 kg/m2时,SMI<53 cm2/m2。
3.治疗方案
TACE过程如下:采用改良Seldinger技术行股动脉穿刺并置入导管鞘,随后将导管插入肿瘤供血动脉,行DSA造影明确病灶后,于肿瘤供血动脉注入奥沙利铂(100~200 mg),再注入盐酸表柔比星(10~40 mg)与罂粟乙碘油(10~20 mL)制成的乳化剂适量进行肿瘤栓塞,后使用明胶海绵颗粒适量加强栓塞。TACE后一周内使用PD-1单抗(卡瑞利珠单抗或信迪利单抗),剂量为200 mg/次,每3周为1个治疗周期。
4.随访和疗效评估
在联合治疗后每2~3个月进行一次增强CT/MRI检查。根据实体瘤改良反应评估标准(mRECIST),与治疗前相比,所有靶病灶均未见动脉期增强,则为完全缓解(complete response,CR);靶病灶增强扫描动脉期的直径之和减少≥30%,则为部分缓解(partial response,PR);靶病灶增强扫描动脉期的直径之和减少<30%或增加<20%,则为疾病稳定(stable disease,SD);靶病灶增强扫描动脉期的直径之和增加≥20%,或出现新发病灶,则为疾病进展(progressive disease,PD)。免疫相关不良事件(immune-related adverse event,irAE)根据不良事件通用术语标准(CTCAE)5.0版本评估。无进展生存期(progression-free survival,PFS)定义为从首次联合治疗开始到疾病进展或患者死亡的时间。总生存期(overall survival,OS)为首次联合治疗开始到患者死亡或随访截止时间(2022年8月1日)。
5.统计学方法
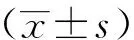
结 果
1.临床资料
本研究共纳入77名HCC患者,男66例,女11例,平均年龄(56.17±10.85)岁,体重指数(22.51±3.19) kg/m2。PD-1单抗治疗2~24周期,中位数6周期。
对测量的身体成分参数标准化后,TATI为( 81.14±44.18) cm2/m2,SATI为(30.94±18.70) cm2/m2,VATI为(50.20±27.78) cm2/m2。通过绘制ROC曲线计算TATI、SATI和VATI最佳截断点为61.75 cm2/m2、30.52 cm2/m2和61.52 cm2/m2。男性的SMI为(48.03±7.34) cm2/m2,女性的SMI为(40.96±4.76) cm2/m2,肌肉减少症的总体发生率为51.9%(40/77)。根据实体瘤改良反应评估标准,治疗期间肿瘤反应分别为PR 29例(37.7%),SD 34例(44.2%),PD 14例(18.2%),客观缓解率(ORR)为29例(37.7%)。
2.肌肉减少症和非肌肉减少症患者临床资料比较
77例患者中共有40例肌肉减少症,37例非肌肉减少症。有和没有肌肉减少症的患者在是否有肝硬化差异具有统计学意义(P<0.05),有和没有肌肉减少症的患者在年龄、BMI、BCLC分期、Child-Pugh分级、血管侵犯、肝外转移、肿瘤大小和肿瘤数目等方面的差异没有统计学意义(P>0.05),见表1。

表1 肌肉减少症和非肌肉减少症患者临床资料比较
3.无进展生存期的单因素和多因素分析
单因素分析结果显示肿瘤直径、肿瘤血供类型、TATI、SATI和肌肉减少症与HCC患者TACE联合PD-1单抗治疗的PFS显著相关(P<0.05)。多因素分析结果显示肿瘤直径(HR=2.256,95%CI:1.453~3.819,P=0.001)、SATI(HR=0.330,95%CI:0.146~0.745,P=0.008)和肌肉减少症(HR=2.386,95%CI:1.446~3.935,P=0.001)是PFS的独立预后因素(表2)。肌肉减少症、低SATI和肿瘤直径≥5 cm接受TACE联合PD-1单抗治疗的肝细胞癌患者PFS不佳相关。患者中位PFS,高SATI者明显长于低SATI者[8.5(95%CI:5.9~11.3) 月 vs. 4.6(95%CI:2.9~6.0)月,P<0.001];非肌肉减少症者要长于肌肉减少症者[9.0(95%CI:5.9~12.2)月 vs. 4.9(95%CI:2.9~6.0)月,P=0.001],其生存曲线见图2。
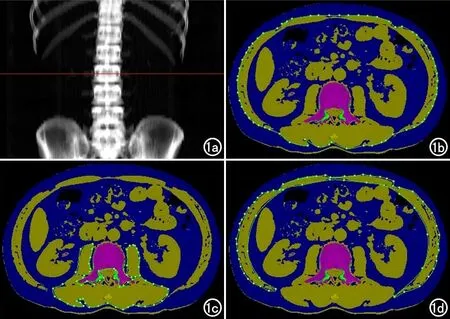
图1 定量CT身体成分测量示意图。a)定位L3椎体水平;b)测量 L3椎体层面皮下脂肪面积、内脏脂肪面积和总脂肪面积;c)测量L3椎体层面椎体周围肌群面积;d)测量L3椎体层面腹部肌群面积。
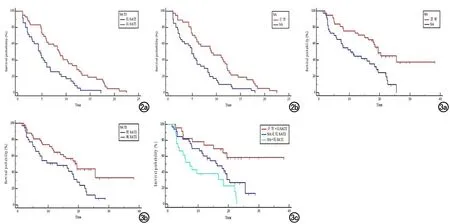
图2 所有患者PFS的Kaplan-Meier曲线。a)高皮下脂肪指数与低皮下脂肪指数患者的PFS;b)肌肉减少症和非肌肉减少症患者的PFS。

表2 无进展生存期的单因素和多因素分析结果
4.总生存期对比分析
截至止随访时间,全部患者中共有52(52/77,67.5%)例患者死亡,中位生存时间为16.7月(95% CI:12.4~20.1)。患者总生存期,非肌肉减少症者要长于肌肉减少症者[中位OS:19.5(95%CI:16.3~25.5)月 vs. 10.4(95%CI:7.3~18.4)月,P<0.05]、高 SATI患者长于低SATI患者[中位OS:19.5(95%CI:11.9~25.5)月 vs. 13.0(95%CI:5.9~18.5)月,P<0.05]。对肌肉减少症和SATI进行组合行分析,分为三个亚组:非肌肉减少症合并高SATI组(23例)、肌肉减少症或低SATI组(33例)、肌肉减少症合并低SATI组(21例),结果显示非肌肉减少症合并高SATI组的1年和2年生存率分别为73.9%和65.1%;肌肉减少症或低SATI组1年和2年生存率分别为60.1%和30.0%;肌肉减少症合并低SATI组1年和2年生存率分别38.1%和0;非肌肉减少症合并高SATI组生存率明显高于其他两组,而肌肉减少症合并低SATI组的生存率最差,差异具有统计学意义(P<0.05),生存曲线见图3。
讨 论
肌肉和脂肪组织含量是肿瘤患者预后的重要预测指标之一[8]。骨骼肌是人体最大的器官,具有调节全身代谢、炎症和胰岛素抵抗的作用[9]。肿瘤患者由于年龄、饮食摄入减少、恶液质状态或肿瘤细胞释放的促炎性细胞因子等因素影响,引起骨骼肌消耗导致肌肉减少症[10]。已有文献对肌肉减少症与肝癌患者治疗预后相关性进行报道,如Lanza等[11]对肝细胞癌患者TACE治疗的预后与肌肉减少症之间的关系进行研究,结果表明肌肉减少症与TACE术后死亡率增加有关;Nishikawa等[12]研究发现,在索拉非尼治疗的肝癌患者中,肌肉减少症患者的生存时间要明显低于非肌肉减少症患者;Yang等[13]发现肌肉减少症与肝癌患者肝切除术后的短期预后不良相关。另外,有研究提示脂肪组织的含量会影响肿瘤患者免疫治疗的疗效[14],如Makrakis等[15]研究发现低皮下脂肪含量的非小细胞肺癌患者接受免疫治疗生存率更差。但是,目前关于肌肉减少症和脂肪组织含量与肝癌TACE联合免疫治疗预后相关性的研究较少。基于此,本研究探讨肝细胞癌患者治疗前肌肉减少症和脂肪组织含量与TACE联合PD-1单抗治疗预后的相关性。
L3椎体层面的骨骼肌总面积与全身骨骼肌含量相关性最高[16],可以很好地评估肌肉减少症。本研究使用QCT测量L3椎体层面所有骨骼肌(腰大肌、竖脊肌、腰方肌、腹横肌、腹外斜肌和腹内斜肌)总面积,肌肉减少症的发病率为51.9%(44/77)。肝癌患者由于肝硬化和肝功能异常等慢性肝病影响会更易患上肌肉减少症[17],这在本研究中也得到证实,即具有肝硬化背景的HCC患者肌肉减少症发病率(39/68,57.4%)要明显高于没有肝硬化背景的肝癌患者(1/9,11.1%)。本研究多因素Cox回归分析显示HCC患者TACE联合PD-1单抗治疗前患有肌肉减少症是预后的独立影响因素,提示肌肉减少症患者预后较差,这与先前研究结论一致。
本研究通过QCT测量总脂肪、内脏脂肪和皮下脂肪面积。多因素分析表明,三种脂肪成分中皮下脂肪指数是影响PFS的独立因素。高SATI(SATI>30.52 cm2/m2)患者TACE联合PD-1单抗治疗的中位PFS和OS明显高于低SATI(SATI≤30.52 cm2/m2)患者(8.5月 vs. 4.6月,19.5月 vs. 13.0月)。SATI高说明该类患者具有较好的营养状态,可以更好地抵御肿瘤带来的能量消耗[18]。皮下脂肪组织是瘦素分泌的主要来源,研究表明瘦素可以直接诱导T细胞上的PD-1受体表达,更容易被PD-1单抗阻断,从而改善免疫治疗的反应[19],使患者生存获益。
此外,本研究也发现肿瘤直径≥5 cm的患者短期内对于TACE联合PD-1单抗治疗预后更差。肝细胞癌的肿瘤负荷,是治疗选择中的主要问题。既往研究表明[20],与肿瘤直径小和单个肿瘤的患者相比,肿瘤直径大且肿瘤多发的患者预后较差,肿瘤大小和数量是HCC病例的潜在预后因素,与肿瘤的分期密切相关,无论局部区域或全身治疗,本研究结论与先前研究一致[21,22],肿瘤直径≥5 cm的患者预后较差。
本研究的局限性:①手动勾画肌肉面积与真实情况的误差难以完全消除;②治疗前未在本院行CT检查或CT图像无法分析的患者不包括在本研究中,可能会引起选择偏倚。
综上所述,肌肉减少症、皮下脂肪指数及肿瘤直径是肝细胞癌患者TACE联合PD-1单抗治疗的独立预后因素,尤其是定量CT评估的肌肉减少症和低皮下脂肪含量与此类患者预后不良相关。
