山兰米醋发酵过程中理化指标及挥发性风味物质的变化规律
2024-03-20吴晓茜钟秋平张云竹
吴晓茜,钟秋平*,张云竹
1(海南大学 食品科学与工程学院,海南 海口,570228)2(海南大学 生物医学工程学院,海南 海口,570228)
“山兰稻”是海南省黎族地区独有的山地旱稻。山兰米营养价值极高,相比于普通稻谷,铁、硒、锌等微量元素含量较高,是酿造米醋的优选原料[1]。米醋是以大米为原料,经过糖化、酒精发酵和醋酸发酵等工艺酿制而成的一种调味品。食醋不仅是一种酸性调味品,而且还具有促进消化、软化血管、消除疲劳、降低血脂和调节血压等功效。风味物质是反应米醋品质的重要指标之一,包括挥发性和非挥发性成分。其中非挥发性物质包含有机酸和游离氨基酸[2]。米醋中的氨基酸主要来源于原料中的蛋白质降解作用,能够缓冲醋酸带来的刺激,使醋的口感更加柔和。在醋酸发酵阶段,许多微生物生长繁殖,形成大部分醋的风味物质[3]。有机酸是食醋中酸味的主要来源,其主要成分是乙酸,具有清爽和刺激的风味,而乳酸是食醋含量最多的非挥发性酸,口感柔和,它们共同协调构成食醋独特的风味和特点[4]。近年来,越来越多人注重健康和膳食营养,许多具备功能性的食醋正在被研究和开发。如徐融融等[5]利用铁皮石斛为原料开发药食同源植物铁皮石斛的食醋产品;杨成瑞等[6]利用以云南产马尾松松针为原料酿造马尾松松针醋;马敬[7]利用青稞麸皮替代小麦麸皮酿醋开发具有良好抗氧化效果的食醋;SU等[8]以兔眼蓝莓为原料制作蓝莓醋等。而采用山兰米发酵食醋的研究尚未报道。
在酿制过程中,理化性质和风味物质的变化都会对小米醋的品质产生影响。本研究以山兰黄酒为原料,通过稀释发酵环境酒精度至最适醋酸发酵酒精度,而后添加醋酸菌进行醋酸发酵,开发一种具有保健功能的山兰米醋产品。同时对醋酸发酵阶段的总酸、pH这两个理化指标进行跟踪测定,分析其动态变化;通过高效液相色谱法分析发酵过程中游离氨基酸和有机酸含量的变化规律;采用顶空固相微萃取气质联用(headspace-solid phase micro-extraction - gas chromatography-mass spectrometry, HS-SPME-GC-MS)风味分析技术对醋酸发酵过程中挥发性风味物质进行跟踪检测,揭示山兰米醋风味物质的变化规律,并筛选出醋酸发酵过程中的差异性成分,为山兰米醋产品开发提供一定的理论支撑。
1 材料与方法
1.1 材料与试剂
醋的制作:山兰酒糟、酒液和纯净水等比例混合,置于80 ℃水浴锅中灭菌15 min,取出冷却至室温后,添加原料1%~3%(体积分数)的醋酸菌,将其放在30 ℃的摇床进行醋酸菌发酵,每天测定总酸含量,待3 d的总酸稳定,结束醋酸发酵。醋醅取4个不同发酵时间的样品[第3天(Acid-3 d),第7天(Acid-7 d),第11天(Acid-11 d),第15天(Acid-15 d)],每天同一时间取样,样品于0~4 ℃保存。
醋酸杆菌培养:配制10 g/L葡萄糖水活化醋酸菌2 d,然后进行醋酸发酵。
甲醇/乙腈/甲酸、3-硝基苯肼/1-(3-二甲氨基丙基)-3-乙基碳二亚胺(色谱级),安谱;盐酸(分析纯),国药;衍生试剂,Waters;NaOH(分析纯),天津欧博凯化工有限公司;草酸、乳酸、乙酸、酒石酸等有机酸标准品,sigma公司。
1.2 仪器与设备
Q Exactive质谱仪、Vanquish超高压液相色谱仪,Thermo;Eppendorf 5430R低温高速离心机、Tissuelyser-48组织破碎仪,上海净信科技有限公司;pH计,上海雷磁仪器有限公司;8890气相色谱、7000D质谱、DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm),Agilent。
1.3 实验方法
1.3.1 总酸的测定
参照GB 12456—2021《食品中总酸的测定》的方法,称取25 g醋醅(精确至0.01 g)至250 mL容量瓶中,用无二氧化碳水定容至刻度,摇匀。用快速滤纸过滤,收集滤液,用于测定。
1.3.2 pH值的测定
用pH计直接测定醋醅浸泡后过滤的滤液。
1.3.3 有机酸的测定
称取适量样本(0.1~0.5 g),加入1 mL 提取液[V(甲醇)∶V(氯仿)=7∶3],充分混匀;冰上孵育提取30 min;加入600 μL H2O,混匀;4 ℃下12 000 r/min离心10 min,取上清液,重复提取1次,4 ℃下12 000 r/min离心10 min,取上清液,稀释20倍,取40 μL样品衍生化上机。
液相色谱条件:色谱柱:Waters BEH C18(50 mm×2.1 mm,1.8 μm);流动相:A相为0.1%甲酸水溶液,B相为0.1%甲酸乙腈溶液;流速0.35 mL/min;柱温40 ℃;进样量2 μL;洗脱梯度:0.0 minV(水)∶V(乙腈)=90∶10;2.0 minV(水)∶V(乙腈)=90∶10;12.0 minV(水)∶V(乙腈)=10∶90;14.0 minV(水)∶V(乙腈)=10∶90;14.1 minV(水)∶V(乙腈)=90∶10;16.0 minV(水)∶V(乙腈)=90∶10。整个分析过程中样品置于4 ℃自动进样器中。
质谱条件:采用美国Thermo公司的Q Exactive高分辨质谱检测系统进行的采集。电喷雾离子源(electrospray ionization,ESI)条件如下:鞘气40 arb;辅助气10 arb;离子喷雾电压-2 800 V;温度350 ℃;离子传输管温度320 ℃。扫描模式为Fullms-ms2模式;扫描方式为负离子。一级扫描范围(m/z)120~1 500。
1.3.4 游离氨基酸的测定
样品制备和提取:样品中加入0.6 mL 0.1 mol/L HCl于室温下搅拌提取1 h,每个样品通过0.22 μm孔膜过滤器过滤。取10 μL样品于萃取瓶,加入70 μL硼酸缓冲液和20 μL AccQ·Tag试剂。反应混合物在室温下静置1 min, 55 ℃加热10 min,冷却后注入1 μL上机分析。
液相色谱条件:色谱柱:Waters BEH C18(50 mm×2.1 mm,1.7 μm);流动相:A相为超纯水(含0.1%甲酸),B相为乙腈(含0.1%甲酸);流速0.5 mL/min;柱温55 ℃;进样量1 μL;洗脱梯度:0 minV(水)∶V(乙腈)=95∶5;5.5 minV(水)∶V(乙腈)=90∶10;7.5 minV(水)∶V(乙腈)=75∶25;8 minV(水)∶V(乙腈)=40∶60;8.5 minV(水)∶V(乙腈)=95∶5;13 minV(水)∶V(乙腈)=95∶5。整个分析过程中样品置于4 ℃自动进样器中。
质谱条件:采用美国Thermo公司的Q Exactive高分辨质谱检测系统进行的采集。采用ESI,鞘气40 arb;辅助气10 arb;离子喷雾电压+3 000 V;温度350 ℃;离子传输管温度320 ℃。扫描模式为全扫(Full MS)模式;扫描方式为正离子。一级扫描范围(m/z)150~700。
1.3.5 风味物质的测定
样品提取:从-80 ℃取出样品,涡旋混合均匀,吸取1 mL样品置于顶空瓶中,分别加入饱和NaCl溶液,10 μL(50 μg/mL)内标溶液。在60 ℃恒温条件下,振荡5 min,120 μm DVB/CWR/PDMS萃取头插入样品顶空瓶,顶空萃取15 min,于250 ℃下解析5 min,然后进行GC-MS分离鉴定。采样萃取头在Fiber Conditioning Station中250 ℃下老化5 min。
色谱条件:DB-5MS毛细管柱,载气为高纯氦气(纯度≥99.999%),恒流流速1.2 mL/min,进样口温度250 ℃,不分流进样,溶剂延迟3.5 min。程序升温:40 ℃保持3.5 min,以10 ℃/min升至100 ℃,再以7 ℃/min升至180 ℃,最后以25 ℃/min升至280 ℃,保持5 min。
质谱条件:电子轰击离子源(EI),离子源温度230 ℃,四级杆温度150 ℃,质谱接口温度280 ℃,电子能量70 eV,扫描方式为选择离子检测模式(SIM),定性定量离子精准扫描(GB 23200.8—2016)。
1.4 数据分析
使用Excel进行基本的数据处理,SPSS 23进行显著性数据分析,结果表示为平均值±标准差。所有的实验均重复3次。采用Origin 2022进行总酸和pH作图。基于自建数据库,对样本的代谢物进行质谱定性定量分析。用MassHunter定量软件打开样本下机质谱文件,进行色谱峰的积分和校正工作。采用多元统计分析,包括采用无监督的主成分分析(principal component analysis,PCA)来观察各组样本之间的总体代谢物差异和组内样本之间的变异度大小。基于正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)结果,从变量重要性投影(variable importance in projection,VIP≥1)初步筛选出组织间差异的代谢物,同时结合差异倍数值(fold change≤0.05)来进一步筛选出差异代谢物。
2 结果与分析
2.1 山兰米醋发酵过程中总酸和pH值的变化
总酸和pH值是评价米醋品质的重要指标[9]。米醋发酵过程中总酸和pH值的变化如图1所示。醋醅为微生物生长繁殖提供营养成分,醋酸菌大量生长繁殖,将原料中的一些化合物转化成酸类物质。米醋发酵的过程中总酸含量逐渐增加,在发酵15 d时达到最大值(4.64 g/100 mL)并趋于稳定,显著高于发酵初期第3天(1.32 g/100 mL)。与发酵前期相比,发酵后期总酸含量变化较小,这可能是由于前期醋酸菌等产酸微生物生长旺盛,促使产生较多酸性物质导致发酵环境酸度较高,以及后期醋醅中的营养物质所剩无几,抑制了醋酸菌等产酸菌的生长代谢。同时,随着发酵的进行,pH值从初期的4.23下降到发酵结束的3.64。

图1 山兰米醋发酵过程理化指标的变化Fig.1 Changes of physicochemical indexes in the fermentation process of Shanlan rice vinegar
2.2 山兰米醋发酵过程中有机酸的变化规律
有机酸是酸味物质的主要来源,构成醋中独特的风味和风格[10-11]。在山兰米醋发酵过程中,共检测到27种有机酸,如表1所示。总体上,发酵过程中乙酸和乳酸的相对含量占比最大,发酵结束时含量分别达到729.91、927.59 mg/L。作为米醋中两种主要的有机酸,共占有机酸总含量的72%左右。乙酸含量随着发酵的过程逐渐增加,从415.91 mg/L提升至927.59 mg/L,而乳酸含量则随着发酵的进行逐渐减少,从1 389.59 mg/L下降至729.91 mg/L,这与LI等[12]研究结果一致。分析原因可能是乳酸菌在有O2存在的条件下代谢生长缓慢,产物乳酸生成降低,且在发酵后期由于乙醇和葡萄糖被大量耗尽,乳酸则作为被醋酸菌利用的碳源。而醋酸菌在每天供氧的条件下,分泌乙醇脱氢酶和乙醛脱氢酶将乙醇氧化生成乙酸[13]。酒石酸、衣康酸和戊酸等有机酸占比相对较小,可能是因为在微生物代谢的过程中难以大量积累。琥珀酸和草酸两种有机酸呈现逐渐下降的趋势,琥珀酸由535.12 mg/L下降至404.06 mg/L,草酸由38.03 mg/L下降至6.05 mg/L。柠檬酸在发酵过程中由发酵前期的93.83 mg/L下降至中后期的27.4 mg/L,而后又上升至79.19 mg/L。综上所述,在米醋发酵的过程中,这些有机酸之间相互协调,缓冲乙酸味道的刺激性,丰富了米醋的口感,使得米醋酸而不涩。
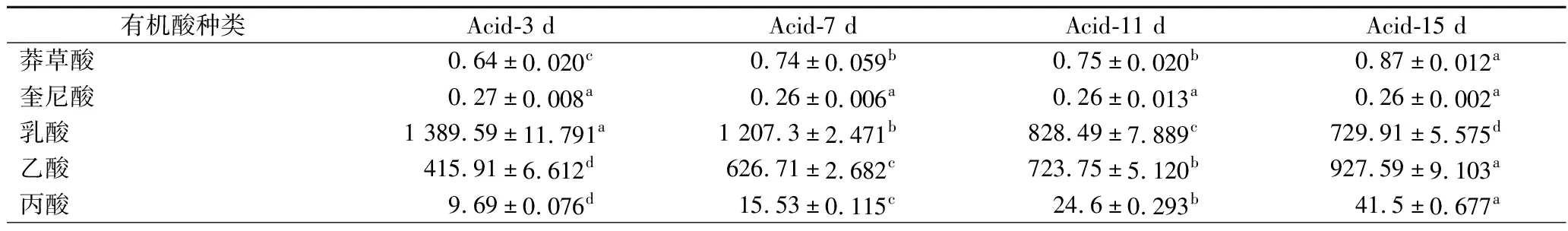
表1 山兰米醋发酵过程中各种有机酸含量的变化 单位:mg/L
2.3 山兰米醋发酵过程中游离氨基酸的变化规律
氨基酸是米醋中重要的呈味物质,能够为米醋提供鲜、甜、苦等滋味,缓冲米醋中酸味的刺激,使得口感更柔和[2]。采用超高效液相色谱法对山兰米醋发酵过程4个阶段游离氨基酸的含量进行测定,共检测到22种游离氨基酸,如电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.035449,下同)。整个发酵过程中谷氨酰胺和丙氨酸含量最高,占总含量的30%左右。在发酵3、7、11、15 d积累的总游离氨基酸含量分别为(3 945.65±28.778)、(4 081.70±53.659)、(3 760.03±33.852)、(3 558.16±44.155) μg/mL,发酵过程中的总游离氨基酸含量发生显著变化(P<0.05),可以看出发酵的中期氨基酸总含量较高,这可能是因为乳酸菌和酵母菌分解蛋白质产生氨基酸,同时发酵初期到中期微生物大量生长繁殖分泌蛋白酶,将原料中的蛋白质分解产生氨基酸,而发酵后期的微生物数量减少、蛋白酶活力下降,同时乳酸菌会在脱羧酶的作用下利用游离的氨基酸产生一些多胺类的物质,导致游离氨基酸含量降低,使得游离氨基酸含量缓慢下降。根据氨基酸的呈味性质,可以分为苦味氨基酸、甜味氨基酸和鲜味氨基酸[9, 14]。甜味氨基酸和苦味氨基酸变化趋势基本保持一致,发酵初期到中期增加,随后略有减少,发酵结束后米醋中的甜味氨基酸和苦味氨基酸的含量分别为(1 573.96±10.734)、(723.13±18.097) μg/mL。鲜味氨基酸含量从发酵初期到发酵结束呈现逐渐下降的趋势,发酵结束后含量为(463.24±5.971) μg/mL。成品米醋中呈味分布为甜味氨基酸>苦味氨基酸>鲜味氨基酸,甜味最为明显,中和醋中的酸味,增加米醋的味道协调性。
2.4 山兰米醋发酵过程中代谢物分布特征分析
2.4.1 山兰米醋发酵过程中挥发性化合物
通过HS-SPME-GC/MS技术,在山兰米醋发酵不同阶段中共鉴定出175种挥发性代谢物,其中包括酯类、萜类、酸类等物质,如图2所示。其中酯类化合物的种类最丰富(21.71%),其次为萜类化合物(17.71%)和杂环化合物(16%)。在米醋发酵过程中杂环化合物一般对米醋香味影响较小,但大多数酯类物质具有花香、果香和酯香,而萜类物质带有木质香和天然香气,为米醋风味贡献很大的作用[15]。

图2 山兰米醋发酵过程中挥发性代谢物的分类Fig.2 Classification of volatile metabolites in the fermentation of Shanlan rice vinegar
2.4.2 PCA
通过对山兰米醋发酵不同时间各样本以及质控样本进行PCA,可以从总体上反映各样本组间的总体差异以及组内样本之间的变异度大小。图3为山兰米醋发酵不同时间各样本及质控样本的PCA图,第一主成分的贡献率为67.64%,第二主成分的贡献率为14.77%,二者累积贡献率为82.41%,可以较好地反映山兰米醋中的挥发性成分。从图3所表示的象限中看,Acid-11 d、Acid-15 d和PC1呈现正相关,而Acid-3 d、Acid-7 d呈现负相关。此外Acid-3 d、Acid-15 d 和PC2呈现正相关,Acid-7 d、Acid-11 d和PC2呈现负相关。以上结果表明,山兰米醋发酵不同时间的各组样本之间完全分离并表现出显著差异,整体说明发酵过程中代谢物差异较大,质控组内平行样本成分接近,聚集在PCA图的中心附近,表明方法稳定性较好,数据质量可靠。

图3 山兰米醋发酵不同阶段样本及质控的PCA得分图Fig.3 PCA scores of samples and quality control at different stages of fermentation of Shanlan rice vinegar
2.4.3 山兰米醋发酵过程中代谢物的OPLS-DA及模型验证
与PCA相比,OPLS-DA能够将X矩阵信息分解成与Y相关和不相关的两类信息,通过去除不相关的差异来筛选差异变量,使组间区分最大化,有利于寻找差异代谢物。OPLS-DA模型得分散点图如电子版增强出版附图1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.035449,下同),其中横坐标表示预测主成分,可以看出组间的差距。纵坐标表示正交主成分,可以看出组内的差距,纵向距离越近表明组内重复性越好。百分比表示该成分对数据集的解释率。图中的每个点表示一个样品,同一个组的样品使用同一种颜色表示。OPLS-DA评价模型的预测参数有R2X、R2Y和Q2,其中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2表示模型的预测能力,这3个指标越接近于1表示模型越稳定可靠,Q2>0.5可认为是有效的模型,Q2>0.9为出色的模型。电子版增强出版附图2为OPLS-DA模型置换验证图,横坐标表示模型R2Y,Q2值,纵坐标是模型分类效果出现的频数,即本模型对数据进行200次随机排列组合实验,一般情况下,P<0.05时模型最佳。由附图1-a可知,Acid-3 d和Acid-7 d两组分别位于置信区间的左右两侧,并且Acid-3 d和Acid-7 d之间具有明显的区分度。PC1和PC2的贡献率为41.5%和36.1%,R2Y=0.994、Q2=0.936,P<0.05,证实了该OPLS-DA模型拟合度好,具有预测性和稳定性。由附图1-b可知,Acid-3 d和Acid-11 d两组分别位于置信区间的左右两侧,并且Acid-3 d和Acid-11 d之间具有比较明显的区分度。PC1和PC2的贡献率为50.6%和24.4%,R2Y=0.992、Q2=0.923,P<0.05。由附图1-c可知,Acid-3 d和Acid-15 d两组分别位于置信区间的左右两侧,并且Acid-3 d和Acid-15 d之间具有明显的区分度。PC1和PC2的贡献率为 46.1%和39.9%,R2Y=0.995、Q2=0.977,P<0.05,证实了3组OPLS-DA两两实验组对比模型拟合度好,具有预测性和稳定性。由附图1可以看出,每两组样本之间区分非常显著,样本全部处于95%置信区间内,表明山兰米醋发酵过程中的代谢物存在显著差异,可用于后续代谢物差异分析。
2.4.4 差异代谢物聚类分析和筛选
为了更直观地观察到发酵过程中不同阶段差异代谢物含量的变化趋势,采用聚类分析方法对山兰米醋发酵过程中的差异代谢物进行分析。电子版增强出版附图3说明了代谢物在山兰米醋发酵过程中的变化规律。根据附图3-a的样本聚类的树状图分析,将发酵过程分成两个区域,Acid-3 d的3个平行样本为第1区域,Acid-7 d、Acid-11 d和Acid-15差异代谢物聚成一类为第2区域,Acid-3 d大多数代谢物颜色比其他3个阶段的深,而其他3个阶段中Acid-15 d的代谢物丰度又比其他两组高。由附图3可知,Acid-7 d和Acid-11 d的差异代谢物数量较少,说明在发酵中期到中后期代谢物的变化较小,即代谢物表达量变化的趋势相接近[16]。苯甲醛、苯甲酸烯丙酯、β-苯乙酸乙酯、苄丁醚、吡啶甲酰胺和1-(2-呋喃基)-1-戊酮等随着发酵时间的延长,代谢物含量逐渐增加,在发酵结束时达到最大。有50%的差异代谢物的含量随着发酵的进行呈现递减的趋势,包括9-十六碳烯酸乙酯、油酸乙酯和十六烷酸乙酯等。由附图3-b可知,随着发酵时间的延长,差异代谢物的数量逐渐减少,并且筛选出的主要差异代谢物集中在酯类、醇类、酸类、酮类和杂环化合物等。
基于OPLS-DA结果,以同时满足OPLS-DA模型的VIP>1.0,t检验的P<0.05为标准,筛选山兰米醋发酵不同阶段样品间的差异代谢产物,结果见电子版增强出版附表2。在醋酸发酵的不同阶段共检测到41种差异性代谢物。醋的味道一般来自醇类、酯类、醛类、酸类和酮类等各种化合物相互协调配合[17]。与Acid-3 d组相比较,4种酸类化合物[油酸、(Z,Z)-9,12-十八碳二烯酸、11-顺-十八碳烯酸和(Z,Z,Z)-9,12,15-十八碳三烯酸]在Acid-15 d组中的含量发生显著下降,从高含量降至低含量。醋中的醇类物质大多来自于原料,或者酒精发酵阶段微生物作用下的产物。4组样本共检测到丙二醇、己醇、(E)-4-己烯-1-醇和3,7,11,15-四甲基-2-十六烯-1-醇4种醇类差异代谢物,这些丰富的挥发性化合物,是醋中的香气活性物质[18]。丙二醇、己醇都属于杂油醇,是谷物通过酒精发酵后的产物。醋中含有少量的高级醇,能够赋予醋特殊的味道,并起到衬托酯香的作用,使醋香更加完美。醛类和酮类因为分子中均含有羰基所以合称为羰基化合物,在米醋发酵过程中共检测到8种羰基类代谢差异化合物。醋中主要的酮类物质为乙偶姻(3-羟基-2-丁酮),乙偶姻带有淡淡的奶油酸奶香气[19-20]。乙偶姻是众多微生物作用的产物,在醋的酿制过程中由α-乙酰乳酸脱羧酶转化双乙酰产生,是醋中常见的香气化合物。由附图3和附表2可以看出,乙偶姻在醋酸发酵过程中逐渐被消耗。发酵期间,醛类差异代谢物只有3个,包括环己烷甲醛、苯甲醛和十八醛。苯甲醛含有杏仁香味,能够增加山兰米醋的风味。在发酵第3天和第7天含量几乎没有发生变化,而在中后期其含量发生大幅度上升。十八醛具有强烈的椰子油香气,在发酵期间缓慢减少。酯类化合物一般由酸与醇的共同反应生成,多数酯类化合物具有花果香气,可使米醋具有理想的风味[21]。检测到发酵过程中的酯类差异代谢物共有12种,占差异代谢物数量的29%。其中,十六烷酸乙酯、9-十六碳烯酸乙酯、β-苯乙酸乙酯和(4Z,15Z)-4,15-十八碳烯乙酸酯等酯类含量较大。β-苯乙酸乙酯具有甜甜的玫瑰花香味,其含量在发酵期间变化最大,呈现逐渐递增的趋势。油酸乙酯由油酸和醇类物质酯化反应生成,油酸乙酯含量在醋酸发酵过程中逐渐减少,考虑与油酸含量减少有关。萜类化合物的产生主要来源于米醋的原料,β-紫罗兰酮具有木质香韵,是合成视黄醇、β-胡萝卜素和维生素A等的前提化合物,具有抗癌作用[22],其含量随着发酵的过程缓慢增加。
2.4.5 差异代谢物的代谢通路分析
山兰米醋的发酵过程受到多种因素的共同调控,需进一步对其代谢通路进行分析,找到发酵过程中潜在的代谢途径。因此,根据山兰米醋发酵不同阶段差异代谢物的结果,进行KEGG通路富集分析,其中Rich Factor为对应通路中差异代谢物个数与该通路注释到的代谢物总数的比值,该值越大表示富集程度越大,P值越接近于0,表示富集越显著,结果见图4。点的颜色反映P值大小,越红表示富集越显著,点的大小代表富集到相应通路上的差异显著代谢物个数。由图4可知,参与山兰米醋发酵过程的关键代谢通路共有17条,主要的相关代谢途径有植物次生代谢产物的生物合成通路、不饱和脂肪酸的生物合成通路、二萜生物合成通路、次生代谢产物的生物合成通路、代谢途径通路、芳香族化合物降解通路和不同环境下的微生物代谢通路。且不同环境下的微生物代谢通路的富集程度最为显著,次生代谢产物的生物合成通路、植物次生代谢产物的生物合成通路和不饱和脂肪酸的生物合成通路的富集程度最高。

图4 山兰米醋发酵过程中差异代谢物通路富集分析Fig.4 Enrichment analysis of differential metabolite pathway during fermentation of Shanlan rice vinegar
将关键代谢通路中主要参与的差异代谢物与代谢路径进行整合,如图5所示。图中标红的表示发酵过程中的主要差异性代谢。由图5可知,主要参与的差异代谢物有6种,分别为丙二醇、苯甲醛、反式香叶基香叶醇、油酸、(Z,Z,Z)-9,12,15-十八碳三烯酸和(Z,Z)-9,12-十八碳二烯酸。在山兰米醋发酵过程中,乙酰辅酶A先转化成丙二酰辅酶A,而后将饱和脂肪酸氧化生成不饱和脂肪酸[油酸、(Z,Z,Z)-9,12,15-十八碳三烯酸、(Z,Z)-9,12-十八碳二烯酸]。苯甲醇在芳基醇脱氢酶的作用下生成苯甲醛,苯甲醛在苯甲醛脱氢酶的作用下生成苯甲酸酯,苯甲酸酯在二羟基环己二烯羧酸脱氢酶的作用下生成邻苯二酚,邻苯二酚经过多重转化形成琥珀酰辅酶A,琥珀酰辅酶A在氧化酶的催化下最终生成乙酰辅酶A,进入代谢循环。葡萄糖在醛缩酶的作用下生成磷酸甘油酮,在甘油脱氢酶的作用下磷酸甘油酮转化成L-乳醛,L-乳醛在乳醛酸还原酶作用下产生丙二醇。香叶基焦磷酸经过香叶酰二磷酸酶的作用生成萜类物质反式香叶基香叶醇。综合代谢通路的分析结果,这些关键代谢物质可能影响山兰米醋的风味和品质。

图5 山兰米醋发酵过程中差异代谢物途径分析Fig.5 Analysis of differential metabolite pathway during fermentation of Shanlan rice vinegar
3 结论
以山兰米醋为研究对象,对发酵过程中的理化性质、游离氨基酸、有机酸和风味代谢物进行定量分析。山兰米醋发酵过程中总酸含量逐渐增加,而pH值呈现缓慢下降趋势,两者呈现负相关。在山兰米醋不同发酵阶段共检测到27种有机酸,其中乳酸和乙酸的含量较高,占有机酸总含量的72%左右,是山兰米醋中的两种主体有机酸,而酒石酸、衣康酸和戊酸等有机酸含量占比相对较小。整个发酵过程中谷氨酰胺和丙氨酸含量最高,而游离氨基酸总含量在发酵的中期较高,成品米醋中呈味分布为甜味氨基酸>苦味氨基酸>鲜味氨基酸。基于PCA和OPLS-DA结果分析,发酵不同阶段的代谢物差异较大,共检测到41种差异代谢物。通过分析发酵过程中差异代谢物相对含量的变化,发现随着发酵时间的延长,大部分差异代谢物的相对含量显著增加。山兰米醋的发酵过程受到多种因素的共同调控,通过对差异代谢物的代谢途径进行分析,筛选出17条关键代谢通路,发现不同环境下的微生物代谢通路的富集程度最为显著,次生代谢产物的生物合成通路、植物次生代谢产物的生物合成通路和不饱和脂肪酸的生物合成通路的富集程度最高。
