Hcy 促血管平滑肌细胞增殖迁移相关的miRNAs 筛选研究
2024-03-20王秀玉莫廷润张鸣号
马 星, 桂 娜, 马 婷, 王秀玉, 莫廷润, 张鸣号
(1.宁夏医科大学基础医学院,银川 750004; 2.国家卫生健康委员会代谢性心血管疾病研究重点实验室,银川 750004; 3.宁夏血管损伤与修复研究重点实验室,银川 750004; 4.宁夏贺兰县人民医院,贺兰 750200)
同型半胱氨酸(homocysteine,Hcy)是引起动脉粥样硬化(atherosclerosis,As)的独立危险因素[1]。血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖和迁移在Hcy 致As 发病过程中发挥着重要作用[2],但Hcy 致VSMC 增殖迁移的发生机制尚不十分清楚。微小RNA(microRNAs,miRNAs)可以通过影响miRNA 降解或翻译,调控蛋白质的表达,在基因转录后调节中起着重要作用[3]。近年来的研究发现,miRNAs 参与调控As发生、发展的病理生理过程[4]。在Hcy 致VSMC 增殖迁移过程中是否受miRNAs 的调控有待进一步研究。本研究旨在探讨Hcy 致VSMC 增殖迁移过程中miRNAs 的差异表达,并分析预测其下游靶基因,以期为明确Hcy 致VSMC 增殖迁移的发病机制提供依据。
1 材料与方法
1.1 材料
人源VSMC 株(苏州北纳创联生物技术有限公司),Hcy(美国Sigma 公司),CCK-8 试剂盒(美国GlpBio 公司)。microRNA 快速提取试剂盒(北京艾德莱生物科技有限公司),small RNA-seq 文库构建试剂盒(南京诺唯赞生物科技股份有限公司),NovaSeq 6000 S4 测序试剂盒(美国Illumina公司),总RNA 提取试剂盒[天根生化科技(北京)有限公司],逆转录试剂盒(美国Thermo Fisher Scientific 公司)。
1.2 细胞培养
用含10%胎牛血清的DMEM 高糖培养基培养VSMC,使用第3~7 代细胞。当VSMC 的融合度达到80%后,将VSMC 分为Control 组和100 μmol·L-1Hcy 组[5-6]。100 μmol·L-1Hcy 刺激VSMC 48 h,采用CCK-8 实验检测VSMC 增殖;采用细胞划痕实验检测VSMC 迁移。
1.3 细胞增殖活力测定
VSMC 以100 μL/孔,1×103~1×104个细胞的密度接种于96 孔板24 h,使其附着。然后用含100 μmol·L-1Hcy 的实验培养基替换生长培养基。细胞孵育48 h。每孔中加入10 μL CCK-8,37 ℃孵育1 h。避光后取出96 孔板水平振荡30 s。用酶标仪在450 nm 处记录,各孔光密度=[OD(加药)-OD(空白)]/[OD(0 加药)-OD(空白)]×100%。
1.4 细胞划痕实验
用马克笔在6 孔板背后均匀地画出横线,作为标记。将VSMC 悬液以100 μL/孔(约5×103个细胞)的体积接种于6 孔板中,待细胞长至90%~95%融合后,用200 μL 的枪头按照马克笔画出的横线在细胞表面画线,然后吸去培养基,分别加入含0、100 μmol·L-1Hcy 的培养基培养0 h和48 h。将6 孔板取出,在显微镜下观察划痕的面积并拍照取样。采用Image J 软件测量划痕面积。
1.5 高通量测序
采用microRNA 快速提取试剂盒/TRIzol 试剂提取Control 组和Hcy 组VSMC 中的核酸,检测核酸浓度和完整性,构建small RNA-seq 文库,通过Illumina NovaSeq 6000 平台测序完成6个样品的small RNA 测序(各样品Q30≥85%),得到的原始图像数据文件经碱基识别(base calling)转化为原始测序序列(raw data 或raw reads),结果以FASTQ 文件格式存储,其中包含测序序列的序列信息及其对应的测序质量信息。
1.6 生物信息学分析
1.6.1 miRNAs 鉴定 使用BMKCloud(https://www.biocloud.net/)、miRBase(v22)数据库和miRDeep2软件包鉴定已知miRNAs 和预测新miRNAs,并对miRNAs 表达进行定量分析,筛选差异表达miRNAs。
1.6.2 miRNAs 的表达量分析 对各样本中miRNAs 进行表达量统计,并用TPM 算法[7]对表达量进行归一化处理。TPM 归一化处理公式为:TPM={(Readcount*1 000 000)over Mapped Reads}。公式中,Readcount 表示比对到某一miRNA 的reads 数目;Mapped Reads 表示比对到所有miRNAs 上的reads 数目。
1.6.3 差异表达miRNAs 的筛选 使用EdgeR软件[8]进行差异表达分析,获得两个样品之间的差异表达miRNAs。差异分组使用“A_vs_B”的方式命名。根据两(组)样品之间表达水平的相对高低,差异表达miRNAs 可以划分为上调miRNAs(Up-regulated miRNA)和下调miRNAs(Downregulated miRNA),上调miRNA 在样品(组)B 中的表达水平高于样品(组)A 中的表达水平,反之为下调miRNAs。
1.6.4 miRNAs 靶基因预测 采用miRanda 和TargetScan 软件进行差异表达miRNAs 的下游靶基因预测,使用BLAST 软件将预测靶基因序列与GO[9]和KEGG 数据库比对[10],获得可能的靶基因信息。
1.6.5 RT-qPCR 按照总RNA 提取试剂盒说明书进行VSMC 中的总RNA 提取,并逆转录成cDNA。逆转录反应条件:42 ℃15 min,37 ℃5 s,4 ℃保存。根据miRNA39、miRNA206 和miRNA212-5p 的基因序列,由广州锐博生物技术有限公司设计引物,PCR 引物序列见表1。RT-qPCR扩增反应条件:37 ℃30 s、95 ℃5 min、95 ℃10 s、55 ℃30 s、72 ℃30 s,共45 个循环。反应结束后,根据扩增曲线数据,对所得的Ct 值进行分析,利用公式2-ΔΔCt计算得到目的基因的相对表达量。ΔΔCt=(Ct 待测样本目的基因-Ct 待测样本内参基因)-(Ct 校正样本目的基因-Ct 校正样本内参基因)。

表1 PCR 引物序列
1.7 统计学方法
所有数据采用Graphpad Prism 5.0 软件进行统计分析。计量数据以均数±标准差(±s)表示,两组间比较采用t 检验,组间两两比较采用Stu-dent-Newman-Keuls 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 Hcy 促进VSMC 增殖
为了研究Hcy 对VSMC 增殖的影响,采用CCK-8 实验检测100 μmol·L-1Hcy 对VSMC 增殖的影响。结果显示,与Control 组比较,Hcy 组VSMC 的增殖能力增强(P<0.01),见图1。

图1 Hcy 对VSMC 增殖的影响
2.2 Hcy 促进VSMC 迁移
为了验证Hcy 对VSMC 迁移能力的影响,本研究使用了细胞划痕实验观察划伤细胞0 h 和48 h 后的迁移能力变化。与Control 组比较,Hcy组VSMC 的划痕面积在0 h 无变化,而在48 h时较Control 组减小(P<0.05),见图2。

图2 Hcy 促进VSMC 迁移
2.3 miRNAs 分析
2.3.1 miRNA 表达量总体分布与鉴定 miRNAs表达量总体分布图能反映样品中miRNAs 的整体表达模式,Control 组和Hcy 组VSMC 中共得到576 个miRNAs,其中已知miRNAs 404 个,新预测miRNAs 172 个,见图3、表2。

图3 各组VSMC 中TPM 密度分布图

表2 各组VSMC 中miRNAs 鉴定结果(个)
2.3.2 差异表达的miRNAs 与Control 组比较,Hcy 组存在88 个差异表达的miRNAs,其中表达上调的miRNAs 有20 个,表达下调的miRNAs 有68 个。通过miRNAs 功能分析,与增殖、迁移相关的miRNAs 共有20个,其中表达上调的miRNAs 包括miRNA39、miRNA206 和miRNA212-5p,表达下调的miRNAs 包括miRNA35 、miRNA25 、miRNA149、miRNA10、miRNA128、miRNA159、miRNA54、miRNA148、miRNA44 、miRNA106 、miRNA146 、miRNA6 、miRNA144、miRNA47、miRNA8、miRNA161 和miRNA90,见图4、图5。

图5 与VSMC 增殖和迁移相关的miRNAs 的差异表达
2.4 miRNAs 靶基因的预测分析
采用miRanda 和TargetScan 软件进行靶基因预测,显示576 个miRNAs 共存在9 966 个下游靶基因,见表3,使用BLAST 软件将预测靶基因序列与GO 和KEGG 数据库比对,分析靶基因的功能,见图6,获得与VSMC 增殖和迁移相关的差异miRNAs 的靶基因信息,见表4。

图6 各组VSMC 中差异表达miRNAs 靶基因的GO 分类统计图和KEGG 分类图
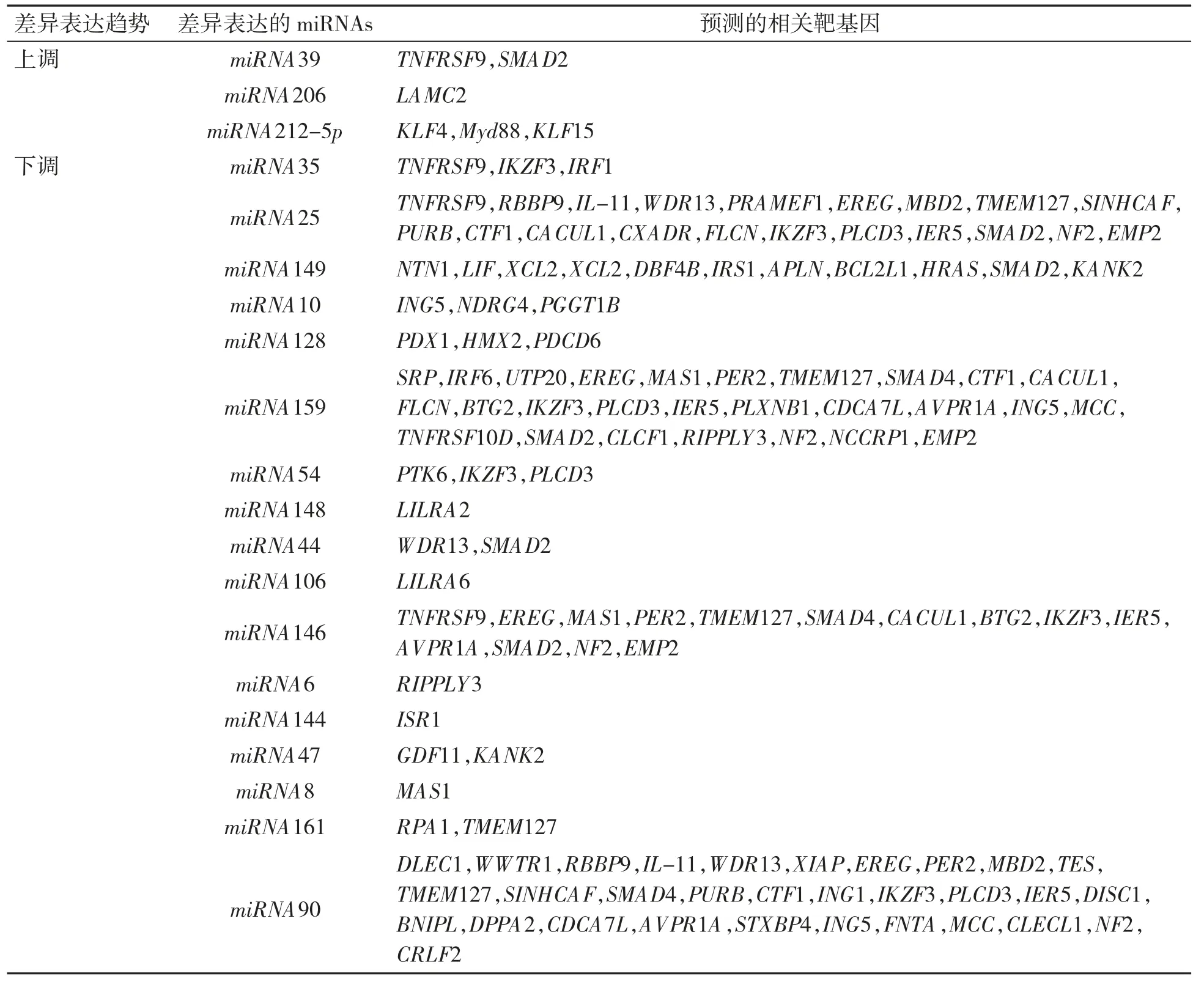
表4 与VSMC 增殖和迁移相关的差异miRNAs 的靶基因预测
2.5 Hcy 上调VSMC 中miRNA212-5p
为了验证差异表达miRNAs 预测的准确性,采用RT-qPCR 法检测两组细胞中miRNA39、miRNA206 和miRNA212-5p 的表达。结果显示,Hcy 组miRNA212-5p 的表达上调(P <0.05),miRNA206 和miRNA39 的表达差异无统计学意义(P>0.05),见图7。

图7 Hcy 对VSMC 中miRNA39、miRNA206 和miRNA212-5p 的表达的影响
3 讨论
As 是一个涉及复杂信号网络和多种效应分子的慢性炎症过程[11],As 的形成是致病因素和血管壁中的多种细胞,包括血管内皮细胞、淋巴细胞、单核/巨噬细胞、VSMC 等相互作用的结果[12],具体表现为血管内膜损伤、趋化因子和炎性因子激活、脂质浸润,内皮细胞功能紊乱,VSMC 增殖、迁移,巨噬细胞形成、迁移,泡沫细胞形成和粥样斑块形成等病理过程[13]。其中,VSMC 作为As斑块增殖体系中的活跃细胞之一[2],位于动脉管壁的中层,是As 斑块中巨噬细胞样细胞和泡沫细胞的主要来源[14]。当血管壁受到内外环境因素刺激,或VSMC 受到炎性因子、氧化应激、细胞因子、血管活性肽、药物损伤、机械作用等病理因素刺激后,可引起VSMC 增殖和凋亡平衡失调,出现VSMC 增殖和迁移。VSMC 的增殖和迁移与血管内皮细胞的损伤被认为是As 形成过程中的主要始动环节[15-16]。VSMC 过度增殖并穿过基底膜向血管内皮下迁移,通过吞噬脂质转变成泡沫细胞,最终发展为纤维斑块[17]。目前虽然对于As已有较多研究,但对VSMC 增殖和迁移的发生机制尚不十分清楚。
Hcy 是一种含硫氨基酸,是甲硫氨酸(蛋氨酸)代谢的中间产物。Hcy 诱发As 是经多种通路相互作用、相互关联的,血浆Hcy 每增加5 μmol·L-1,相当于胆固醇升高0.5 mmol·L-1,而血管危险性约增加1/3[1]。Hcy 可以通过影响内皮细胞和VSMC 功能,参与氧化应激和炎症反应,以及PI3K、p53、PTEN、MFN2、PDG 等改变基因表达活性等多种机制,促进As 的发生发展[6]。在本研究中,100 μmol·L-1Hcy 干预促进了VSMC 的增殖和迁移,这与既往的研究结果一致[2,6,17]。然而Hcy 引起VSMC 增殖和迁移的机制尚不十分明确。
miRNAs 为内源性非编码的短链RNA,是一种高效且特异的基因表达调控因子,通过与特定靶基因(miRNA)的3’UTR(非翻译区)结合致miRNA 降解或翻译抑制,进而影响蛋白质的表达,调节靶蛋白参与细胞分化、增殖、凋亡和细胞信号传导等基本生物过程,在基因的转录后调节中起重要作用[18]。目前正在进行临床前开发的miRNAs 模拟物和miRNAs 抑制剂已显示出作为新型治疗药物的前景。多种技术平台已被开发用于miRNAs 分离、miRNAs 定量、miRNAs 谱分析、miRNAs 靶点检测和调节体内外miRNAs 水平[19]。研究[4]发现,miRNAs 参与调控As 形成、发展的病理生理过程,参与调节血管内皮细胞、巨噬细胞及平滑肌细胞等多种细胞的生物学功能。但是在Hcy 诱导VSMC 增殖和迁移的过程中,Hcy 是否通过差异表达的miRNAs 影响VSMC 的增殖和迁移,尚需要进一步研究。
本研究在Hcy 诱导VSMC 增殖和迁移的基础上,通过高通量测序分析各组VSMC 中差异化表达的miRNAs,并对差异表达的miRNAs 进行功能分析和靶基因预测。但Hcy 是否通过上述差异表达的miRNAs 及其下游靶基因发挥诱导VSMC 增殖和迁移的作用,还需要进一步的实验验证。
