桃红四物汤对大脑中动脉闭塞大鼠lncRNA表达的影响
2024-03-18张丽娟费长义薛苏君李雨朦李静静潘凌宇段贤春彭代银
张丽娟,费长义,余 超,薛苏君,李雨朦,李静静,潘凌宇,段贤春,3,彭代银
(1.安徽中医药大学第一附属医院药学部,安徽 合肥 230031;2.安徽中医药大学药学院,3.中药复方安徽省重点实验室,安徽 合肥 230012)
缺血性中风是一种突发的脑血液循环障碍疾病。缺血性中风后,信使RNA表达谱在血液或脑中发生变化,microRNA(miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)和环状RNA(circRNA)参与RNA介导的调控网络[1],LncRNA为转录本长度大于200个核苷酸的长链非编码RNA,已被证明是生长和疾病的关键基因调节因子[2]。LncRNA也可以与miRNA竞争性结合,被称为“竞争性内源性RNA”(ceRNA)。研究表明,显著差异表达的lncRNA(DEL)与缺血性中风的病理过程密切相关[3]。许多lncRNA已经通过平行测序技术进行了鉴定。然而,功能性RNA分子和RNA介导的调控网络在中风中的具体作用机制尚不清楚。因此,通过研究lncRNAs与mRNAs之间的相互作用,我们可以更深入地了解缺血性中风的病理生理过程。桃红四物汤(Tao Hong Si Wu decoction,THSWD)是一种传统中药(TCM)制剂,包含桃仁、当归、红花、地黄、芍药和川芎六味草药,可有效治疗心肌损伤和产后血瘀等疾病[4]。课题组前期使用超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS)来鉴定THSWD的成分,从这项工作中,我们确定了5种主要活性成分:没食子酸、原儿茶酸、羟基红花黄A、苦杏仁苷和芍药苷[5]。THSWD治疗大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)的机制在近几年已经有了许多研究成果。例如,THSWD被证明可以通过调节脑细胞坏死和炎症来治疗脑缺血[6]。然而,THSWD治疗后MCAO的lncRNA失调很少受到关注,我们旨在利用RNA测序揭示THSWD治疗MCAO大鼠相关的lncRNA-mRNA网络表达情况。
1 材料与方法
1.1 实验动物SPF级Sprague-Dawley大鼠(200±20 g,7周)购自安徽医科大学实验动物中心,SCXK(安徽)2017-0004,所有动物实验均经安徽中医药大学动物实验伦理委员会批准(许可证号:LLSC20160336)。室温25 ℃左右,60%±5%相对湿度,自然光暗周期和自由饮水条件下饲养1周,待其适应环境后进行实验。
1.2 主要试剂与仪器mirVanaTM miRNA Isolation kit(美国 Thermo Fisher Scientific,货号:AM1561);TRIzol提取试剂(美国 Thermo Fisher Scientific,货号:15596026);RNeasy试剂盒(德国 Qiagen,货号:74104);RevertAid第一链cDNA合成试剂盒(美国 Thermo Fisher Scientific,货号:K1622)。
生物分析仪(美国 Agilent Technologies Inc);微量紫外分光光度计、荧光计、荧光定量PCR仪(美国 Thermo Fisher Scientific);Illumina Hiseq 2500(美国Illumina)。
1.3 主要数据库与软件Seqtk(https://github.com/lh3/seqtk);Venny(https://bioinfogp.cnb.csic.es/tools/venny/);Cytoscape(https://cytoscape.org/);GO(http://geneontology.org/);KEGG(https://www.genome.jp/kegg);Genome Browser(https://genome.ucsc.edu/);PubChem(https://pubchem.ncbi.nlm.nih.gov/);PDB数据库(https://www.rcsb.org/);AutoDockTools 1.5.7;Pymol 2.4。
1.4 方法
1.4.1动物实验与分组 将大鼠随机分为3组,每组10只:正常组,MCAO组和THSWD给药组。经过一周的适应性饲养,建立MCAO模型[7]。在大鼠MCAO造模24 h后,使用ZeaLonga方法对神经功能进行评分,以确定造模是否成功。得分为1-3的大鼠被认为是成功的模型,并被纳入实验组进行后续实验,模型组和对照组在没有任何治疗的情况下正常饲养。THSWD组灌胃THSWD煎剂,一天一次。灌胃7 d后,老鼠被安乐死。收集左半球并立即在液氮中冷冻。
1.4.2THSWD制备 THSWD购自安庆华仕中药饮片有限公司(桃仁(批号 17033101)、红花(批号 17041401)、熟地黄(批号 17042501)、白芍(批号 17050301)、当归(批号 16070501)和川芎(批号 17061601)),根据所需的THSWD比例称量所需的药材,在10倍量水中浸泡0.5 h后煮沸2 h。然后,收集滤液,残余物用8倍量的水煮沸2 h。将两种滤液混合并通过旋转蒸发浓缩至1.8 kg·L-1。
1.4.3RNA测序 使用TRIzol试剂从大脑梗死区域提取总RNA。然后,使用RNeasy试剂盒进行RNA纯化和柱上DNase消化。分光光度计和生物分析仪进行序列质量分析,VAHTS Total RNA-seq (H/M/R) Library Prep Kit for Illumina试剂盒构建文库。纯化的互补cDNA文库通过荧光计和生物分析仪分析,然后根据制造商的说明,在 HiSeq 2500 平台上进行簇生成和测序。由奥吉生物(中国上海)进行文库构建和RNA测序,并使用计算机进行分析数据。
1.4.4DEL的注释和筛选 原始数据由FastQC v0.11.3鉴定,并由seqtk进行修剪。使用Hisat2 v2.0.4将修剪后的读数映射到大鼠基因组(Rn6)。应用Stringtie(version:1.3.0)对Hisat2比对后每个基因的Fragments数进行计数,然后用TMM(trimmed mean of M values)法进行归一化,最后利用perl脚本计算出每个基因的FPKM值。根据lncRNA在基因组上与附近mRNA的位置关系,对lncRNA进行分类。应用Stringtie(version:1.3.0)对预测的novel lncRNA和NONCODE数据库,以及Ensembl数据库中的已知lncRNA进行表达定量。MCAO组和对照组之间差异表达的lncRNA被命名为mcDEL,由edgeR筛选(|log2(FC)|>1,P<0.05)。接下来,Venny用于识别上调mcDEL和上调mtDEL的交集DEL(上调iDEL,即THWSD逆转MCAO异常上调lncRNA),下调mcDEL和下调mtDEL的交集DEL(下调iDEL,即THWSD逆转MCAO异常下调lncRNA)。
1.4.5lncRNA-mRNA网络构建 为了更进一步的了解lncRNA的功能,使用皮尔逊相关性计算了lncRNA和mRNA之间的相关性(|r|>0.95和P<0.000 1)。LncRNA-mRNA网络由Cytoscape构建。在这个共表达网络中,每个lncRNA或mRNA对应一个节点。通过clusterProfiler对lncRNA-mRNA网络进行注释,以识别与DEL相关的信号通路。Cytoscape中的MCODE插件用于识别lncRNA-mRNA网络模块。随后,在Cytoscape中可视化得到两个典型模块的子网络。此外,clusterProfiler还使用GO和KEGG数据库分析了两个典型模块富集的生物功能和信号通路。
1.4.6iDEL的顺反式调控分析 LncRNA可以通过顺式调节附近的蛋白质编码基因和反式调节远端蛋白质编码基因来调节其靶基因。因此,基于顺式或反式作用算法预测lncRNA的潜在靶标。首先,使用Genome Browser来鉴定lncRNA的顺式调控网络,以lncRNA距离<10 kb的gene作为cis作用的靶基因。其次,分析lncRNA-mRNA的序列互补性和双链能量,预测lncRNA的潜在反式作用靶基因。用BLASTN和RNAplex预测潜在的反式作用靶mRNA,相似性>95%、e<1e-50和RNAplex分析结合能<30。
1.4.7RT-qPCR 根据制造商(中国 赛默飞世尔科技公司)的说明,使用RevertAid第一链cDNA合成试剂盒对来自每个样品的等量总RNA进行反向转录以生成cDNA。使用实时荧光定量PCR系统验证NONRATT024616,NONRATT030683,NONRATT004058,NONRATT010334,NONRATT003292,NONRATT000 003,C1qb和Hemox的基因表达,使用2-ΔΔCT法计算基因表达量。甘油醛3-磷酸脱氢酶(GAPDH)mRNA用作内部对照。RT-qPCR在含有cDNA(2.0 μL)、qPCR SYBR绿色预混液(10 μL)、每种引物0.4 μL和ddH2O(7.2 μL)的20 μL反应混合物中进行。PCR反应程序为:酶在50 ℃下活化2 min,在95 ℃下初始变性10 min,然后在95 ℃下进行40次循环,持续15 s,在60 ℃下持续1 min。从3个独立样品中测定相对基因表达,每个样品一式3份测定。本实验中使用的所有引物均列于Tab 1中。

Tab 1 Primer sequences
1.4.8分子对接实验 活性化合物的2D结构从Pubchem官方网站下载。通过Chem3D 20.0软件将二维结构转化为三维结构,并对其进行优化。在PDB数据库中下载靶蛋白的3D结构。将靶蛋白和化合物的三维结构导入AutoDockTools 1.5.7软件,并对分子结构进行常规预处理。然后选择AutoDockTool vina进行分子对接,并分析其结合活性。Pymol 2.4软件用于可视化。
2 结果
2.1 lncRNA测序数据分析我们分析了在对照组、MCAO组和THSWD组中表达的lncRNA的特征,并且比较了这三组之间的差异和相似之处。从9个样本中鉴定了24 637个lncRNA,其中22 772个相互lncRNA(Fig 1A)在三组中均有表达。接下来,我们分析了筛选的lncRNA在大鼠染色体上的分布,发现所有染色体均有表达。其中,lncRNA在九条染色体(chr1-8和chr10)表达>1 000个,其中表达lncRNA最多的是chr1(Fig 1B)。根据lncRNA在基因组上相对于蛋白编码基因的位置,lncRNA可分为五种类型,我们使用这些类别来分析已筛选的lncRNA。大多数是从蛋白质编码外显子转录而来的,而另一些从内含子和基因间区域转录(Fig 1C)。

Fig 1 Venn diagram(A),chromosome distribution(B) and class type(C) of lncRNAs identified in control,MCAO and THSWD groups

Fig 2 THSWD-reversed lncRNAs with MCAO
2.2 THSWD对lncRNA表达的影响314个下调mcDEL和332下调mtRNA进行交集分析获得116个下调iDEL(THSWD逆转MCAO下调lncRNA)(Fig 2)。此外,从563个上调mcDEL和339个上调mtRNA中筛选到了186个上调iDEL(Fig 2)。因此,THSWD可以逆转MCAO中302个失调的lncRNA(116个下调iDEL和186个上调iDEL)。染色体分布分析表明,所有染色体都有下调的iDEL、上调iDEL和交集iDEL。我们确定了5条染色体(chr1、chr2、chr5、chr7、chr10),包含的iDEL>20个,其中chr1含有最多的iDEL(Fig 3A)。类别分析表明,大多数iDEL是从蛋白质编码外显子转录而来的,少数iDEL则来自内含子和基因间区域(Fig 3B)。这些结果与三组表达的lncRNA(2.1部分)特征相似。

Fig 3 Features of THSWD-reversed lncRNAsA: Chromosome distribution, B: Class type.
2.3 lncRNA-mRNA网络的构建和模块分析为了进一步了解在MCAO中被THSWD调节的iDEL,构建了lncRNA-mRNA网络。使用GO和KEGG数据库进行富集分析。通过Cytoscape,基于相关系数(|r|>0.95)和P值(P<0.001)构建了lncRNA-mRNA共表达网络。根据度值,前5名lncRNA分别为MSTRG.21354.5、NONRATT016046.2、NONRATT 016429.2、NONRATT003285.2和NONRATT004 058.2。根据度值,前6名的编码蛋白mRNA分别为RGD1311343、LOC684828、Cnn2、Hist3h3、A3galt2和Cd93。GO分析和KEGG分析展示了前30个富集结果(Fig 4A,4B)。GO分析表明,这些DEL与“有丝分裂细胞周期”、“有丝分裂”、“染色体分离”、“细胞分裂”和“细胞周期”有关。KEGG分析表明,涉及的信号通路是“ECM-受体相互作用”、“细胞周期”、“补体和凝血级联”等。通过MCODE插件分析,确定了10个模块。前3个模块按降序排列,MCODE得分≥1.5,节点≥10的分别被视为模块1,模块2和模块3。随后,选择包含大于10个蛋白质编码基因的模块1和模块3进行网络可视化。分别对模块1(Fig 5B,5C)和模块3(Fig 6B,6C)进行了生物功能富集分析和信号通路富集分析。属于这些模块的大多数iDEL在模块1和模块3的MCAO组中上调。在模块1中,有12个lncRNA(NONRATT030953.2,NONRATT030261.2,NONRATT026655.2,NONRATT023599.2,NONRATT017195.2,NONRATT 015182.2,NONRATT009960.2,NONRATT007019.2,NONRATT005984.2,NONRATT003292.2和NONRATT000003.2)。这些lncRNA参与“造血细胞谱系”、“百日咳”、“ECM-受体相互作用”、“系统性红斑狼疮”、“补体和凝血级联”(Fig 5)。我们还在模块3中确定了NONRATT030262.2,NONRATT 008267.2和NONRATT010334.2,信号通路分析显示这三种lncRNA与“ECM-受体相互作用”、“局灶黏附”、“补体和凝血级联”有关(Fig 6)。

Fig 4 Top-30 significantly enriched terms using GO database (A) and KEGG database (B) with lncRNA-mRNA network

Fig 5 Module 1 subnet (A), GO (B) and KEGG (C) of lncRNA-mRNA networkCircular nodes denote mRNAs, and Vee nodes denote lncRNAs.

Fig 6 Module 3 subnet (A), GO (B) and KEGG (C) of lncRNA-mRNA networkCircular nodes denote mRNAs, and Vee nodes denote lncRNAs.
2.4 iDEL的顺反式调控基因我们在MCAO中鉴定了250个iDEL的225个顺式调节基因(153个上调iDEL和97个下调iDEL),这些基因由THSWD调节。此外,这225个顺式调节基因中有32个具有差异表达,其中38个iDEL与这32个差异表达顺式调控基因呈正相关。同时,我们发现3个iDEL和2个差异表达顺式调节基因之间存在负相关。此外,经BLASTN和RNAplex筛选了592个反式调控基因和20个iDEL组成的基因对1 606对,其中5个反式调控基因具有差异性,我们进一步筛选出了由6个iDEL和5个反式调控基因组成的15个基因对,它们之间呈现负相关关系。
2.5 通过qRT-PCR验证DEL的表达为了进一步验证RNA测序数据,选择了8个iDEL(NONRAT T000003.2,NONRATT003292.2,NONRATT01033 4.2,NONRATT004058.2,NONRATT030683.2,NONRATT024616.2,C1qb和Hemox)进行RT-qPCR。与正常组相比,MCAO组NONRATT000003.2、NONRATT003292.2、NONRATT010334.2、NONRATT004058.2、C1qb和Hemox的表达明显上调(Fig 7B),而NONRATT030683.2和NONRATT0246 16.2的表达明显下调(Fig 7A),这与RNA测序数据一致(Fig 7C)。

Fig 7 Gene expressions of six specified lncRNAs confirmed by RT-qPCR
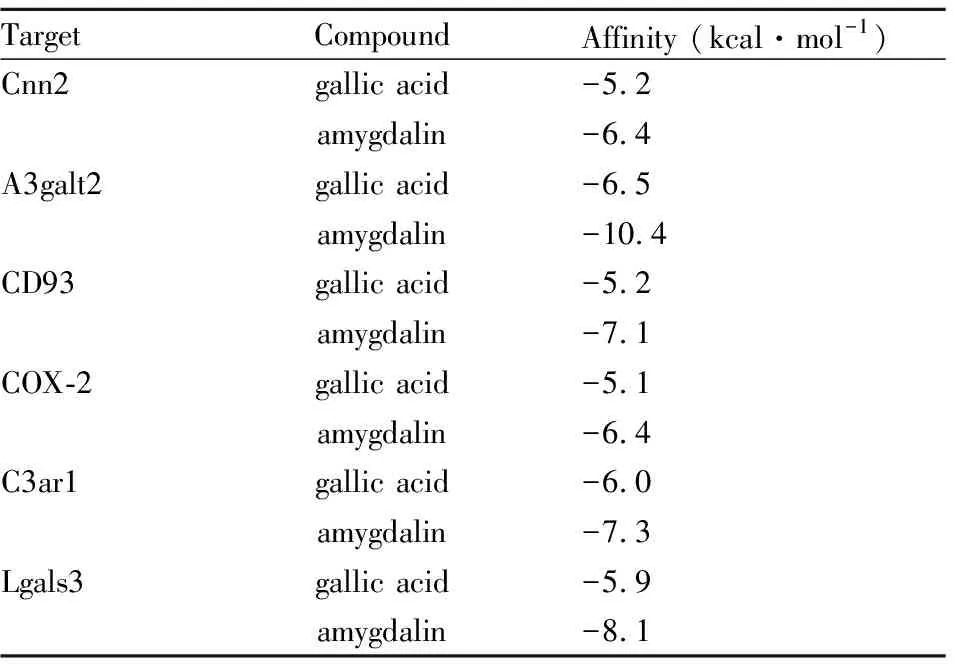
2.6 分子对接本研究通过构建lncRNA-mRNA网络和富集分析,获得了关键mRNA靶点和关键通路,选择Cnn2、A3galt2、C3ar1、Lgals3和CD93与活性化合物没食子酸(gallic acid)和苦杏仁苷(amygdalin)进行分子对接实验验证。此外,COX-2被认为在大脑稳态中起作用,因此我们也对该mRNA所指导表达的蛋白质进行了分子对接实验。对接结合能(Tab 2)显示,所有结合能均<-5 kcal·mol-1,表明蛋白质与化合物之间存在良好的结合。分子对接的可视化结果如Fig 8所示。
Tab 2 Molecular docking binding energy

Fig 8 Compound target molecular docking
3 讨论
许多参与缺血性中风的lncRNA已经通过微阵列技术或RNA测序技术阐明[8]。Huang等[9]发现lncRNA MALAT1通过作用于HSP90促进脑缺血/再灌注小鼠神经元坏死性凋亡。
在本研究中,THSWD可以调节MCAO中302个失调的lncRNA(116个下调表达和186个上调表达),通过构建lncRNA-mRNA网络、鉴定模块和分析富集信号通路,我们发现补体和凝血级联反应被富集(在脑缺血后被激活)。我们发现一些lncRNA(例如,NONRATT030262.2、NONRATT010334.2、NONRATT008267.2)可能参与THSWD治疗后的补体和凝血级联反应。一些研究表明,补体和凝血级联的补体C3(Complement 3,C3)和补体C5(Complement 5,C5)成分可通过补体和凝血级联反应和TLR4/NF-κB通路来加速MCAO损伤[10-11]。此外,THSWD抑制了C3ar1、C1qb、C1qc和C5ar1的表达,这与我们的其他研究结果一致[12]。C3ar1、C1qb、C1qc和C5ar1蛋白在脑缺血的发生和发展中起重要作用[13]。因此,我们推测THSWD给药可以通过抑制补体和凝血级联来逆转MCAO损伤。此外,生物信息学分析表明,3种lncRNA可能分别受Lgals3、Hjurp和Kif14调控。作为与小胶质细胞和巨噬细胞相关的炎症介质,Lgals3可能影响缺血性中风疾病发生发展[14]。
我们对部分基因进行了RT-qPCR实验验证,发现实验结果与测序数据结果吻合。另外,本研究发现,Cnn2、A3galt2、C3ar1、Lgals3、CD93和COX-2与没食子酸和苦杏仁苷稳定结合,这也证实了THSWD可能通过lncRNA-mRNA网络和富集分析通路对MCAO大鼠发挥治疗作用。
综上,THSWD可以影响MCAO大鼠的lncRNA表达。一些核心lncRNA可能在THSWD保护MCAO损伤过程中发挥重要作用。THSWD可能通过调节补体和凝血级联反应以及各种信号通路参与缺血性中风的治疗。为缺血性中风的分子机制研究提供了新的见解,但是,本研究对lncRNA在细胞中的具体机制研究还有一定的欠缺,因此,我们后续将继续使用THSWD作为治疗方法来研究lncRNA在不同细胞类型中的功能,深入研究这些与MCAO密切相关且受THSWD显著调控的lncRNA的作用机制。
