香叶醇通过调控Nrf2/HO-1途径调节氧化应激减轻大鼠脑缺血/再灌注损伤
2024-03-18刘京东
罗 佳,吴 宇,刘京东,陈 莎,董 志
(重庆医科大学药学院,重庆市生物化学与分子药理重点实验室,重庆 400016)
近年来,中风造成了大量的死亡或致残病例。在脑缺血的相关疾病中,缺血性脑卒中发病率最高,占脑卒中患病总数的60%~80%[1]。临床上主要治疗方法是及时对缺血脑组织进行再灌注,恢复正常血液循环。然而,恢复血液再灌注仍然不能缓解部分患者的症状,甚至会引起继发性脑损伤,导致预后恶化。这一病理过程被定义为脑缺血/再灌注损伤(cerebral ischemia reperfusion injury,CIRI)[2-3]。CIRI会诱发一系列细胞或者生化病理反应,包括细胞内活性氧(ROS)的产生、Ca2+超载、氧化应激、炎症和细胞凋亡等[4]。这些病理反应最终会造成脑组织永久性损伤。因此,抑制上述病理反应是治疗CIRI的关键。
氧化应激是CIRI中重要的病理过程之一。缺血/再灌注后脑组织中ROS产生过多会引起氧化应激[5]。核因子E2相关因子2 (Nrf2)是一种转录因子,也是氧化还原平衡的调节因子[6]。Nrf2激活诱导血红素加氧酶- 1(HO-1)基因转录,减少氧化应激损伤,从而维持氧化还原平衡[7]。研究发现,通过激活Nrf2/HO-1信号通路可以抗氧化应激反应,对CIRI具有保护作用[8]。香叶醇(geraniol)属于非环单萜醇类化合物,可从芳香植物挥发油中提取得到[9]。很多研究都表明香叶醇具有多种药理作用,例如抗氧化、抗炎和抗肿瘤活性[ 10]。但是目前关于香叶醇与CIRI中的Nrf2/HO-1途径的关系尚未有研究。因此,本研究通过构建大脑中动脉闭塞再灌注(MCAO/R)模型,观察香叶醇对CIRI的潜在保护作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性SD大鼠,体质量(250~270)g。所有大鼠在25 ℃±2 ℃,相对湿度为60%~70%饲养,进行昼夜循环的光照。动物实验通过重庆医科大学动物伦理委员会的审查。
1.1.2药物与试剂 香叶醇(纯度99.98%,美国Sigma-Aldrich公司,W250708),2,3,5-氯化三苯基四氮唑(TTC,美国Sigma-Aldrich公司,T8877),山羊抗兔二抗(中国Proteintech公司,SA00001-2),山羊抗鼠二抗(中国Proteintech公司,SA00001-1),β-actin一抗(中国Proteintech公司,81115-1-RR),Nrf2一抗(美国Affinity生物,AF0639),HO-1一抗(美国Affinity生物,AF5393),依达拉奉(美国Sigma-Aldrich公司,M70800),brusatol(美国Sigma-Aldrich公司,SML1868),线栓(中国佳灵生物公司),SOD试剂盒(中国碧云天公司,S0103)、GPx试剂盒(中国碧云天公司,S0056)、GSH试剂盒(中国碧云天公司,S0053)、MDA试剂盒(中国碧云天公司,S0131)
1.2 方法
1.2.1实验分组、给药及模型制备 1)为确定合适的香叶醇给药剂量,我们将大鼠称体质量编号后,采用完全随机分组法,将大鼠随机分为7组进行后续实验:假手术组(sham)、假手术+200 mg·kg-1香叶醇组、缺血/再灌注(I/R)组、I/R+50 mg·kg-1香叶醇组、I/R+100 mg·kg-1香叶醇组、I/R +200 mg·kg-1香叶醇组、依达拉奉阳性对照组(3 mg·kg-1,静脉注射)。大鼠在MCAO术前5 d连续腹腔注射香叶醇,术后再次腹腔注射香叶醇。根据前面实验的结果,选择最合适的香叶醇给药剂量进行接下来的实验。将大鼠随机分为假手术组(sham)、缺血/再灌注模型(I/R)组、I/R+200 mg·kg-1香叶醇组、I/R+ brusatol(Nrf2抑制剂)组、I/R+200 mg·kg-1香叶醇+ brusatol组。MCAO术前1.5 h侧脑室注射brusatol。假手术组只分离血管不插栓线,其余组别采用线栓法建大鼠CIRI模型。
2)4%戊巴比妥钠腹腔注射麻醉大鼠,仰卧位固定大鼠。消毒备皮后沿着颈部中线小心划开皮肤,分离并结扎颈总动脉,颈外动脉和颈内动脉,注意避免损伤神经和气管。在颈总动脉处用血管剪剪一个“V”字小口,将线栓轻轻从切口处插入,缓慢插入中动脉至18.5±1.0 mm深,然后将线栓固定。缺血1.5 h后,取出线栓实现恢复血液再灌注,结扎血管,缝合伤口,消毒。假手术组只分离血管但不插栓线。术后大鼠放回笼子中,给予食物和水。
1.2.2神经行为学评分 造模24 h后,采用随机双盲法,根据改良神经功能评分表评定大鼠神经功能受损情况。0分表示神经功能正常;1分表示轻度的神经功能损伤(提尾时左前肢屈曲);2分表示中度的神经功能损伤(行走时向左侧转圈);3分同样表示中度神经功能损伤(向左侧倾斜);4分表示无自发行走,意识减退;5分表示与缺血有关的死亡。
1.2.3TTC染色法测定大鼠脑梗死体积 造模24 h后,麻醉大鼠后迅速分离脑组织。随后将脑组织放入-20℃冰箱中冷冻2 h,冠状位依次切下脑片,大约2 mm每片。加入2%TTC溶液染色15 min。染色期间保持避光。然后加入4%多聚甲醛浸泡,固定过夜。第2天将脑片按顺序放在黑色背景布上拍照。使用ImageJ软件计算每张脑片的梗死体积。
1.2.4HE染色 造模24 h后,麻醉大鼠,然后从左心尖缓慢灌注含有肝素的磷酸盐缓冲盐水(PBS)以及4%多聚甲醛进行固定。固定好之后取出脑组织,加入4%多聚甲醛浸泡固定,放在4 ℃冰箱中保存。最后进行梯度脱水,石蜡包埋。切片进行HE染色。
1.2.5TUNEL染色测定大鼠皮层细胞凋亡 TUNEL染色法检测大鼠右侧受损皮质细胞凋亡情况。显微镜下观察记录切片染色情况。正常细胞核被染色为蓝色荧光,而凋亡细胞则被染色为绿色荧光。通过ImageJ软件,导入图片后调整阈值,去除背景,选中细胞核,再选择自动分析、计数颗粒,通过不同的情况设置参数,最后得出细胞数。分别计算皮层半暗区凋亡细胞数,细胞总数,再进行相比得出凋亡率。
1.2.6氧化应激参数测定 SOD、GPx、GSH和MDA的变化可以反应机体氧化应激程度,根据试剂盒说明书进行操作。
1.2.7免疫组织化学染色 用PBS清洗石蜡切片,加入0.3% H2O2室温孵育5 min,加入5%的正常山羊血清室温孵育10 min。再加入一抗,4 ℃过夜孵育。然后,加入二抗,37 ℃孵育10~30 min。再加入显色剂显色3~15 min,然后进行复染,脱水,透明,封片处理。显微镜下观察切片并拍照记录。
1.2.8Western blot检测大缺血皮层组织中相关蛋白表达 造模24 h后麻醉大鼠,分离出脑右侧皮层组织并置于-80 ℃冰箱保存。称取30 mg左右组织,加入组织裂解液进行匀浆离心,并提取上清,加入buffer煮15 min,冷却后冷冻保存。制胶后加入Marker和蛋白样品,进行凝胶电泳、转膜。转膜结束后,将条带转移至含有5%脱脂奶粉的孵育盒中,室温封闭1 h,封闭结束后用TBST洗膜3次,每次10 min,随后分别加入Nrf2、HO-1和β-Actin,4 ℃过夜,加入二抗,37 ℃孵育1 h。用TBST洗膜3次,三抗室温孵育30 min,用TBST洗膜3次。随后将条带用ECL超敏显影液进行显影、拍照。使用ImageJ软件计算统计。
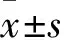
2 结果
2.1 香叶醇对脑缺血/再灌注后神经功能损伤和脑梗死的影响如Fig 1A,CIRI 24 h后,I/R组神经行为评分高于假手术组。香叶醇和依达拉奉组改善了大鼠的神经功能。如Fig 1B-C,TTC结果显示,与假手术组相比,模型组出现白色梗死区域;与I/R组相比,I/R+香叶醇组脑梗死体积明显减小,且呈剂量相关性。这些结果表明,香叶醇对I/R引起的脑损伤具有神经保护作用。在后续实验中我们选择了200 mg·kg-1作为最终给药浓度。
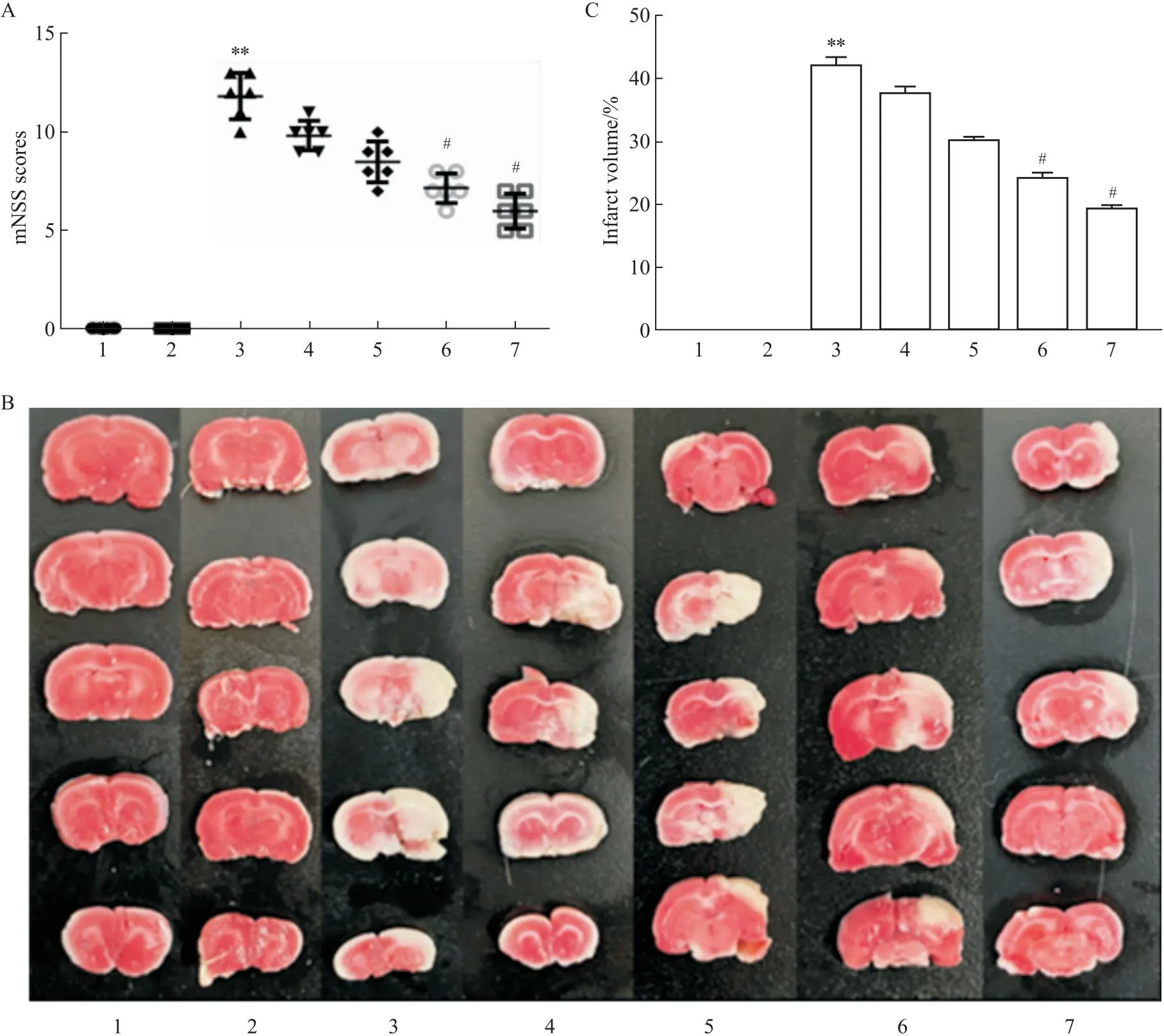
Fig 1 Differences in neurological scores and cerebral infarct volume after cerebral
2.2 香叶醇对脑缺血/再灌注后大鼠受损皮层组织病理学的影响Fig 2 HE染色结果表明,与假手术组比较,I/R组右侧皮质神经细胞出现明显萎缩、断裂,脑组织切片损伤严重。而I/R+香叶醇组受损神经细胞数量明显减少,脑损伤明显减轻。
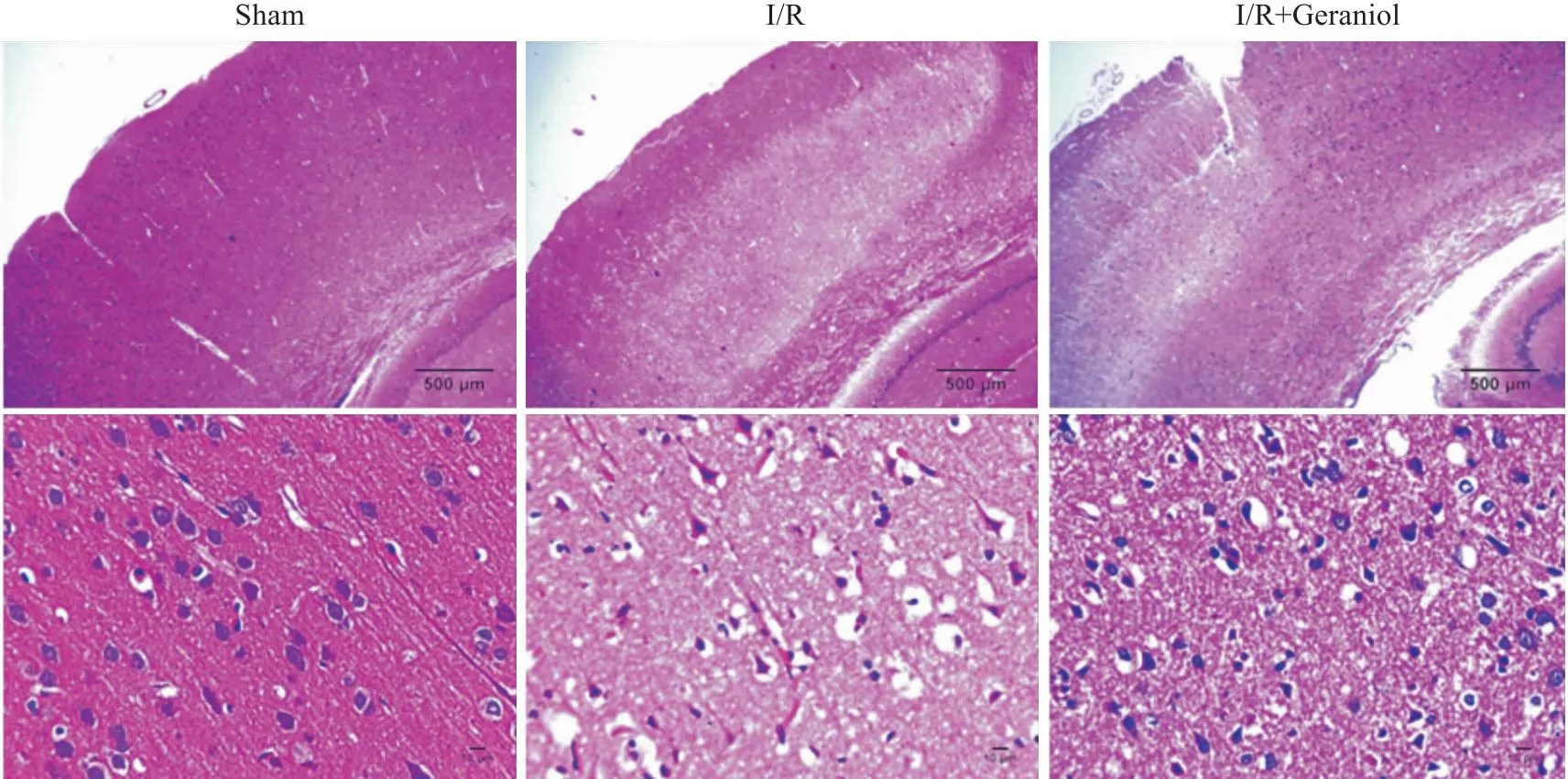
Fig 2 Injury of right damaged cortex in rats after cerebral ischemia-reperfusion
2.3 香叶醇改善脑缺血/再灌注所致的细胞凋亡和氧化应激TUNEL染色使得凋亡细胞呈现绿色。由Fig 3A-B可见,与假手术组相比,模型组中绿色染色细胞数量增多,大量细胞发生了凋亡;与模型组比较,香叶醇组中绿色染色细胞数量明显减少,细胞发生凋亡情况减少。SOD、GPx和GSH是体内重要的内源性抗氧化酶,MDA是脂质过氧化的产物,这些指标通产用于评估氧化应激的程度。由Fig 3C-F可见,与假手术组相比,模型组中SOD表达量、GSH表达量和GPx的表达量都呈现下调趋势,而MDA表达量水平升高。相比于模型组,香叶醇干预组SOD、GSH和GPx的表达水平明显上调,MDA的水平则明显降低。以上结果表明香叶醇能够减轻脑缺血再注损伤中氧化应激水平。

Fig 3 Changes in apoptosis and oxidative stress indicators after cerebral
2.4 香叶醇对脑缺血/再灌注后大鼠受损皮层Nrf2、HO-1蛋白表达的影响Fig 4免疫组化染色结果显示,假手术组中无明显染色颗粒,而模型组中棕色染色颗粒明显,这表明经过造模后,Nrf2以及HO-1蛋白的表达水平会被诱导上调。同时与模型组相比,经过香叶醇干预后Nrf2及HO-1的蛋白表达明显升高。
与免疫组化结果一致,Western blot实验结果显示,假手术组中Nrf2及HO-1蛋白表达水平较低,而在模型组中表达水平升高。与模型组相比,香叶醇给药组中Nrf2及HO-1蛋白表达更高(Fig 4)。
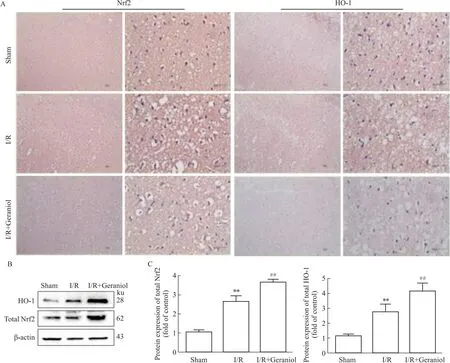
Fig 4 Changes in Nrf2 and HO-1 protein expression in the injured cortex after cerebral
2.5 香叶醇联合Nrf2抑制剂brusatol对脑缺血/再灌注后大鼠神经功能受损和脑梗死体积的影响与模型组相比,模型+brusatol组脑梗死体积更为明显,神经功能受损情况加重,表明通过抑制Nrf2/HO-1信号通路会加重CIRI。与模型+香叶醇给药组相比,模型+香叶醇+brusatol组脑梗死体积明显有所增加,神经功能受损情况也较为明显,说明抑制剂brusatol可以逆转香叶醇对大鼠的脑保护作用。以上结果表明,香叶醇对CIRI保护作用可能是通过激活Nrf2/HO-1信号通路(Fig 5)。

Fig 5 Effect of geraniol combined with Nrf2 inhibitor brusatol on neurological function and TTC
2.6 香叶醇联合Nrf2抑制剂brusatol对脑缺血/再灌注后大鼠受损皮层组织病理学的影响Fig 6 HE染色结果表明,与模型组对比,模型+brusatol组细胞病理学损伤更严重,视野中正常细胞核明显更少,核固缩深染,周围组织空泡化;与香叶醇给药组相比,模型+香叶醇+brusatol组的核固缩程度较为严重,死亡细胞数较多。表明,香叶醇的神经保护作用能被Nrf2/HO-1抑制剂brusatol影响,并降低其保护作用。

Fig 6 Effect of geraniol combined with Nrf2 inhibitor brusatol on histopathologyof damaged cortex after cerebral ischemia-reperfusion in rats
2.7 香叶醇联合Nrf2抑制剂brusatol对脑缺血/再灌注后氧化应激水平的影响由Fig 7所示,与模型组相比,模型+brusato组SOD、GSH和GPx的活性明显下降,MDA 的水平明显升高,相比于香叶醇给药组,模型+香叶醇+brusatol组SOD、GSH和GPx的活性下降,MDA的水平升高。表明香叶醇的抗氧化应激作用能被Nrf2/HO-1抑制剂brusatol影响。

Fig 7 Effect of geraniol combined with Nrf2 inhibitor brusatol on oxidative stress parameters after cerebral
2.8 香叶醇联合Nrf2抑制剂brusatol对脑缺血/再灌注后Nrf2、HO-1的蛋白表达影响由Fig 8所示,与模型组相比,模型+brusatol组Nrf2及HO-1的表达不明显,相比于香叶醇给药组,模型+香叶醇+brusatol组Nrf2及HO-1的表达有所降低,表明香叶醇对CIRI的保护作用是通过Nrf2/HO-1通路产生的。
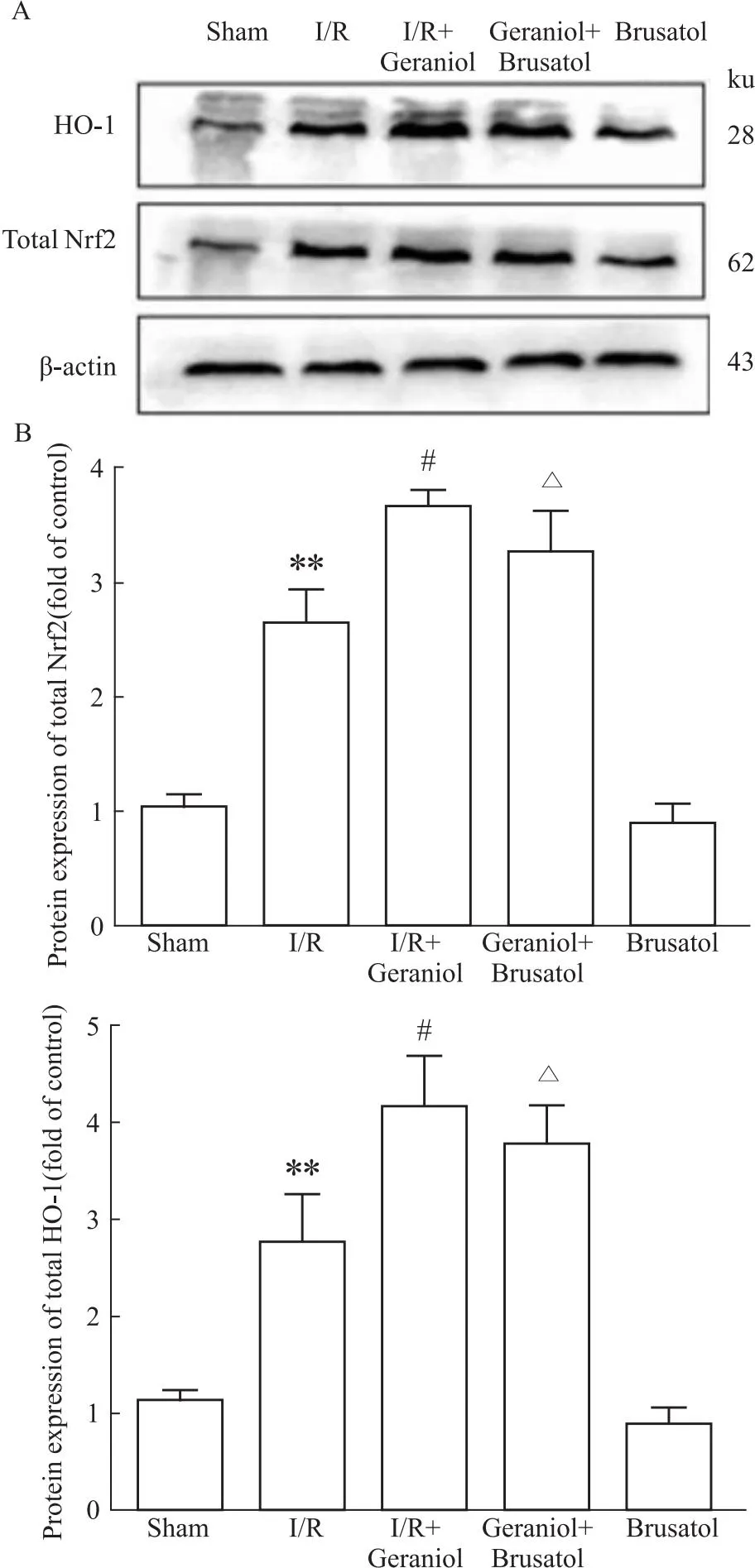
Fig 8 Effect of geraniol combined with Nrf2 inhibitor brusatol on Nrf2 and HO-1 protein expression after
3 讨论
大脑内动脉栓塞引起的缺血性脑卒中约占所有脑卒中的60%~80%,在全球范围内,已成为导致死亡和残疾的主要原因之一[11]。目前,急性缺血脑卒中患者最常用的治疗方法是溶栓治疗。然而,血液供应的恢复可进一步加重缺血/再灌注损伤所致的脑组织损伤[12]。CIRI涉及一系列的病理生理损伤机制,包括兴奋毒性、氧化应激、炎症和细胞凋亡。寻找有效治疗缺血性脑卒中的方法与药物仍然是临床研究的一大挑战。香叶醇在以往的研究中发现具有抗肿瘤、抗炎和抗氧化应激等作用,既往研究也表明香叶醇对CIRI有保护作用[13],但具体机制尚不明确。在本研究中,我们通过建立了大鼠CIRI模型,并给予香叶醇药物干预。通过神经功能评分、TTC染色测定脑梗死体积以及HE染色观察受损皮层病理损伤情况,以上结果表明,香叶醇能够明显改善大鼠神经功能,减少脑梗死,改善右侧皮质病理损伤。
CIRI会诱发氧化应激、炎症反应和细胞凋亡等病理过程。其中,细胞凋亡是神经细胞死亡的重要方式之一,越来越多的研究表明,减少细胞凋亡的发生可以减轻CIRI[14]。在本研究中,我们通过TUNEL染色发现,与模型组相比,经过香叶醇处理之后,能有效抑制细胞凋亡的发生。这说明香叶醇可以缓解CIRI后神经元的死亡,发挥保护作用。
氧化应激被定义为一种病理状态,与各种疾病的衰老和病理过程有关,包括动脉粥样硬化、高血压、中风和神经退行性疾病。氧化应激或氧化还原失衡可导致脂质和蛋白质的过氧化,以及DNA损伤,从而在体内产生毒性作用[15]。当发生氧化应激时,活性氧或活性氮超负荷或超过机体的清除能力,会导致机体氧化还原系统失衡。缺血/再灌注损伤会诱发氧化应激反应,因此氧化应激也是CIRI过程中重要的病理生理机制[16]。Nrf2是抗氧化反应的主要调节因子,能够通过协调基础和应激诱导的多种细胞保护基因的激活来发挥保护作用。氧化应激可以激活Nrf2实现自我保护。HO-1是一种限速酶。在氧化应激条件下,Nrf2被磷酸化并易位到细胞核,并启动HO-1基因的转录。有研究发现,Nrf2/HO-1途径在CIRI中起着重要作用,能够抑制氧化应激的发生[17-18]。本研究通过测定Nrf2和HO-1蛋白的表达,结果发现,模型组中Nrf2和HO-1蛋白表达水平呈现上升的趋势,而香叶醇给药之后能够明显增加Nrf2和HO-1蛋白表达水平。在加入Nrf2抑制剂brusatol之后,能够逆转香叶醇对CIRI的神经保护作用,以上结果均能说明香叶醇能够通过激活Nrf2/HO-1信号通路调节氧化应激,从而减轻大鼠CIRI。
4 结论
综上所述,香叶醇对CIRI具有神经保护作用。香叶醇可以减少CIRI后氧化应激的发生以及减轻细胞凋亡,其保护机制可能通过激活Nrf2/HO-1信号通路实现。我们的研究结果丰富了香叶醇对CIRI神经保护作用的分子机制,为脑卒中治疗提供了有希望的药物靶点。
