铝在酸性AlCl3-EMIC 和AlCl3-BMIC 离子液体中的阳极溶解
2024-03-18杨晓晴郑勇王倩李玉李涛任保增
杨晓晴 ,郑勇 ,王倩 ,李玉 ,李涛 ,任保增
(1.离子液体清洁过程北京市重点实验室,中国科学院过程工程研究所,北京 100190;2.中国科学院绿色过程制造创新研究院,北京 100190;3.郑州大学化工学院,河南 郑州 450001;4.安阳工学院化学与环境工程学院,河南 安阳 455000)
0 引言
国家的“双碳”目标对电解铝工业提出了新要求[1]。离子液体电解铝能在小于100 ℃下进行,相比于传统电解铝工业,能耗大幅降低,且没有二氧化碳以及其他污染气体的产生,有望发展成铝工业生产的一种新型绿色工艺[2]。目前离子液体电沉积铝的研究很广泛[3-13],1-乙基-3-甲基咪唑氯盐(EMIC)和1-丁基-3-甲基咪唑氯盐(BMIC)与氯化铝(AlCl3)形成的氯铝酸型离子液体具有电导率高、黏度小等物理化学性质[14],是目前电解铝用离子液体中最优良的一类电解质。
电解质循环利用对离子液体电解铝工程放大至关重要。因此,研究铝在离子液体中的阳极溶解行为具有重要意义,可用于电解质再生,并可扩展至铝的精炼。近年来,铝在离子液体中的阳极溶解逐渐受到关注[15-18],目前已发表文献中对铝在氯铝酸型离子液体中的阳极溶解的相关结论包括:①铝在氯铝酸离子液体中溶解时出现阳极钝化现象,铝阳极溶解存在极限电流密度;②钝化是由于铝电极附近电解质的铝离子浓度增加,超过饱和浓度后结晶析出,在电极表面形成了氯化铝钝化膜造成的;③增加搅拌、升高温度以及降低离子液体中AlCl3的摩尔分数均可以增加铝阳极溶解的极限电流密度;④在铝阳极溶解过程中,表面不可避免地形成阳极泥,这种阳极泥的主要成分为碳。酸性AlCl3-EMIC 和AlCl3-BMIC 离子液体是目前电解铝用电解质中最有工业应用前景的2 种离子液体,2 种离子液体的性质相似。目前尚未有文献对比分析铝阳极在2 种离子液体中的电化学性能,离子液体电解铝新技术的发展需要铝在2 种离子液体中阳极溶解的相关基础数据。本文通过比较铝在2 种离子液体中的阳极溶解,以筛选出较优的电解质体系,并探究搅拌、温度、电流密度、电位等工艺参数对电解过程的影响,为工业放大提供基础数据。
1 实验部分
1.1 离子液体的制备和表征
称量1∶2物质的量比的1-乙基-3 甲基咪唑氯盐(EMIC,兰州化物所,99%)和无水三氯化铝(AlCl3,国药,99%),将AlCl3缓慢地加入到EMIC 中,待2种固体反应完全形成离子液体后,用2 个高纯铝板作为阴阳两极对制备的离子液体以1.5 V 左右的电压进行预电解处理。离子液体颜色由深黄色变成淡黄色,此时AlCl3-EMIC 离子液体的制备完成。整个制备和预电解过程均在手套箱中进行,手套箱内为氩气氛围,其水含量和氧含量均保持在1 ppm(10-6)以下。1-丁基-3-甲基咪唑氯盐(BMIC) -AlCl3离子液体的制备同上述方法。采用日本电子株式会社的600M 核磁共振谱仪(JNM-ECA600)对制备好的2 种离子液体进行核磁氢谱(1H NMR)和铝谱(27Al NMR)表征。
1.2 电化学实验
1.2.1 线性伏安曲线(LSV)
所有电化学实验在手套箱中使用辰华CHI 660D 电化学工作站控制进行,温度为室温,搅拌时控制转速恒定为800 r/min。采用三电极体系测定铝电极在2 种离子液体中的线性伏安曲线。实验时,以铝圆盘电极(Φ=3 mm)为工作电极,铝丝为参比电极,铂片电极为辅助电极,电极均为天津艾达恒晟生产。实验前,铝圆盘电极表面用50 nm 的Al2O3抛光粉打磨光滑,铝丝用1 000目①1 000 目≈12.5 μm。的砂纸打磨,清洗干净后用氩气吹干并立刻放入手套箱中备用。
1.2.2 计时电流曲线(CA)和计时电位曲线(CP)
采用三电极体系测定铝电极在2 种离子液体中的计时电流曲线和计时电位曲线。实验时,使用1 cm×1.5 cm 铝片(99.999%)为工作电极,用绝缘胶带覆盖,暴露面积1 cm ×1 cm,铝丝为参比电极,铂片电极为辅助电极。铝片使用前用600目②600 目≈20 μm。和1 000 目的砂纸打磨,依次用丙酮、乙醇、去离子水超声清洗干净后用氩气吹干并立刻放入手套箱中。
1.2.3 长时间恒流电解和恒压电解
用2 个铝片(99.999%)组成两电极体系,在AlCl3-EMIC 离子液体中分别进行恒电流电解(5 mA/cm2,40 ℃)和恒电压电解(1 V,室温),观察铝阳极的变化。
1.2.4 极限电流密度
使用2 个6 cm ×6 cm 铝片(99.999%)组成两电极体系,阳极铝片暴露面积6 cm ×2 cm,阴、阳极板极间距1.67 cm,在313.15~343.15 K、搅拌和不搅拌条件下在2 种离子液体中采用恒压稳流电源进行电解,通过改变电压使铝阳极电流达到极限,此时铝阳极溶解速度最大,得到铝阳极溶解的极限电流密度。
2 实验结果与讨论
2.1 铝阳极的线性伏安曲线
在对铝阳极扫描线性伏安曲线前,先采用循环伏安扫描使电极和电解质处于稳定状态,线性扫描时,扫速为10 mV/S,从0 V 开始往正方向扫描,得到的线性伏安曲线具有明显复现性。在2 种离子液体中得到的铝阳极的线性伏安曲线如图1 所示,以AlCl3-BMIC 离子液体中的线性伏安曲线为例,铝的初始溶解开始于0 V(vsAl/Al(III))左右,随着电位的正移,溶解电流逐渐增大并达到峰值。在0.32 V以后,随着电位的正移,电流反而减小,最后保持稳定。铝在AlCl3-BMIC 离子液体中的溶解过程可以分为3 个阶段:①电化学反应区,在此区域铝的溶解主要受电化学控制;②过渡区,在此区域铝的溶解同时受电化学和电活性离子的扩散控制;③钝化区,在此区域铝的溶解主要受电活性离子的扩散控制。
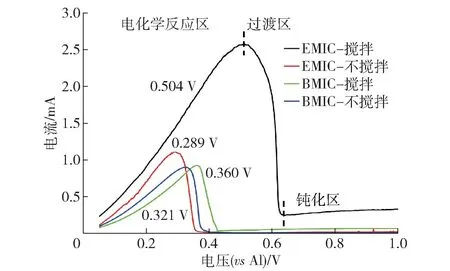
图1 铝在2 种离子液体中的LSV 曲线Fig.1 LSV curves of Al anode inAlCl3-EMIC and AlCl3-BMIC
铝在2 种离子液体中的峰值电位分别为0.360 V、0.321 V、0.504 V、0.289 V,对比LSV 曲线可知铝在2 种离子液体中具有相似的溶解性质。搅拌使得铝的溶解峰值电位正向移动,同时相同电位下的溶解电流变大。同一电位下,AlCl3-EMIC 离子液体中铝的溶解电流大于AlCl3-BMIC 离子液体。搅拌对AlCl3-EMIC 离子液体中铝的溶解电流提升影响明显,而对AlCl3-BMIC 离子液体中铝的溶解速率提升影响不大。这是因为:2 种离子液体的阴离子相同,而阳离子的区别在于咪唑环上相连的丁基和乙基,丁基对电活性离子的扩散阻碍更大,导致了AlCl3-BMIC 离子液体中铝的溶解更慢;搅拌增强了电解液中电活性离子的扩散,使得电极表面溶出的铝离子快速转移,电活性离子得到补充,加快了铝阳极的溶解;由于丁基的阻碍更大,对AlCl3-BMIC 的增强明显弱于AlCl3-EMIC。
2.2 铝阳极的计时电流曲线
控制电位分别在电化学反应区、峰值电位、过渡区以及钝化区,测定搅拌和不搅拌2 种工艺条件下,铝阳极在2 种离子液体中的计时电流曲线(CA),测试结果如图2 所示。由铝阳极在AlCl3-BMIC 中的计时电流曲线可知,不论施加电位在何区间,铝阳极在恒定电位下,电流均随着电解时间增长逐渐下降,最后趋于稳定。施加电位越大,起始的瞬时电流越大。当电位为0.16 V,在电化学反应区的时候,最后对应的稳定电流为最大的。当电位为0.32 V、0.36 V 和0.6 V,即对应电位处于峰值电位、过渡区和钝化区时,最后对应的稳定电流差别不大,且均低于电化学反应区电位下的稳定电流。当电位在峰值电位0.32 V 时,电流下降的斜率最小,而在电化学反应区和钝化区电位下,电位下降的斜率较大。相较于其他电位,峰值电位下,能在某一时间阶段内保持较大电流进行电解。铝阳极在AlCl3-EMIC 中的计时电流曲线也呈现同样的情况。对比铝阳极在搅拌和不搅拌的计时电流曲线,搅拌可以有效提高各区间电位下铝阳极在AlCl3-EMIC 的电流,对AlCl3-BMIC 的提高不大。

图2 铝阳极在2 种离子液体中的计时电流曲线Fig.2 CA curves of Al anode in AlCl3-EMIC and AlCl3-BMIC
2.3 铝阳极的计时电位曲线
控制铝阳极的电流密度分别为2、5、10、15 和20 mA/cm2,测定铝阳极在2 种离子液体中搅拌和不搅拌2 种工艺条件下的计时电位曲线时,测试结果如图3~5 所示。铝阳极在AlCl3-BMIC 中的计时电位曲线表明,电流密度为2 mA/cm2时,800 s 内铝阳极的电位在0~1 V 并保持稳定。当增大电流密度到5 mA/cm2,150 s 内铝阳极的电位突增到10 V,不能保持稳定,推测当电流密度达到某一极限值后,铝阳极表面局部的铝离子浓度急速增加,超过饱和浓度后结晶析出,形成了氯化铝钝化膜,钝化时阳极表面相关的电化学反应见式(1)~(3)。
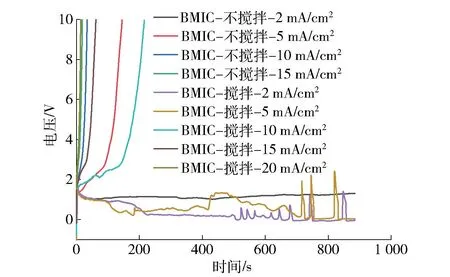
图3 铝阳极在AlCl3-BMIC 中的计时电位曲线Fig.3 CP curves of Al anode in AlCl3-BMIC
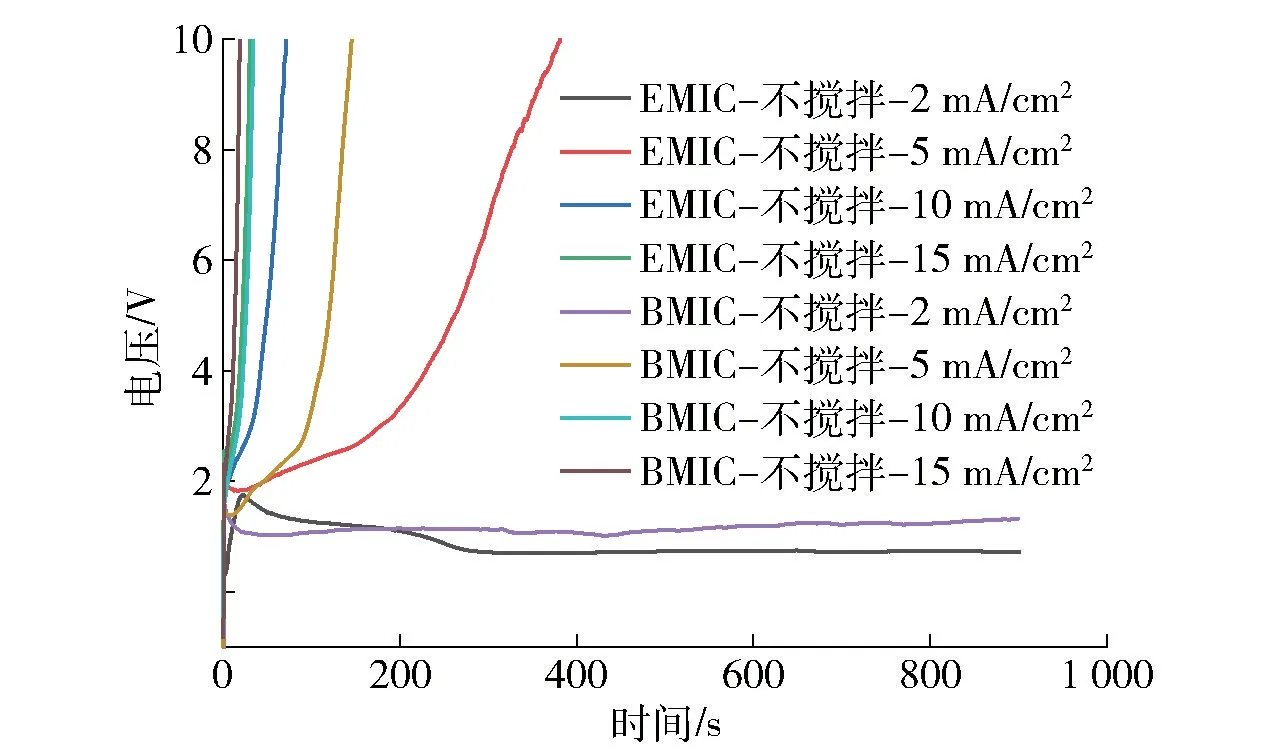
图4 铝阳极在2 种离子液体中的计时电位曲线(不搅拌情况下)Fig.4 CP curves of Al anode in AlCl3-EMIC and AlCl3-BMIC (without stirring)
随着电流密度增大,铝阳极钝化的时间逐渐减少,在达到15 mA/cm2时,仅在十几秒内铝阳极的电位就突增到10 V,钝化膜迅速形成。比较相同电流密度下搅拌和不搅拌铝阳极的电位,搅拌使得铝阳极的电位降低,与不搅拌相比,钝化需要的时间更长,铝阳极的极限电流密度变大。通过对比图5 铝阳极未钝化电流密度下的电位变化,搅拌使铝阳极电位不够稳定,波动比较大,这是由于搅拌导致电活性离子传质的波动,造成铝阳极表面铝离子浓度局部变化。
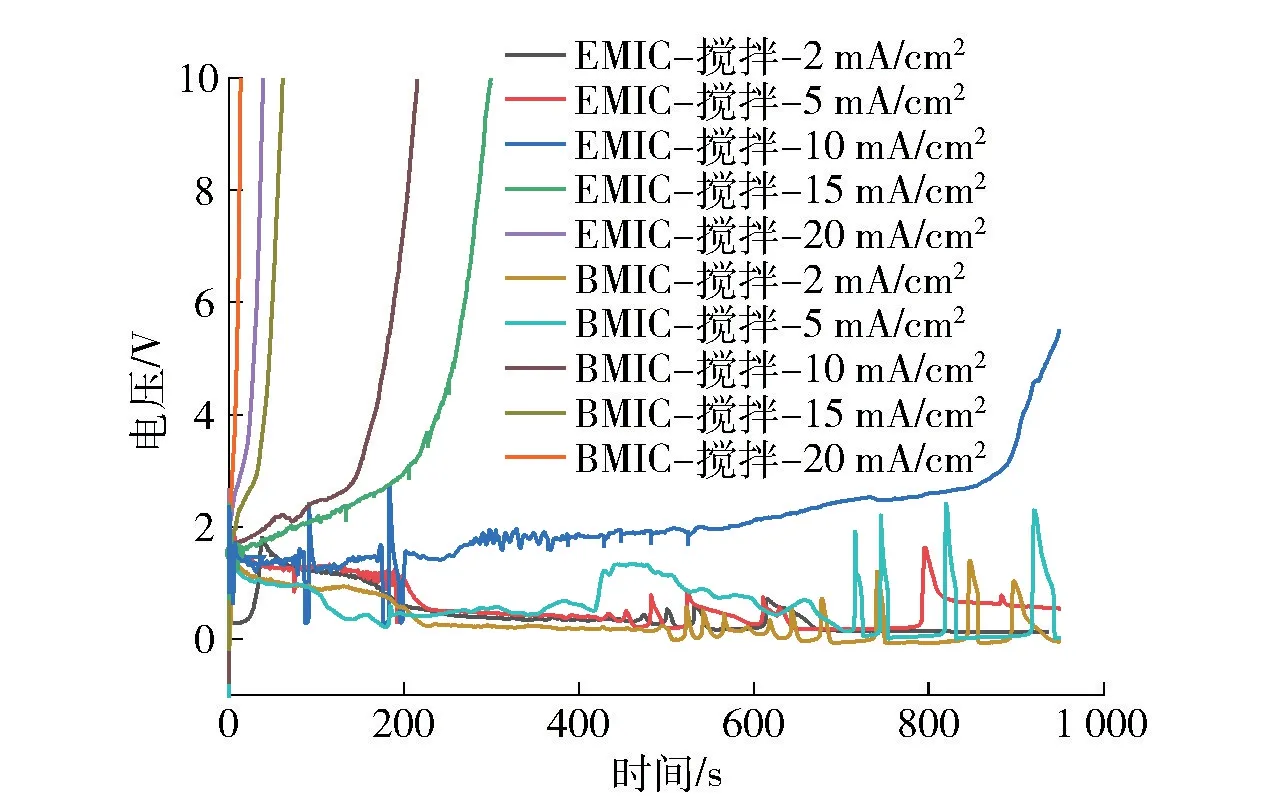
图5 铝阳极在两种离子液体中的计时电位曲线(搅拌情况下)Fig.5 CP curves of Al anode in AlCl3-EMIC and AlCl3-BMIC (stirring)
对比铝阳极在2 种离子液体中的计时电位曲线,搅拌可以提高铝阳极在2 种离子液体中的极限电流密度,并且对AlCl3-EMIC 的提高大于AlCl3-BMIC。同一电流密度,铝阳极在AlCl3-BMIC中的电位高于在AlCl3-EMIC 中的电位,铝阳极在AlCl3-EMIC 中能够保持稳定的时间更长。由于搅拌的原因,造成电位波动的现象更加明显。铝阳极的钝化原因在于铝电极表面溶解的铝离子不能快速扩散出去导致集聚钝化。铝阳极在AlCl3-BMIC 中更容易钝化,源于丁基对铝活性离子扩散的阻滞更强。
2.4 铝阳极溶解的极限电流密度
电流密度是电解工业重要的工艺参数,铝阳极在2 种离子液体中的计时电位曲线表明,阳极电流密度达到某一极限值后,铝电极表面形成氯化铝钝化膜,导致电位突增。LSV 曲线表明,随着阳极电位的增大,铝阳极的溶解电流密度先增大后减小,最后趋于稳定,存在溶解的极限电流密度。在搅拌和不搅拌2 种操作条件下,通过改变2 个铝电极板的施加电压使铝阳极电流达到最大,之后进行长达48 h的电解,并对期间的电压电流变化进行监测,以此最大电流为铝阳极在离子液体中的极限电流密度,相关结果如图6 所示。温度在313.15~343.15 K,搅拌时,铝阳极在 AlCl3-EMIC 体系的极限电流密度由7.67 mA/cm2增加到23.13 mA/cm2,同样条件下AlCl3-BMIC 体系的极限电流密度由6.17 mA/cm2增加到16.08 mA/cm2,铝阳极溶解的极限电流密度AlCl3-EMIC > AlCl3-BMIC。温度在313.15~343.15 K,不搅拌时,铝阳极溶解的极限电流密度AlCl3-EMIC(1.83~7.92 mA/cm2),略小于AlCl3-BMIC(2~7.92 mA/cm2),2 种离子液体中铝阳极溶解的极限电流密度相差不大。结果表明,升温和搅拌能增大铝阳极在2 种离子液体中的极限电流密度,搅拌对AlCl3-EMIC 离子液体中极限电流密度的增幅更大,这可能是因为AlCl3-EMIC 比AlCl3-BMIC离子液体更受限于铝活性离子的扩散。
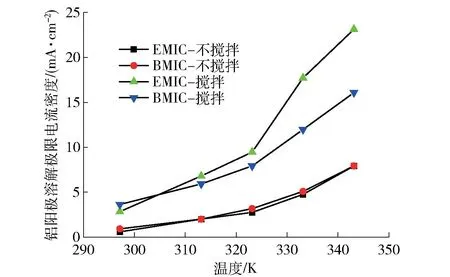
图6 铝阳极在2 种离子液体中的极限电流密度Fig.6 The anodic limiting current density of Al anode in AlCl3-EMIC and AlCl3-BMIC
铝阳极在2 种离子液体中溶解的极限电流密度与温度之间符合Arrhenius 关系式[15,19],见式(4)。
式中:A为指前因子;R为摩尔气体常量;T为热力学温度,K;Ea为表观活化能,kJ/mol。
极限电流密度与温度之间的Arrhenius 线性拟合如图7 和表1 所示。由图表可得出:在AlCl3-EMIC阳极溶解的表观活化能大于AlCl3-BMIC,搅拌使得阳极溶解的表面活化能降低,溶解更容易。

表1 铝阳极溶解的极限电流密度与温度之间的Arrhenius 拟合参数Table 1 Regression parameters of the Arrhenius equation between lni and temperature
2.5 铝阳极恒流电解和恒压电解的阳极产物
用2 个铝片组成两电极体系,在AlCl3-EMIC 离子液体中分别进行恒电流电解(5 mA/cm2,40 ℃)和恒电压电解(1 V,常温)。随着恒电流电解的进行,铝阳极表面逐渐出现一层黑色的阳极泥,该阳极泥不溶于离子液体,如图8 中(a)(d)所示。在其他温度(40~70 ℃)和电流密度(5~20 mA/cm2)下普遍出现同样的黑色阳极泥,已有文献证明该阳极泥的组成基本上均为碳元素[16]。黑色阳极泥的出现,证明了铝阳极表面电解过程中普遍存在的有机分解副反应。恒电压电解时,此时电流密度很小(<1 mA/cm2),铝阳极表面逐渐出现一层白色固体黏性膜,随着电解时间的加长(48 h 以上),该白色固体越来越多,并逐渐沉积到底部,如图8 中(b)(c)所示。根据文献[15,18],此类物质为析出的氯化铝固体。该白色固体的析出从宏观上证明了铝阳极表面存在铝离子积聚现象,导致氯化铝的析出。

图8 铝阳极恒流电解和恒压电解的阳极产物Fig.8 Anodic products of constant-current and constant-voltage electrolysis of Al anodes
3 结论
通过比较铝在酸性AlCl3-EMIC 和AlCl3-BMIC 2 种离子液体中的阳极溶解,可以得出以下结论。
1)不同电位下,铝在2 种离子液体中的阳极溶解分为电化学反应区、过渡区和钝化区。但相同条件下,铝阳极在AlCl3-EMIC 中的溶解电流大于AlCl3-BMIC。
2)铝阳极的电流密度存在极限值,达到极限电流密度以后,铝阳极开始钝化,造成电位突增。电流密度越大,钝化时间越短。相同工艺条件下,铝阳极在AlCl3-EMIC 中的极限电流密度大于AlCl3-BMIC。钝化原因是铝阳极表面铝离子的积聚,搅拌可有效增大传质效率,从而减缓钝化时间。
3)搅拌和升温均可增大铝阳极的极限电流密度。搅拌对AlCl3-EMIC 的增幅远大于AlCl3-BMIC。313.15~343.15 K 温度范围内,铝阳极在AlCl3-EMIC 体系的极限电流密度范围为 1.83~23.13 mA/cm2,在AlCl3-BMIC体系为 2.00~16.08 mA/cm2。搅拌时,铝阳极溶解的极限电流密度AlCl3-EMIC >AlCl3-BMIC。
4)铝阳极在离子液体中溶解的过程中,普遍存在有机分解副反应和表面铝离子积聚,使阳极表面出现黑色阳极泥以及氯化铝固体析出。阳极表面铝离子积聚使得阳极钝化,限制阳极极限电流密度。黑色阳极泥使电效降低,且引入杂质,制约离子液体的工业应用。
综上,铝阳极在2 种离子液体中的溶解机理相同,均受限于铝阳极表面铝离子的扩散。2 种电解液中的阴离子相同,而阳离子中咪唑环上相连丁基和乙基的差别,导致电活性铝离子的扩散速率不同。因此,在不同的工艺条件下,电流密度和钝化时间不同。相较之下,AlCl3-EMIC 比AlCl3-BMIC 显示出更优异的工业应用潜力。
致谢
感谢中国科学院绿色过程制造创新研究院自主部署项目(IAGM2022D01)、国家自然科学基金资助项目(22378400)和河南省自然科学基金资助项目(232300421209)的支持。
