捻转血矛线虫LAMP-LFD检测方法的建立
2024-03-18汤洪宁项继忠马光旭杜爱芳
段 钰,汤洪宁,项继忠,吴 飞,马光旭,杜爱芳,杨 怡*
(1.浙江大学动物科学学院,浙江省动物预防医学重点实验室,浙江杭州 310058;2.湖州咩咩羊牧业有限公司,浙江湖州 313023)
捻转血矛线虫(Haemonchuscontortus)寄生于反刍动物皱胃,靠吸食血液为生,可引起宿主贫血、发育不良,感染严重时死亡,给畜牧业带来严重影响。捻转血矛线虫繁殖能力强,感染宿主体内可携带上万条虫,一条雌性成虫每天可产卵5 000~15 000个[1]。捻转血矛线虫在自由生活阶段和具有感染性的L3期生存能力强,在适宜环境中能迅速增多,增加了感染率[2]。为了解捻转血矛线虫感染分布情况,国内外进行了大量流行病学调查。如英国的感染率高达66%[3],澳大利亚为37.18%[4],瑞典为25%[5],西非部分地区达到85%[6],中非卢旺达地区为75.7%[7],非洲东北部埃塞俄比亚部分地区达到68.75%[8]。我国捻转血矛线虫病在东北、西北、内蒙古等地多发。吉林省西北地区的感染率为34.99%[9],内蒙古乌审旗地区为44.5%[10],赤峰市为82.5%[11],通辽市为80.4%[12],甘肃南部地区的平均感染率为14.30%[13],其他地区如福建总体感染率为67.9%[14],湖南岳阳为63.33%[15],贵州雷山为18.18%[16]。
羊感染捻转血矛线虫后可能导致死亡,因此快速、准确诊断捻转血矛线虫病对实际生产意义重大。近年来该病的临床诊断主要依靠粪便虫卵检测和死尸临床剖检。粪便虫卵检测法操作简单,但虫卵数量较少时易造成漏检;线虫混合感染时,因虫卵形态较相似,不能确诊。临床剖检则只能针对死尸,通过挑取皱胃内的成虫进行确诊。分子诊断技术检测速度相对较快、灵敏性高,聚合酶链反应(polymerase chain reaction,PCR)、实时定量PCR(quantitative real-time PCR,qPCR)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)等技术已广泛应用于寄生虫检测中。LAMP相对于其他核酸分子检测技术,具有试验装置简单、耗时短、结果判定简单、特异性强、灵敏度高的特点。LAMP利用Bst(Bacillusstearothermophilus)DNA聚合酶的链置换活性在等温条件下扩增DNA,与PCR中使用的聚合酶相比,BstDNA聚合酶对粪便样品中常见的抑制因子具有更好的耐受性,可以从粗犷样品中成功扩增DNA,最大限度减少DNA的提取步骤[17]。而横向流动试纸条(lateral flow dipstick,LFD)可以通过对LAMP产物进行生物素和荧光素标记,与试纸条上包被生物素抗体的检测线结合,使结果可视化,判读更为方便,更具有特异性。
本研究针对捻转血矛线虫线粒体细胞色素氧化酶亚基Ⅰ(mitochondrial cytochrome oxidase subunit Ⅰ,mt-COⅠ)基因的保守区段设计1组引物和1条探针,将LAMP技术与LFD技术有机结合并优化,建立了捻转血矛线虫的 LAMP-LFD检测方法,旨在为捻转血矛线虫病的快速鉴别诊断提供新选择。
1 材料与方法
1.1 材料
1.1.1 虫株及样品 捻转血矛线虫虫卵及成虫由浙江大学动物科学学院寄生虫研究室保存;夏伯特线虫成虫、奥斯特线虫成虫、毛首线虫成虫由四川省畜牧科学研究院惠赠。50份湖羊粪便样品采自湖州咩咩羊牧业有限公司。
1.1.2 主要试剂 血液/细胞/组织DNA基因组提取试剂盒(DP304),天根生物技术(北京)有限公司产品;Fluorescent Dye(FD)、10×LAMP buffer、BstⅡ DNA聚合酶、100 mmol/L MgSO4,NEB(北京)生物技术有限公司产品;甜菜碱,Sigma(美国)公司产品;10 mmol/L dNTP Mix,生工生物工程(上海)股份有限公司产品。
1.1.3 主要仪器 水浴锅,上海精宏实验设备有限公司产品;NanoDrop超微量分光光度计,赛默飞世尔(美国)公司产品;恒温金属浴干式恒温器,大龙兴创实验仪器(北京)股份公司产品;核酸电泳仪,北京六一科技有限公司产品;凝胶成像仪,杭州亚旭科技有限公司产品;T100TMThermalCycler、CFX96TMReal-Time System,Bio-Rad公司产品。
1.2 方法
1.2.1 基因组DNA的提取 用北京天根公司生产的血液/细胞/组织基因组DNA提取试剂盒(DP304)提取捻转血矛线虫、夏伯特线虫、奥斯特线虫、毛首线虫基因组DNA,按说明书操作。提取完成测定DNA浓度,保存于-80℃备用。
1.2.2 引物的设计与筛选 从GenBank中获得捻转血矛线虫mt-COⅠ基因序列(登录号:LS997568),针对其保守片段,根据LAMP引物的设计原则,用Primer ExplorerV5设计1组引物,每组包括2条外引物F3和B3,2条内引物FIP和BIP。其中,BIP的5′端用生物素标记。同时设计合成一条5′端标记6-FAM的特异性探针。引物和探针均由上海生工股份有限公司合成(表1)。
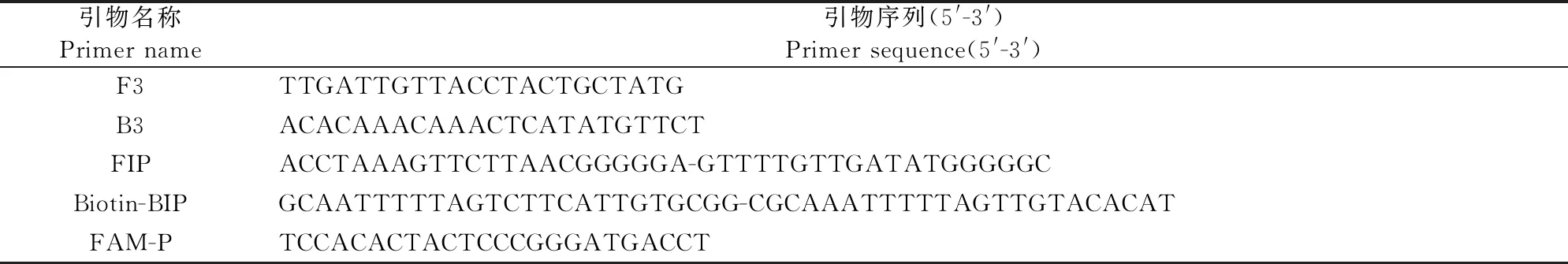
表1 mt-COⅠ引物和探针
1.2.3 实时荧光LAMP反应体系的优化
1.2.3.1 最佳反应温度的确定 按下列体系加样:2.5 μL 10×LAMP buffer,2.5 μL dNTP Mix(10 mmol/L),1.0 μLBstⅡ DNA聚合酶(8 U),0.75 μL MgSO4(100 mmol/L),2.0 μL 甜菜碱(5 mol/L),FIP/BIP(10 μmol/L)各4.0 μL,F3/B3(10 μmol/L)各0.5 μL,1.0 μL DNA模板,0.5 μL FD,ddH2O补至25 μL。将以上混合物分别于61、62、63、64、65、66℃反应1 h,通过CFX96TMreal-time system实时荧光曲线出峰时间和峰值高度判定结果。
1.2.3.2 最佳反应时间的确定 保持体系中其他成分不变,设置多组阴性对照,判断阴性组中非特异性扩增的出峰时间点,以此确定最佳反应时间。
1.2.3.3 Mg2+最佳反应浓度的确定 保持体系中其他成分不变,分别加入MgSO4使其终浓度为2、4、6、8、10 mmol/L,同时设置阴性对照。最佳温度下反应1 h,通过CFX96TMreal-time system判定结果。
1.2.3.4 dNTP最佳反应浓度的确定 保持体系中其他成分不变,分别加入dNTP使其终浓度为0.4、0.6、0.8、1.0、1.2 mmol/L。通过CFX96TMReal-Time System判定结果。
1.2.4 LAMP-LFD检测方法的建立 基于优化后的LAMP体系,将LAMP产物与20 pmoL带有FAM标签的探针于原条件下杂交5 min,取10 μL反应产物加入190 μL PBS溶液进行LFD检测。同时设置实时荧光LAMP反应,反应产物分别通过CFX96TMreal-time system和2%琼脂糖凝胶电泳检测。
1.2.5 LAMP、LAMP-LFD方法的特异性试验 分别以夏伯特线虫、奥斯特线虫、毛首线虫、捻转血矛线虫DNA为模板,进行LAMP-LFD检测,同时设置实时荧光LAMP反应,反应产物分别通过CFX96TMreal-time system和2%琼脂糖凝胶电泳检测。
1.2.6 LAMP、LAMP-LFD灵敏度试验 将捻转血矛线虫基因组DNA分别稀释成10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL,进行LAMP-LFD检测,同时设置实时荧光LAMP反应,反应产物分别通过CFX96TMReal-Time System和2%琼脂糖凝胶电泳检测。
1.2.7 临床样品的检测 将采集的50份临床样品提取DNA,分别进行LAMP-LFD试纸条检测和粪便虫卵镜检,使用SPSS Statistics v.23.0分析比对两种方法的检测结果。
2 结果
2.1 LAMP体系的优化
当反应温度为63℃时扩增曲线出峰较早,且峰值最高(图1A),因此本LAMP反应体系的最佳反应温度为63℃。设置多组阴性对照,经过多次重复LAMP扩增,发现阴性组中非特异性扩增的出峰时间点为110 cycles即55 min(图1B),因此本LAMP反应体系的阳性判断时间点为55 min内。对Mg2+、dNTP的反应浓度进行优化(图1C和图1D),Mg2+最佳反应浓度为4 mmol/L,dNTP最佳反应浓度为1.0 mmol/L。
A.最佳反应温度,1~6.63℃、61℃、62℃、64℃、65℃、66℃;7~12.阴性对照;B.最佳反应时间,1.捻转血矛线虫;2~5.阴性对照;C.Mg2+最佳反应浓度,1~5.4、6、8、10、2 mmol/L;6.阴性对照;D.dNTP最佳反应浓度,1~5.1.0、1.2、0.8、0.6、0.4 mmol/L;6.阴性对照
优化后的LAMP反应体系为:2.5 μL 10×LAMP buffer,2.5 μL dNTP Mix(10 mmol/L),1.0 μLBstⅡ DNA聚合酶(8 U),0.5 μL MgSO4(100 mmol/L),2.0 μL甜菜碱(5 mol/L),FIP/BIP(10 μmol/L)各4.0 μL,F3/B3(10 μmol/L)各0.5 μL,1.0 μL DNA模板,ddH2O补至25 μL。LAMP反应的最佳温度为63℃,最佳反应时间为55 min。
2.2 LAMP-LFD方法的建立
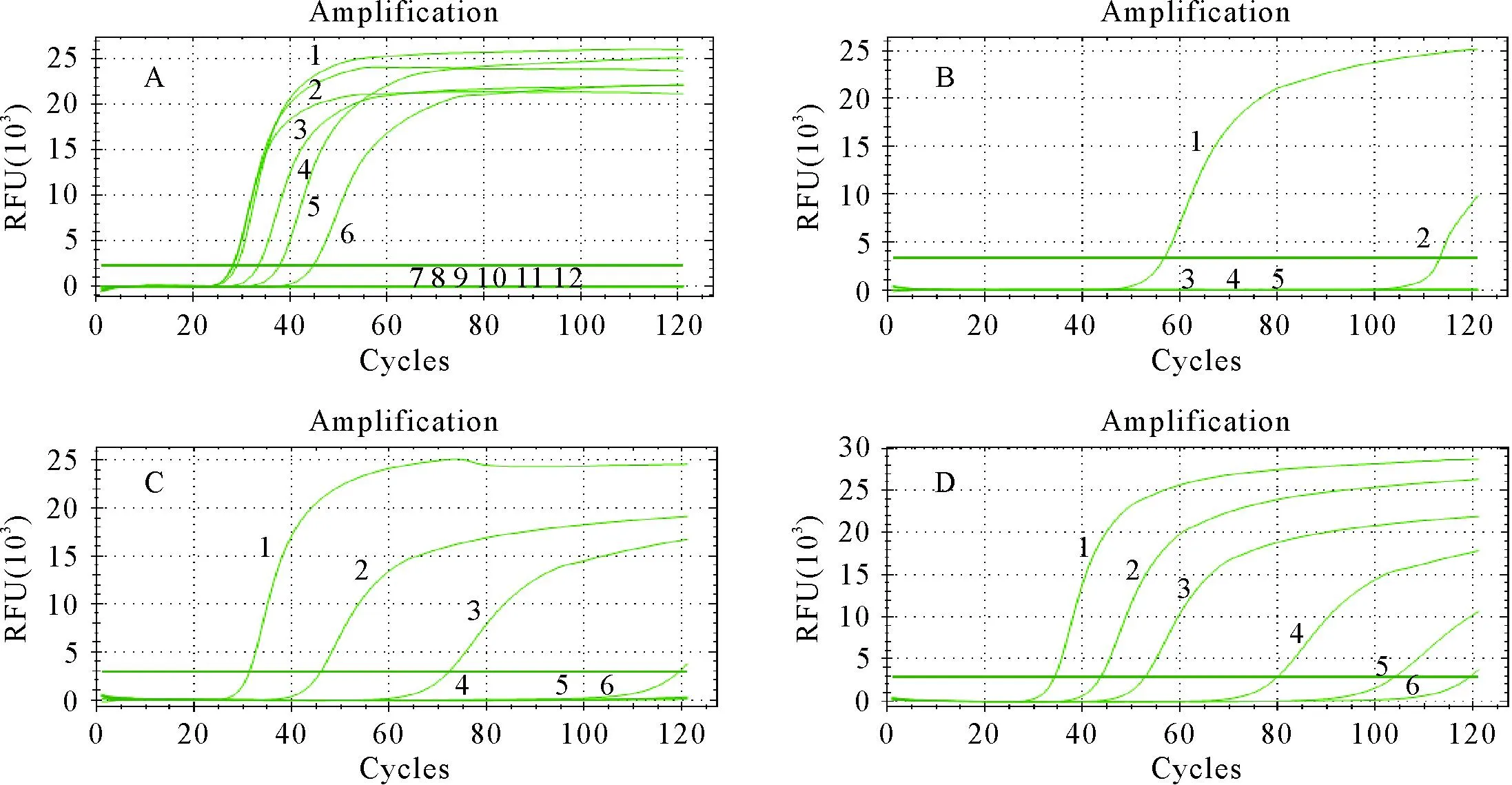
阳性模板的LAMP-LFD检测结果为质控线和检测线均显色,阴性对照仅出现一条蓝色质控线(图2C),与实时荧光LAMP检测结果(图2A)以及琼脂糖凝胶电泳检测结果(图2B)相符合,表明LAMP-LFD检测方法可行。
A.LAMP扩增曲线;B.LAMP产物电泳图;C.LAMP-LFD检测结果;M.DNA标准DL 100;1.捻转血矛线虫;2.阴性对照
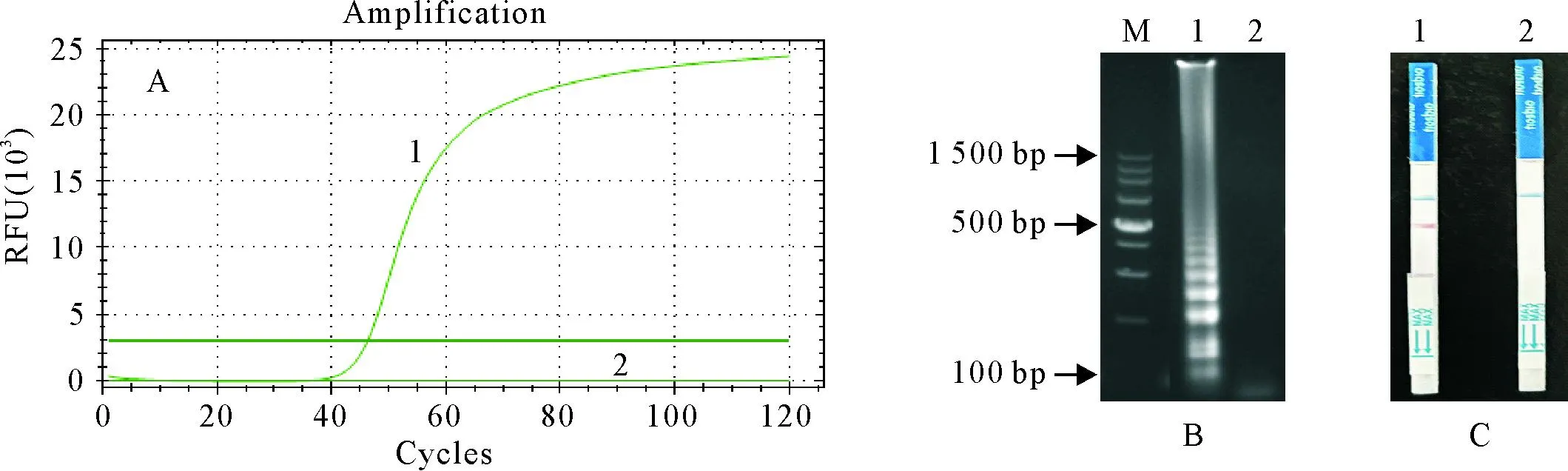
A.LAMP扩增曲线;B.LAMP产物电泳图;C.LAMP-LFD检测结果;M.DNA 标准DL 100;1.捻转血矛线虫;2.绵羊夏伯特线虫;3.环纹奥斯特线虫;4.毛首线虫;5.阴性对照
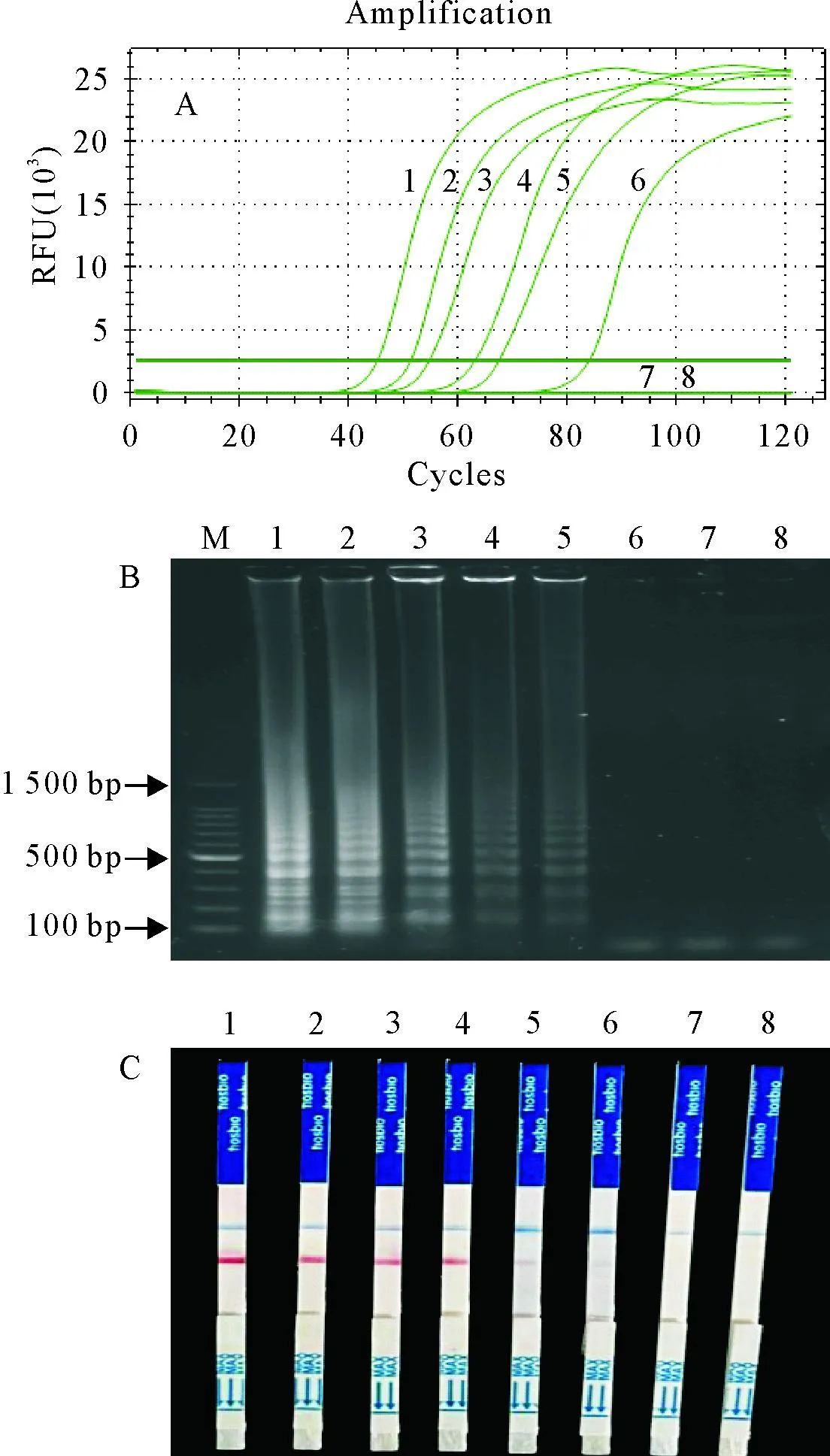
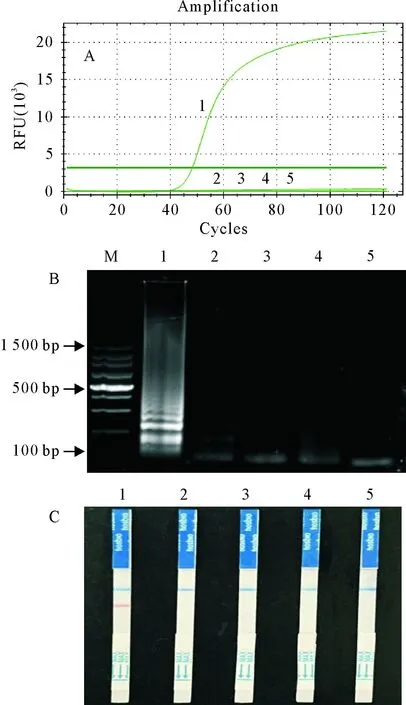
A.LAMP扩增曲线;B.LAMP产物电泳图;C.LAMP-LFD检测结果;M.DNA 标准DL 100;1~7.10 ng、1 ng、100 pg、10 pg、1 pg、100 fg、10 fg;8.阴性对照
2.3 LAMP、LAMP-LFD方法的特异性试验
在同一条件下,分别以夏伯特线虫、奥斯特线虫、毛首线虫、捻转血矛线虫DNA为模板,进行LAMP以及LAMP-LFD检测(图3),除捻转血矛线虫的DNA为模板检出阳性外,其他均为阴性。
2.4 LAMP、LAMP-LFD灵敏度试验
结果显示,建立的LAMP方法,实时荧光扩增曲线最低可以检测到100 fg(图4A),2%琼脂糖凝胶电泳最低检测量为1 pg(图4B),LAMP-LFD能检到捻转血矛线虫DNA的最低量为100 fg(图4C)。
2.5 临床样本的检测
对50份粪便样品进行显微镜检测阳性率为24%(12/50),LAMP-LFD检测阳性率为20%(10/50),与粪便虫卵检测法的符合率为96%(48/50),Kappa值为0.884(P=0.001),说明两种方法检测结果一致性较高。
3 讨论
捻转血矛线虫的检测方法有病原学检测、免疫学及分子生物学方法等。病原学检测方法如常见的粪便虫卵镜检及凝集素荧光标记技术[18],既耗时又不准确,不适合临床检测大量粪便样本。捻转血矛线虫的免疫学诊断方法以抗体检测为主。通过研究捻转血矛线虫的排泄分泌蛋白ES24,建立了血清IgG ELISA检测方法[19];用捻转血矛线虫复合诊断抗原制备的胶体金试纸条使用较方便[20]。这些方法无法区分既往感染和现症感染。分子学诊断技术近年来得到广泛的应用,如 PCR 技术可有效解决相似寄生虫虫卵的鉴别问题[21],RT-qPCR推动了寄生线虫发育各个阶段诊断方法的发展且能对虫卵进行定量[22],但这两种方法需要昂贵的设备,常用于实验室检验。
相比于PCR和qPCR技术,LAMP技术所需试验装置简单、操作更为便捷,已被广泛用于检测病毒、细菌和寄生虫[23]。犬猫刚地弓形虫的LAMP-LFD检测方法,灵敏度达到1 fg[24]。针对捻转血矛线虫核糖体DNA的ITS-2序列建立了LAMP方法,产物分别用凝胶电泳法和SYBR Green Ⅰ染料目测法检测,灵敏度为1 pg[25]。ITS-2因其在种间高度特异,常被用作诊断靶标来检测目标物种,其他基因如28S rRNA、COⅠ和COⅡ等也常用于鉴别反刍动物胃肠道内线虫[26-28]。有研究基于捻转血矛线虫mt-COⅠ 基因建立了一种 SYBR Green qPCR 方法,用于检测和定量捻转血矛线虫,具有高度的特异性和敏感性[29],能够区分出捻转血矛线虫和柏氏血矛线虫。本研究基于mt-COⅠ基因的保守序列设计特异性引物,建立捻转血矛线虫的LAMP-LFD检测,灵敏度达到100 fg,相较于传统PCR法高出103倍[30],相较于杨新等建立的LAMP法高出10倍[25]。
LAMP反应产物检测方法有多种,包括荧光曲线法、琼脂糖电泳法、染料显色法、LFD法等。本研究同时用几种方法对LAMP产物进行检测,琼脂糖电泳法需要用到电泳仪、凝胶成像仪,耗费时间长,在临床应用中推广意义不大;染料法如SYBR Green Ⅰ染料、羟基萘酚蓝(HNB)染料、钙黄绿素染料,在微量扩增时肉眼难以辨别轻微的颜色变化。本研究将LAMP与LFD试纸条相结合,结果判读更方便、准确。相比前两种检测方法,LFD特异性更高,灵敏度也更高。
本研究以mt-COⅠ基因保守区段为靶标设计引物及探针,建立了一种捻转血矛线虫的LAMP-LFD检测方法。经检验,本研究建立的LAMP-LFD方法对捻转血矛线虫基因组DNA的最低检测限为100 fg,与奥斯特线虫、夏伯特线虫、毛首线虫基因组DNA不发生交叉反应。LAMP-LFD方法具有灵敏度高、特异性强、操作简便、结果可视化的优点,有望为捻转血矛线虫病的临床防控提供新的技术支撑。
