腹腔镜与开腹肝切除术治疗肝细胞癌临床疗效的真实世界比较研究
2024-03-18李军姚磊胡芳远叶轲肖莫延张鸽文
李军,姚磊,胡芳远,叶轲,肖莫延,张鸽文
[1.中南大学湘雅医院 普通外科,湖南 长沙 410008; 2. 国家老年疾病临床医学研究中心(湘雅医院),湖南 长沙 410008]
方法:回顾性分析2016 年1 月1 日—2020 年12 月31 日在中南大学湘雅医院517 例因HCC 施行肝切除术的患者临床资料。其中,196 例行腹腔镜肝切除术(腹腔镜组),321 例行开腹肝切除术(开腹手术组)。分析比较两组患者一般资料、围手术期情况及随访指标。
结果:一般资料中,腹腔镜组与开腹手术组患者的肿瘤分期、肿瘤直径、术前白蛋白水平及肝切除部位方面的差异有统计学意义(均P<0.05),其余差异无统计学意义(均P>0.05)。围手术期指标中,腹腔镜组的中位术中出血量(200.00 mL vs. 300.00 mL)、术后中位住院时间(6 d vs. 8 d)、术后肝功能恢复、术后并发症发生率(6.63% vs. 14.02%)均优于开腹手术组(均P<0.05)。随访指标中,腹腔镜组总生存期(OS)和无病生存期(DFS)优于开腹手术组(OS:χ2=4.478,P=0.034;DFS:χ2=8.915,P=0.003)。采用倾向性评分匹配(1∶1 匹配,每组51 例)均衡两组的一般资料后比较,腹腔镜组术后中位住院时间(6 d vs. 9 d)与术后并发症发生率(3.92% vs. 19.61%)仍优于开腹手术组,但两组的OS 与DFS 差异无统计学意义(均P>0.05)。
结论:腹腔镜肝切除术治疗HCC 是安全、有效的,并可加快患者术后恢复,缩短术后住院时间。腹腔镜肝切除术和开腹肝切除术治疗HCC 的远期疗效相当。腹腔镜有其自身的适应证,在充分评估患者后,腹腔镜手术是HCC 患者的首选手术方式。
1991 年Reich 等[1]首次应用腹腔镜切除了位于肝脏边缘的良性肿瘤,揭开了腹腔镜肝切除术的序幕;1994 年周伟平等[2]完成了我国首例腔镜下左外叶切除术,开创了我国腔镜肝切除的先河;2005 年蔡秀军等[3]完成了我国首例全腔镜下右半肝切除术。之后腹腔镜肝切除术进一步推广,腹腔镜肝切除的数量激增,并随着新手术器械及能量器械的使用以及临床医师腹腔镜肝切除术手术技巧的提高和经验的积累,腹腔镜肝切除对可切除肿瘤的大小限定愈加模糊,肿瘤位置也拓展到包括尾状叶、Ⅶ段在内的各个肝段,腹腔镜肝切除的适应证目前已逐渐趋同开腹手术,可行性、安全性和有效性也逐步得到证实[4-8]。但由于腹腔镜肝切除术在患者的选择上往往有更严格的要求,因此腹腔镜肝切除术和开腹肝切除术的选择也有待在不同的人群和医学中心仔细评估[9],且时至今日,仍有学者对腹腔镜肝切除术的不良肿瘤学结局心存疑虑。因此,本研究回顾性分析了近5 年间腹腔镜和开腹肝切除术治疗肝细胞癌(hepatocellular carcinoma,HCC) 患者的临床资料,探讨比较腹腔镜与开腹肝切除术治疗HCC 的临床疗效。
1 资料与方法
1.1 一般资料
回顾性分析2016 年1 月1 日—2020 年12 月31 日在中南大学湘雅医院因HCC 而施行肝切除术的患者临床资料。纳入标准:⑴ 中南大学湘雅医院住院患者;⑵ 行手术切除治疗患者;⑶ 术后病理结果回报证实为原发性HCC;⑷ 肝功能Child-Pugh 分级为A 级或B 级。排除标准:⑴ 合并肝外转移或术中探查发现肿瘤侵犯腹壁、胃、横结肠等邻近脏器;⑵ 术前病史、体征及辅助检查提示HCC 已破裂出血,并且术中得到证实;⑶ 混合型肝癌;⑷ 合并其他类型癌。根据纳入及排除标准,共收集517 例患者,其中行腹腔镜肝切除术患者196 例(腹腔镜组)、开腹肝切除术患者321 例(开腹手术组)。
1.2 手术方法
腹腔镜组:全麻后,采用头高脚低仰卧剪刀位,对于肝右后叶HCC 肿块则需垫高患者右侧腰背部,常规消毒铺巾,扶镜手站于患者双下肢之间,主刀及第一助手分别站于患者两侧,一般采用五孔法来实施手术,首先建立并维持10~12 mmHg(1 mmHg=0.133 kPa)的CO2气腹,于脐周1~2 cm 用10 mm Trocar 建立观察孔,置入腹腔镜,观察腹、盆腔内有无转移结节或侵犯其余脏器,接着在腹腔镜指示下于剑突下方及其下方10 cm 偏左侧、右锁骨中线与肋缘下交点稍下方、右侧腋前线处放置10 mm、5 mm、12 mm、5 mm Trocar 作为操作孔,布孔的原则一般以肿瘤为中心呈扇形展开,观察孔位于扇形的中点(图1)。超声刀离断肝圆韧带、镰状韧带,充分游离肝脏、暴露肿块,采用术中超声定位,行解剖性或非解剖性肝切除,非解剖性肝切除常规距肿块1~2 cm 制定预切线。阻断第一肝门,用超声刀由浅入深完整切除肿块,肝脏断面用电凝止血,标本装入标本袋,经扩大的剑突下切口取出,放置腹腔引流管,缝合伤口。

图1 腹腔镜肝切除术布孔Figure 1 Laparoscopic hepatectomy port placement
开腹手术组:全麻后,常规消毒铺巾,取仰卧位右上腹反“L”型切口分层进腹。安装肝叶拉钩,探查腹、盆腔,确定肿块位置,离断肝周韧带,充分游离肝脏,术中超声定位,行解剖性或非解剖性肝切除,非解剖性肝切除常规距肿块1~2 cm 制定预切线。阻断第一肝门,由浅入深使用钳夹法完整切除肿块,取出标本,肝脏断面采用电凝止血,放置腹腔引流管,缝合伤口。
1.3 观察指标
围手术期指标:手术时间、术中出血量、术中是否输血、肿瘤分化程度、肿瘤是否侵犯微血管、住院时间、血清甲胎蛋白(AFP)水平、血清总胆红素水平、白蛋白水平、丙氨酸氨基转移酶(ALT) 水平、天门冬氨酸氨基转移酶(AST) 水平、凝血酶原时间(PT)、术后并发症情况(参照Clavien-Dindo 分级标准[10]);随访指标:术后1、3、5 年总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS)。
1.4 统计学处理
采用SPSS 26.0 统计软件对数据进行统计分析。对符合正态分布及近似正态分布的计量资料结果以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,对不符合正态分布的计量资料结果用中位数(四分位数间距)[M(IQR)]表示,两组间比较采用秩和检验;计数资料率的结果用例数(百分比)[n(%)],两组间比较采用χ2检验;倾向性评分匹配(propensity score matching,PSM) 卡钳值为0.02;采用Kaplan-Meier 模型的Log-rank 检验分析OS 及DFS。检验标准ɑ=0.05,P<0.05 为差异有统计学意义。
2 结 果
2.1 两组患者一般资料
根据纳入及排除标准,共收集517 例手术患者,其中腹腔镜组患者196 例,开腹手术组患者321 例(包含40 例腹腔镜中转开腹患者)。在肿瘤分期上,两组患者差异有统计学意义(P<0.01),在肿瘤直径上,腹腔镜组患者肿瘤直径明显小于开腹手术组患者[(4.48±2.73) cmvs.(6.25±3.85)cm,P<0.01],且腹腔镜组术前白蛋白水平略高于开腹手术组[(41.49±4.43) g/Lvs.(40.65±4.29)g/L,P=0.034];在肝切除的部位方面,腹腔镜组中位于Ⅱ、Ⅲ、Ⅳb、V、Ⅵ段的简单部位切除126 例,位于Ⅰ、Ⅳa、Ⅶ、Ⅷ段的复杂部位切除47 例,大于或等于3 个肝段的肝大部切除23 例;开腹手术组中位于Ⅱ、Ⅲ、Ⅳb、Ⅴ、Ⅵ段的简单部位切除135例,位于Ⅰ,Ⅳa,Ⅶ,Ⅷ段的复杂部位切除126 例,≥3 个肝段的肝大部切除60 例,两组患者在肝切除部位方面差异有统计学意义(P<0.01)。除此4 项指标外,两组患者一般资料差异无统计学意义(均P>0.05)(表1)。

表1 腹腔镜组与开腹手术组患者一般资料Table 1 General information of patients in the laparoscopic and open surgery groups
2.2 围手术期情况
两组患者的手术时间、肿瘤分化程度及肿瘤是否侵犯微血管差异均无统计学意义(均P>0.05)。腹腔镜组术中出血明显少于开腹手术组[200.00 (100.00~400.00) mLvs.300.00 (200.00~600.00)mL,P<0.01];术后住院时间腹腔镜组也明显短于开腹手术组[6(5~7)dvs.8(6~11)d,P<0.01];术后肝功能指标(血清总胆红素、白蛋白、ALT、AST、PT) 情况腹腔镜组也明显要好于开腹手术组;在术后并发症发生率方面,腹腔镜组明显低于开腹手术组[6.63% (13/196)vs.14.02% (45/321),P=0.01]。腹腔镜组围手术期无死亡病例,开腹手术组围手术期有2 例死亡病例,死亡原因均为肝功能衰竭。根据Clavien-Dindo 分级标准,腹腔镜组中出现Ⅱ级并发症10 例,Ⅲ级并发症3 例,Ⅳ级并发症0 例;Ⅴ级并发症0 例,开腹手术组中出现Ⅱ级并发症24 例,Ⅲ级并发症15 例,Ⅳ级并发症4 例,Ⅴ级并发症2 例,秩和检验,两组患者并发症严重程度差异无统计学意义(P=0.097)(表2)。

表2 腹腔镜组与开腹手术组患者围手术期情况Table 2 Perioperative conditions of patients in the laparoscopic and open surgery groups
2.3 随访结果
经Kaplan-Meier 生存分析,腹腔镜组OS 和DFS均优于开腹手术组(OS:χ2=4.478,P=0.034;DFS:χ2=8.915,P=0.003)(图2)。腹腔镜组患者的第1、3、5 年OS 率分别为93.58%、76.19%、62%, 第1、 3、 5 年DFS 率分别为77.01%、61.90%、54.00%;开腹手术组患者的第1、3、5 年OS 率分别为87.54%、70.83%、57.4%,第1、3、5 年DFS 率分别为67.02%、46.97%、40.83%。
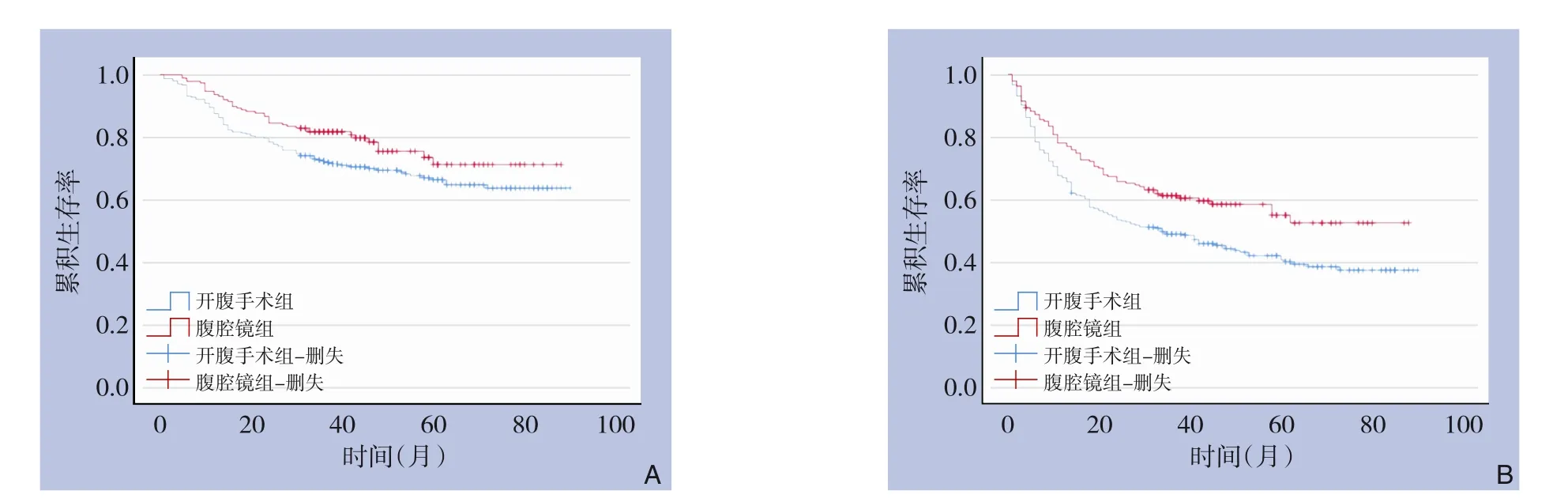
图2 腹腔镜组与开腹手术组患者术后生存曲线 A:OS;B:DFSFigure 2 Postoperative survival curves for patients in the laparoscopic group and open surgery group A: OS; B: DFS
2.4 PSM后腹腔镜组与开腹手术组资料比较
由于两组患者的肿瘤分期、肿瘤直径、手术切除部位等术前情况会影响手术的效果及预后,从而造成两组之间的选择偏移,为了消除这种影响,笔者以年龄、性别、是否有病毒性肝炎、是否存在肝硬化、既往是否有腹部手术史、肝功能Child-Pugh 分级、AFP 水平、血清总胆红素水平、白蛋白水平、ALT 水平、AST 水平、PT、肿瘤分期、肿瘤数目、肿瘤直径、手术切除部位为协变量进行PSM,在所有患者中选出条件相近的102 例,匹配出腹腔镜组和开腹手术组各51 例,进行进一步分析。
2.5 PSM后腹腔镜组与开腹手术组一般资料
PSM 后,两组患者的年龄、性别、是否有病毒性肝炎、是否存在肝硬化、既往是否有腹部手术史、肝功能Child-Pugh 分级、AFP 水平、血清总胆红素水平、白蛋白水平、ALT 水平、AST 水平、PT、肿瘤分期、肿瘤数目、肿瘤直径、手术切除部位等一般资料差异均无统计学意义(均P>0.05)(表3)。
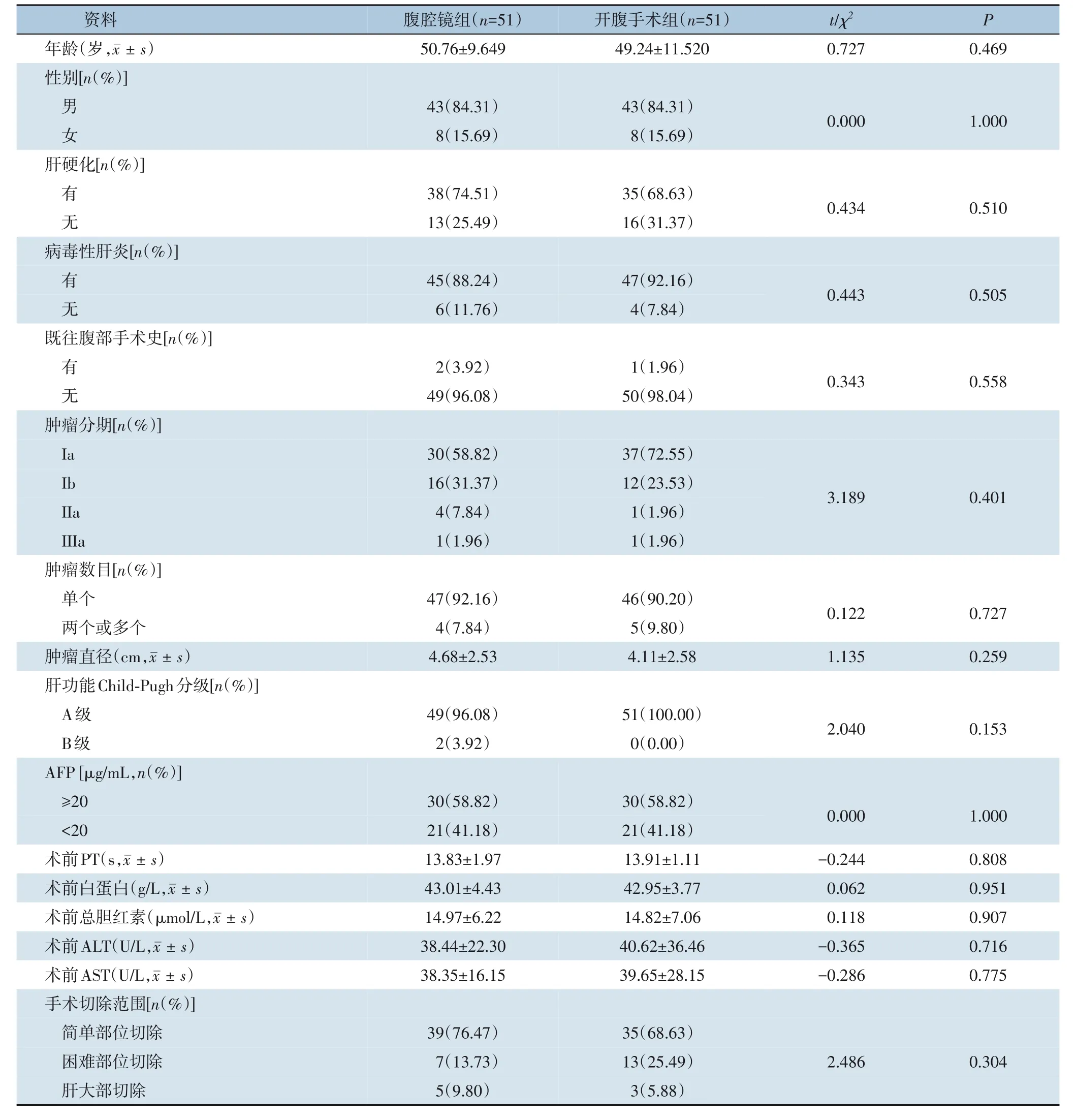
表3 PSM后腹腔镜组与开腹手术组患者一般资料Table 3 General information of patients in the laparoscopic and open groups after PSM
2.6 PSM后腹腔镜组与开腹手术组围手术期情况
PSM 后,两组患者的手术时间、术中出血量、肿瘤分化程度及肿瘤是否侵犯微血管均差异无统计学意义(均P>0.05),但腹腔镜组术后住院时间明显短于开腹手术组[6(5~8)dvs.9(8~11)d,P<0.01];两组患者术后肝功能指标(血清总胆红素水平、白蛋白水平、ALT 水平、AST 水平、PT)无明显统计学差异(均P>0.05);在术后并发症发生率方面,腹腔镜组明显低于开腹手术组[3.92%(2/51)vs.19.61%(10/51),P<0.05]。两组患者围手术期均无死亡情况。根据Clavien-Dindo 分级标准,腹腔镜组中出现Ⅱ级并发症1 例,Ⅲ级并发症1 例,Ⅳ级并发症0 例,开腹手术组中出现Ⅱ级并发症6 例,Ⅲ级并发症4 例,Ⅳ级并发症0 例,经秩和检验,两组患者并发症严重程度差异无统计学意义(Z=-0.251,P=0.802)(表4)。

表4 PSM后腹腔镜组与开腹组患者围手术期资料Table 4 Perioperative conditions of patients in the laparoscopic and open groups afterPSM
2.7 PSM后腹腔镜组与开腹手术组随访结果
PSM 后,经Kaplan-Meier 生存分析,两组的OS和DFS 差异无统计学意义(OS:χ2=0.262,P=0.602;DFS:χ2=0.646,P=0.422)(图3)。腹腔镜组患者的第1、 3、 5 年OS 率分别为95.92%、71.43%、 61.22%, 第1、 3、 5 年DFS 率分别为83.67%、59.18%、51.02%;开腹手术组患者的第1、3、5 年OS 率分别为80.00%、66.67%、62.22%,第1、3、5 年DFS 率分别为64.44%、51.11%、40.00%。
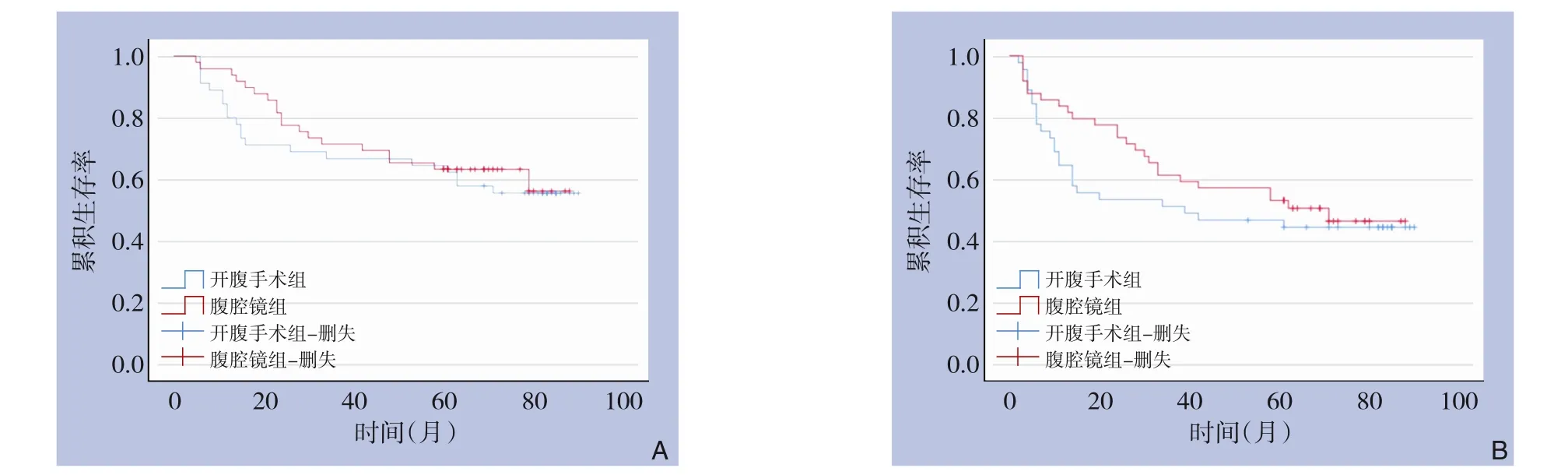
图3 PSM后腹腔镜组与开腹手术组患者术后生存曲线 A:OS;B:DFSFigure 3 Postoperative survival curves for patients in the laparoscopic group and open surgery group after PSM A: OS;B: DFS
3 讨 论
原发性肝癌是全球第六大最常见的恶性肿瘤和第三大癌症相关死亡的原因[11]。在我国,原发性肝癌是第四位常见恶性肿瘤及第二位肿瘤致死原因[12-13]。原发性肝癌包括HCC 和肝内胆管癌,以及其他罕见类型。其中HCC 占原发性肝癌的绝大多数(占病例的75%~85%)。时至今日,对于HCC 的治疗有手术治疗、消融治疗、介入治疗以及放化疗等多种治疗方式,但以根治性肝切除术为主的外科治疗仍是HCC 患者获得长期生存最主要的手段[13-14]。近年来,微创外科技术飞速发展,截至2017 年,中国腹腔镜肝切除术约为4 500 例,60%为肝脏恶性肿瘤手术,其中77%为HCC 的治疗[15]。腹腔镜的广泛使用逐步替代了传统的开腹手术,目前腹腔镜肝切除术已逐渐成为肝切除的标准术式[15-16]。尽管在HCC 治疗方式上,越来越多的外科医师采用腹腔镜肝切除术治疗HCC,但对于特殊部位、肿瘤直径较大的HCC 在应用腹腔镜时仍是一项具有挑战性的技术,且其远期疗效及安全性仍有待进一步确定,需要更多医学中心的证据支持[17-18]。通过本研究PSM 后的随访结果显示,腹腔镜肝切除术与开腹肝切除术治疗HCC 患者有着相同的远期疗效,两组患者术后OS 和DFS差异均无统计学意义,这进一步证明了腹腔镜肝切除术治疗HCC 与开腹肝切除术相比同样是有效的,这与之前的研究结果一致[19-21]。
本研究结果中,对整体资料分析结果显示开腹手术组肿瘤直径要大于腹腔镜组(P<0.01),开腹手术组肿瘤分期也较腹腔镜组稍晚,表明在手术方式的选择上,肿瘤直径较大及肿瘤分期较晚的HCC 更倾向于行开腹肝切除术;并且结果显示位于困难部位的HCC 或需行肝大部切除的HCC 同样也倾向于行开腹肝切除术,这说明外科医师在手术方式的选择上,对患者有着明显的选择偏倚。这与外科医生掌握的腹腔镜技术有关,也与腹腔镜技术本身的局限性有关,在欧洲腹腔镜肝手术指南[22]指出,腹腔镜肝切除术是一项复杂的手术技能,具有陡峭的学习曲线,必须逐步掌握,从切除简单部位肝切除及小肿瘤开始;《腹腔镜肝切除术治疗肝细胞癌中国专家共识(2020 版)》[23]也指出:开展腹腔镜肝切除术治疗肝癌需要满足技术储备和难度系数的要求,在保证患者安全的前提下,充分评估手术难度,循序渐进地由有经验的医师进行。腹腔镜肝切除术的复杂性可归因于多种因素,其中主要包括肿瘤位置和直径、肝切除范围等[24-25]。因此,对于腹腔镜肝切除术初学者更倾向于小肿瘤和简单部位的肝切除,且本研究中心开展腹腔镜肝切除术相对较晚,这解释了为何本研究结果中PSM 前开腹手术组肿瘤直径大于腹腔镜组,肿瘤分期稍晚于腹腔镜组,且肝切除部位也较腹腔镜组复杂。
通过对PSM 后资料进一步分析显示,腹腔镜肝切除术相比开腹肝切除术术后并发症更少和术后住院时间也更短。究其原因,腹腔镜肝切除术具有更小的切口,能够明显减轻术后疼痛,使患者愿意更早下床活动,减少了呼吸系统并发症的发生,并减少了患者发生双下肢深静脉血栓及肺栓塞的风险,同时可促进肠道蠕动,使患者尽快恢复正常饮食,缩短患者术后住院时间。同时对于有肝硬化或门静脉高压的HCC 患者,常规开腹肝切除术后常出现顽固性腹水,而腹腔镜肝切除术避免了腹壁上的大切口并减少了对肝周韧带的游离,有效保留了腹壁周围和肝周韧带的侧支循环及淋巴回流,进而可能降低顽固性腹水和肝切除术后肝衰竭的发生率[26-27]。在肝切除术中,手术部位感染(surgical site infection,SSI)是术后的主要并发症之一,肝切除术后SSI 的发生率为3.1%~25.2%[28-29],且开腹肝切除术患者SSI 发生率要高于腹腔镜手术者[26],这可能与手术切口的大小有关,在开腹肝切除手术过程中,腹壁切口常大范围暴露于空气中,相对处于干燥状态,这可能会降低腹壁抗感染的能力。此外腹腔镜手术的另一优势是,与开腹手术相比,在接受腹腔镜肝切除术的患者中,腹腔内粘连会减少,这可能对临床过程中出现HCC 复发需要重复肝切除术的患者更有益[30]。
任何腹腔镜手术都存在中转开腹可能,腹腔镜肝切除术同样如此,在本研究中,一共有40 例中转开腹患者,主要原因有:腹腔镜下难以控制的大出血(9 例,占22.5%)、肿块位于困难位置,腹腔镜下难以分离且无法保证足够安全的切缘(9 例,占22.5%)、肝硬化严重,且靠近肝脏主要大血管(5 例,12.5%)等。分析其根本原因可能与肿瘤位置、肿瘤直径、肝硬化程度以及术者操作水平有关[22]。肝脏的I 段(尾状叶)、Ⅳa、Ⅶ和Ⅷ段因其位置较深、解剖关系复杂一直被认为是腹腔镜肝切除术的难点,特别是对于位于肝脏裸区的肿瘤,腹腔镜手术更加困难,该区域的解剖结构较为复杂,肝蒂和肝静脉的分支交错,这些解剖特点容易迫使腹腔镜手术转为开腹。Sandri等[31]根据肿瘤位置将患者分为位于有利位置(Ⅱ、Ⅲ、Ⅳb、Ⅴ、Ⅵ段) 的第1 组和位于不利位置(Ⅰ、Ⅳa、Ⅶ、Ⅷ段)的第2 组,研究结果显示,第1 组中转开腹率(5.1%)要明显低于第2 组的中转开腹率(21.6%),证明中转开腹率与肿瘤位置有关。一项国际大型研究[32](n=3 008)根据肿瘤直径将肿瘤分为三组(≤5 cm,5~10 cm 和>10 cm),结果表明随着肿瘤直径的增加(从≤5 cm 到5~10 cm再到>10 cm),中转开腹率(从11.2%增加到14.7%再到23.0%) 随之显著增加,说明中转开腹率与肿瘤直径相关。在本研究中,中转开腹的肿瘤常>10 cm 或明显突出于肝脏表面,可能有以下原因:⑴ 肿瘤较大,腹腔镜下难以保证足够安全的切缘;⑵ 肿瘤占据了腹腔内大量的空间,外科医生没有足够的空间来进行手术,强行分离肿瘤可能导致肿瘤破裂、肿瘤细胞脱落。腹腔镜中转开腹与肝硬化也有相关,研究[33]表明,肝硬化患者的中转开腹率为11.1%,而非肝硬化患者的中转开腹率为7.3%。此外,腹腔镜中转开腹率还与外科医师的操作水平密切相关,腹腔镜肝切除术有着显著的学习曲线,学习曲线陡峭,Michael 等[34]比较了3 个不同时期的腹腔镜肝切除手术资料,结果显示,随着学习曲线的上移、腹腔镜肝切除术数量的增加,腹腔镜中转开腹率由最初的16%降到了3%。一些学者[35]认为,至少需要大约60 例腹腔镜肝切除术才能显著降低中转开腹风险,以此克服学习曲线带来的困扰。
尽管目前腹腔镜肝切除术其适应证和禁忌证原则上与开腹手术类似,但是仍然建议根据肿瘤大小、肿瘤部位、肿瘤数目、合并肝脏基础疾病以及手术团队的技术水平等综合评估、谨慎开展[36]。根据笔者手术团队的经验认为,以下情况可能不宜行腹腔镜肝切除术:⑴ 肿瘤直径超过10 cm 或明显突出于肝脏表面,在腹腔镜下肿块占据大量空间,导致没有足够的空间进行手术,强行分离肿块有可能导致肿瘤破裂、肿瘤细胞脱落者;⑵ 术前评估考虑肿瘤表面张力过高,术中过度搬动有肿瘤破裂风险者;⑶ 重度肝硬化患者,既要保证足够的安全切缘同时需要尽量保留多的残余肝;⑷ 肿瘤紧邻重要肝蒂及静脉或合并门静脉及肝静脉癌栓;⑸ 术前提示肿瘤已破裂的患者。同时,笔者手术团队认为,对于解剖肝尾状叶,腹腔镜手术相比开腹手术可能更有优势,原因如下:⑴ 腹腔镜下对第三肝门的显露较开腹手术更充分;⑵ 腹腔镜下可以沿足侧入路解剖尾状叶,此时相比开腹手术腹腔镜术野更清晰,且由于放大作用,更能很好地处理肝短静脉;⑶ 肝尾状叶位置较深,腹腔镜下较开腹手术有更充足的手术操作空间。已有回顾性研究[37]表明在两者手术时间和术后并发症发生率无明显差异情况下,腹腔镜肝尾状叶切除术治疗肝肿瘤术中失血量明显少于开腹手术,且腹腔镜肝尾状叶切除术术后恢复更快,有着更短的住院时间。但目前尚缺乏腹腔镜肝尾状叶切除术和开腹肝尾状叶切除术治疗HCC 患者临床疗效的比较。
在本研究结果中,PSM 前,腹腔镜组OS 及DFS 均优于开腹手术组,这可能与两组的肿瘤分期及肿瘤直径差异有关,有研究[38-39]表明,肿瘤分期与肿瘤直径是HCC 切除术后复发的危险因素。在进行PSM 排除这些因素的影响后,腹腔镜组与开腹手术组的OS 及DFS 明显差异,且两组的肿瘤分化程度及肿瘤是否侵犯微血管也均无明显差异,这说明PSM 后两组患者的长期预后结果是具有可比性且结果是可靠的。关于腹腔镜肝切除术治疗HCC 的长期肿瘤学结局证据仍在积累中,一项Meta 分析[40]报告表明,腹腔镜肝切除术可显著降低术后并发症,同时与开腹手术有着相当的长期生存率,这与本研究结果相符。这也表明在充分掌握其适应证的情况下,腹腔镜肝切除术治疗HCC 是一项安全、疗效可靠的方法。
综上,腹腔镜肝切除术治疗HCC 是安全、有效的,并可加快患者术后恢复,缩短术后住院时间。腹腔镜肝切除术和开腹肝切除术治疗HCC 的远期疗效相当。腹腔镜有其自身的适应证,在充分评估患者后,腹腔镜手术应是HCC 患者的首选手术方式。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:李军负责实施研究、起草文章、采集数据;姚磊、胡芳远、肖莫延负责实施研究、采集数据;叶轲负责设计指导研究;张鸽文负责设计指导研究,对文章专业性内容作批评性审阅。
