白芍及白芍总苷治疗自身免疫性皮肤病的作用及机制研究进展
2024-03-14陈睿轩马致洁梅雪岭
杨 阳 陈睿轩 闵 力 马致洁 梅雪岭
(1.首都医科大学附属北京友谊医院教育处,北京 100050;2.山西医科大学药学院,太原 030001;3.首都医科大学附属北京友谊医院消化内科,北京 100050;4.首都医科大学附属北京友谊医院药学部,北京 100050;5.首都医科大学附属北京友谊医院皮肤性病科,北京 100050)
白芍为毛茛科植物芍药的干燥根。性味苦、酸,微寒,归肝、脾经,具有养血调经,敛阴止汗,柔肝止痛,平抑肝阳的功能,临床多用于血虚萎黄、月经不调、自汗、盗汗、头痛眩晕、胁痛、腹痛、四肢挛痛等。白芍总苷(total glucosides of paeony,TGP)是从白芍的干燥根中提取,包括芍药苷、白花苷、芍药花苷、羟基芍药苷、芍药内酯苷、苯甲酰芍药苷、羟苯甲酰芍药苷、芍药酮、乳花苷、没食子芍药苷和丹皮酚等单体成分,具有抗炎、保肝、镇痛、养血等作用。
皮肤病是人类疾病的第四大常见疾病,影响几近全世界三分之一的人口[1-2]。据统计,中国皮肤疾病标化患病率为27.3%,且呈逐年增加趋势,其致健康寿命损失年在所有疾病中位列第四[3]。在皮肤病领域中,相当一部分与自身免疫有关,包括银屑病、系统性红斑狼疮(systemic lupus erythematosus,SLE)、湿疹等,发病过程涉及多种炎症细胞和炎症介质激活[4]。中医治疗皮肤病具有悠久历史,特别是在顽固性、慢性皮肤病的治疗中收效显著[5]。白芍及其提取物TGP作为一种免疫调节剂,是临床上首个用于治疗类风湿关节炎的抗炎免疫药物[6],能调节机体的细胞免疫及体液免疫,抑制自身免疫反应。使用白芍治疗是近年来皮肤病治疗领域的热点,本文拟对白芍及TGP在自身免疫性皮肤病治疗中的研究成果及作用机制进行综述。
1 白芍的用药史
芍药为芍药属植物,是现代常用的中药之一,分赤芍和白芍两种。芍药历史悠久,药用首载于春秋时期的著作《五十二病方》,治疗乌喙中毒。《神农本草经》首次记述芍药四性五味及功效主治,《本草经集注》将其分为白芍和赤芍,《开宝本草》《太平圣仁方》和《滇南本草》等将白芍与赤芍从性质、炮制、入经和功效等方面分别记载,以资区别。目前大部分中医专著中将白芍和赤芍分别立项论述,对各自功效主治记述较为详尽。历代本草和医籍中以白芍为君药的古方数以百计,例如桂枝汤、黄芩汤和炙甘草汤等[7-9],长于补阴养血功效。白芍为治肝之品,肝虚、肝郁、肝逆、肝火、肝寒、肝湿热等证皆可配伍他药而治之,王保军[10]通过数学算法发现,白芍配伍中药的核心组方为:白芍-甘草-延胡索、白芍-当归-熟地黄和白芍-当归-川芎。
2 白芍的来源、化学成分及功效
白芍多来源于栽培的芍药根,按顺序去皮、水煮和干燥炮制加工后入药,现代炮制品主要有酒白芍、炒白芍、麸炒白芍等[11]。白芍药饮片特征常见表面灰白色或浅棕红色、光滑、质地致密、不易折断,形成层环明显,射线放射状,目前可根据炮制方法、野生或栽培来源、原植物、花色、品种、芍药苷含量等方面进行白芍鉴别[12]。研究人员使用高速超高效液相色谱和飞行时间质谱等先进仪器来测量白芍的化学成分,检测出40种以上组分,包括29种单萜糖苷、8种没食子酰葡萄糖和3种不同的酚类化合物,其中主要的 生物活性成分包括萜类化合物、黄酮类和挥发油等[13]。
白芍属于补血药范畴,性微寒,味苦、酸,具有养血调经、敛阴止汗、疏肝止痛、镇静、抑制肝阳等功效[14]。白芍“养血柔肝,缓急止痛。用于头痛眩晕、胸胁疼痛、胃肠痉挛性疼痛、泻痢腹痛、月经不调、痛经、崩漏等”,近年来研究[15]显示,白芍具有明显镇痛作用,参与调节机体的体液免疫、细胞免疫及细胞吞噬功能,且其提取物能对实验动物急性炎症发挥抗炎作用。
3 白芍的药理作用及机制研究进展
现代药理学研究[15]表明白芍主要有抗炎、保肝、镇痛、养血等药理作用,其中发挥主要生理活性的物质为单萜糖苷类化学成分——TGP,其中以芍药苷含量最高,约占3%,此外还包括氧化芍药苷、芍药内酯苷、苯甲酰芍药苷和没食子酰芍药苷等,其作用机制主要有调节免疫细胞、促炎因子、抗体产生和抗氧化等(图1)。
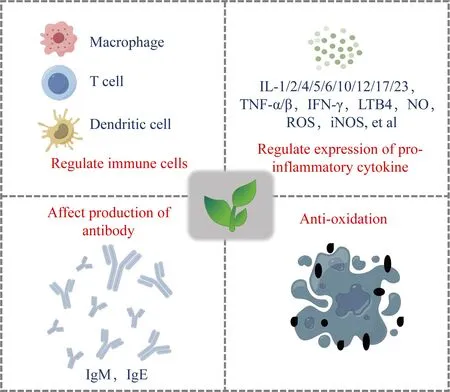
图1 白芍/白芍总苷的药理作用机制
3.1 抗炎作用
白芍及TGP临床用于治疗多种炎症相关疾病,如类风湿性关节炎、胃炎和肝炎等。TGP能改善急性或亚急性炎症动物模型的炎症反应,例如二甲苯诱导小鼠耳肿胀、角叉菜胶诱导大鼠足水肿和皮下异物肉芽肿等[16-17]。Wang等[18]发现TGP通过下调炎性因子白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达水平抑制大鼠模型的炎症反应。前列腺素和白三烯B4在急性炎症反应中发挥着重要作用,TGP以剂量依赖性方式抑制巨噬细胞产生白三烯B4,同时抑制A23187刺激巨噬细胞后产生的前列腺素,进而抑制炎症[19]。炎症通过产生活性氧和一氧化氮(nitric oxide,NO)等氧化剂来诱发氧化应激,TGP显著抑制脂多糖诱导的大鼠腹膜巨噬细胞中NO的产生并诱导型一氧化氮合酶的表达[20]。此外,较高浓度TGP抑制脂多糖(lipopolysacharide,LPS)刺激的巨噬细胞产生活性氧,但较低浓度的TGP会以剂量依赖性方式增强活性氧的产生[21]。体内研究[22]表明,TGP和芍药苷均能有效抑制IgE-抗原复合物诱导的皮肤过敏反应和化合物48/80诱导的小鼠抓挠行为。芍药苷抑制LPS刺激的TNF-α和IL-1β的释放,并促进LPS诱导分泌IL-10[23]。曾松等[24]的研究显示,白芍七物颗粒可降低大鼠模型血小板计数和血清NO含量,提高血小板平均体积,进而达到抗炎作用。王双等[25]及王晓燕等[26]发现白芍水提物具有一定的抗炎作用,其抗炎机制可能与减少血液和局部组织前列腺素E2(prostaglandin E2,PEG2)水平,进而减少局部组织NO含量有关。研究[27-28]表明,芍药苷可通过树突状细胞抑制T细胞和B细胞的增殖发挥免疫抑制和调节作用。MAPK信号通路在炎症过程中起着至关重要的作用,研究[23,29]显示,TGP抑制HaCaT细胞中核转录因子κB(nuclear factor-κB,NF-κB)抑制因子αIκBα和NF-κB p65亚基磷酸化,抑制p65核转位,进而抑制MAPK信号通路激活。
3.2 免疫调节作用
TGP对淋巴细胞增殖和凋亡有双重调节作用。体外实验中,TGP对刀豆球蛋白A诱导的小鼠脾细胞增殖具有双重作用,即低浓度TGP促进增殖,但高浓度时呈剂量依赖性抑制其增殖[30-32]。此外,TGP促进辅助性T细胞(helper T cell,Th)和抑制性T细胞(suppressor T cell,Ts)的分化,并逆转环孢素A对Th分化的抑制作用和左旋咪唑对Ts分化的抑制作用。高浓度TGP通过下调Th/Ts比值和血清TNF-α浓度抑制免疫激活小鼠的迟发型超敏反应,低浓度TGP则上调Th/Ts比率增强免疫抑制小鼠的迟发型超敏反应[33-34]。此外,芍药苷通过氧化还原相关机制诱导小鼠T淋巴细胞和Jurkat细胞(人T淋巴细胞白血病细胞)凋亡[35]。树突状细胞在免疫初始阶段发挥着关键作用,TGP可以选择性阻断TLR4/5的激活,从而抑制树突状细胞的成熟,从而减少体内免疫介导的反应[36]。以上研究表明TGP可能通过抑制淋巴细胞增殖、平衡Th和Ts细胞的分化以及诱导淋巴细胞凋亡抑制过度激活的免疫反应。
TGP对促炎细胞因子产生双重影响。在体外实验中,TGP对IL-1和IL-2发挥双重调控作用[37],低浓度TGP增强LPS刺激小鼠脾细胞或巨噬细胞产生IL-1,高浓度下呈现剂量依赖性方式抑制IL-1分泌[38]。TGP处理后血清IL-6、IL-17和IL-23浓度降低,转化生长因子-β1(transforming growth factor-β1,TGF-β1)和Foxp3表达浓度升高[39]。TGP主要组分芍药苷显著下调促炎细胞因子IL-2的浓度,上调IL-4和TGF-β1的浓度[40]。TGP通过促进 TGF-β和IL-10的表达,上调外周Treg细胞和Treg细胞中的转录因子Foxp3[41],同时通过抑制Th17相关细胞因子及Th17特异性转录因子下调类维生素A相关孤儿核受体γ表达,进而抑制IL-6和IL-17分泌。亦有研究[42]表明,TGP抑制STAT1和STAT3磷酸化,机制可能与上调miR-124有关。此外,TGP选择性下调外周Th1细胞的产生和分泌Th1型细胞因子,如TGF-α、IL-12和干扰素-γ(interferon-γ,IFN-γ),具体机制与TGP下调T-bet相关[43]。
TGP对抗体产生双重影响。TGP对绵羊红细胞免疫的小鼠脾细胞产生IgM抗体具有双重作用,即低浓度TGP增强IgM抗体的产生,高浓度抑制IgM抗体的产生[1]。然而,研究[44]表明尽管TGP治疗改善大鼠后爪肿胀和关节炎评分,但患有胶原诱导性关节炎的大鼠体内Ⅱ型胶原抗体的浓度并未发生改变。
3.3 抗氧化作用
TGP具有抗氧化作用。Kim等[45]发现TGP保护暴露于H2O2诱导的氧化应激的大鼠皮质细胞的原代培养物。芍药苷通过抑制氧化应激和Ca2+超载,对PC12细胞中谷氨酸诱导的神经毒性发挥神经保护作用[46]。此外,体内研究[47]也证明了芍药苷对LPS诱导的肝炎症反应和糖尿病相关肾损伤产生抗氧化作用。
4 白芍在治疗皮肤病中的应用
4.1 特应性皮炎
特应性皮炎(atopic dermatitis,AD)又称异位性皮炎、特应性湿疹,是一种慢性、复发性、炎症性皮肤病,属中医“奶癣”“四弯风”等范畴。白芍及TGP在治疗AD的过程中主要起到抗炎和免疫调节作用。AD模型小鼠经TGP干预治疗后,其右耳皮损程度有所改善、抓挠次数显著降低,皮肤结构损伤与模型组相比明显减轻,炎性细胞和肥大细胞浸润减少,血清中IgE和IL-6的浓度降低[48]。刘斌等[49]发现TGP可能通过促进IFN-γ分泌,降低炎症因子IL-4、IL-5浓度以及抑制IgE表达,提示TGP能够通过抑制炎症反应,有效调节炎症因子,发挥抗AD作用。Lee等[50]的研究显示,白芍抑制IL-17A产生,诱导Foxp3的表达,并通过增加紧密连接蛋白-1(zonula occludens-1,ZO-1)和闭合蛋白等的表达来改善肠道屏障的完整性,通过增强肠道屏障完整性和改变肠道微生物群组成进而改善特应性皮炎症状。
4.2 慢性荨麻疹
慢性荨麻疹,即反复发作持续6周以上的荨麻疹,通常缺乏明确病因、长期持续且难以控制,荨麻疹产生扰乱患者睡眠的剧烈瘙痒,严重影响患者的日常生活和工作,损害患者生活质量。全天华等[51]用含白芍汤剂平胃消疹汤治疗30例慢性荨麻疹患者,患者治疗总有效率达93.33%。TGP联合西替利嗪治疗慢性荨麻疹疗效确切,复发率低,无明显不良反应,其治疗作用可能是通过调节患者的免疫功能来实现,因此需长期持续用药[52]。一项包含30项研究、共涉及2 973例参与者的Meta分析结果[53]表明,TGP作为辅助治疗可以为青少年和成人荨麻疹提供良好的疗效,不良事件轻微且可耐受。
4.3 银屑病
银屑病是一种慢性炎症性皮肤病,主要病理特征是角质形成细胞过度增殖、异常分化,并伴随皮肤炎症细胞浸润和血管生成异常。研究[54]表明,TGP通过抑制角质形成细胞增殖、新生血管生成以及免疫调节等作用,缓解治疗银屑病,不良反应较少,患者治疗依从性较高,与正常表皮细胞相比,银屑病患者皮损处角质形成细胞中血管内皮生长因子(vascular endothelial growth factor,VEGF)表达显著上调,通过诱导血管炎症反应导致银屑病样皮损和Koebner样银屑病损害。张苑等[55]的研究显示,TGP能够降低银屑病小鼠皮肤中VEGF mRNA表达,且TGP浓度为125 mg/L时,最大程度抑制HaCaT细胞分泌VEGF,减轻银屑病皮肤损伤并降低Baker评分,抑制角质形成细胞增殖。除皮肤中的角质形成细胞外,免疫细胞及其细胞因子在银屑病的发病机制中亦扮演了重要角色。一般认为,银屑病真皮中树突状细胞和巨噬细胞产生TNF-α、IL-23及IL-2等,诱导辅助T细胞分化为多个亚群,如Th17、Th22和Th1,通过分泌IL-17、IFN-γ和TNF-α等炎症细胞因子,作用于角质形成细胞,导致表皮角化过度、棘层肥厚等典型的银屑病病理改变[56]。研究[57]显示,TGP主要成分芍药苷能够抑制树突状细胞分化、成熟,这为TGP治疗免疫性疾病提供了理论基础。Zhao等[58]的研究显示,TGP通过下调p-STAT3/p-STAT1表达,抑制Th17细胞分化和Th1细胞募集,进而缓解银屑病样皮损的免疫反应。Sun等[59]发现芍药苷通过减少F4/80+CD68+巨噬细胞和CD11b+Gr-1+中性粒细胞数量,同时抑制巨噬细胞炎症蛋白2表达和细胞因子,如TNF-α、IL-1β、IL-6、IL-12和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的产生,缓解银屑病进展。
4.4 SLE
SLE是一种慢性自身免疫病,患者体内产生异常的自身抗体、补体和免疫复合物,常攻击多器官、多系统,皮肤损害较为常见。白芍作为风湿免疫科常用中药,临床疗效确切,不仅能明显改善SLE患者实验室指标,降低血清免疫因子水平,还能控制疾病活动,激活低表达免疫细胞,其发挥作用的具体物质基础和分子机制可能与直接调控Toll样受体(Toll-like receptors,TLRs)、Nod样受体(Nod-like receptors,NLRs)、NF-κB、TNF等信号通路有关[60]。TGP通过增强SLE患者CD4+T细胞中CD11a启动子的DNA甲基化来抑制CD11a基因表达。在TGP处理的SLE CD4+T细胞中,CD11a的mRNA和蛋白水平显著下调[61]。TGP诱导Treg细胞分化抑制SLE患者的自身免疫,具体机制为:TGP通过下调Foxp3启动子甲基化水平显著增加SLE CD4+T细胞中Foxp3的表达,进而增加Treg细胞的百分比和数量[62],导致SLE免疫抑制。另有一项Meta分析结果[63]显示,TGP联合常规治疗在降低SLE疾病活动度和不良反应发生率方面优于常规治疗。这些观察结果为理解TGP治疗SLE的机制提供了一些证据。
4.5 白癜风
白癜风是一种常见的获得性自身免疫性皮肤病,具有影响美观、病程呈慢性、顽固难治、易反复、药物治疗效果差且部分治疗药物不良反应较大等特点。至今为止,白癜风的病因及病理机制尚不确切。可能与遗传因素、神经精神因素、自身免疫因素和黑素细胞的自身破坏有关。Yuan等[64]报道芍药苷通过激活JNK/Nrf2/HO-1信号传导来改善H2O2诱导的黑素细胞氧化应激,提示TGP在白癜风方面具有潜在的治疗应用。另有一项研究[2],基于数据挖掘证明白芍和血镇痛作用强,用于治疗白癜风营血不足、血虚有瘀疼痛之证,常用方剂为桂枝汤加味、归芪治白汤、桃红四物汤加味。霍晶等[65]发现,白芍总苷胶囊联合308准分子激光能通过降低血清IL-17、IL-23浓度,进而缓解老年白癜风患者病情。白芍总苷联合祛白合剂治疗白癜风有一定疗效,其机制可能与上调白癜风患者CD4/CD8的比值,改善患者免疫状态有关[66]。
综上所述,白芍对多种皮肤病有一定改善作用,其机制主要涉及免疫调节、抗炎症和抗氧化等。白芍作为一种已在临床广泛应用的中药,对其单体化合物、主要活性成分或方剂治疗皮肤病作用及机制进行深入研究,可为皮肤病,特别是免疫性、炎症性皮肤病的治疗提供新思路。对白芍及TGP的深度探索、开发与利用,旧药新用、一药多用的实现,对治疗皮肤病、提高患者生活质量等具有重要意义。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明杨阳、陈睿轩:收集整理文献,撰写论文;闵力、马致洁:修改论文;梅雪岭:提出文章思路,总体把关,审定论文。
