不同干扰强度高原鼠兔对高寒草甸土壤温室气体通量变化的影响
2024-03-14王苏芹谈昭贤曲家鹏
李 婧 2, ,王苏芹 2, ,谈昭贤,4,曲家鹏 2,
(1.中国科学院西北高原生物研究所, 青海 西宁 810001;2.中国科学院大学, 北京 100049;3.青海省动物生态基因组学重点实验室, 青海 西宁 810001;4.青海师范大学, 青海 西宁 810001)
温室气体排放导致的气候变化已成为世界各国共同面对的严峻环境挑战,是全球变化生态学研究的热点问题[1],二氧化碳(CO2)、甲烷(CH4)和氧化亚氮(N2O)是最重要的3 种温室气体[2],在2021 年均 创 下 了 浓 度 新 高,分 别 为415.7 mg·L-1、1 908 μg·L-1和334.5 μg·L-1[3]。温室气体变化受到多种因素影响,如化石燃料开采增加CH4排放、化石燃料燃烧增加CO2和N2O 排放,影响全球气候变化[4]。同时,土壤温室气体通量变化与土壤微生物转化土壤有机质密切相关[5],受到土壤有机质含量、土壤湿度、土壤温度、土壤pH 等多种因素影响。
青藏高原在调节区域生态系统平衡中发挥着重要作用,该生态系统结构简单、功能脆弱[5],对气候变化的响应更为敏感[6]。高寒草甸是青藏高原的主要草地类型,占青藏高原草地总面积的53%[7],土壤富含有机质,极具温室气体排放潜能,使之成为温室气体排放的重要来源[8]。牛、羊等大型食草动物的活动直接或间接影响着温室气体排放[9]。研究表明,食草动物的活动会提高土壤微生物活性加速碳循环,从而促进CO2排放[10];家畜的排泄物限制氨氧化古菌生长,增加N2O 排放[11-12];家畜的踩踏及其排泄物还可以改变土壤容重和碳氮含量,增加与CH4通量相关的土壤微生物丰度,加强高寒草地对CH4的吸收作用[13]。
小型穴居食草动物是造成草地扰动的主要因素之一[14],它们通过刈割地上植物、掘洞及排泄等行为对温室气体通量产生影响[15]。高原鼠兔是青藏高原特有的小型穴居食草动物[16],是高寒草甸生态系统的关键种[17]。Zhou 等[18]研究发现,与无高原鼠兔干扰区域相比,高原鼠兔掘洞使得洞穴处N2O 排放量增加,CH4吸收增加。也有研究表明,高原鼠兔通过选择性采食改变植物地上、地下生物量,影响土壤有机质转化[19-20],排泄尿液和粪便改变土壤pH[21],掘洞改变土壤的透气性、温度、湿度等,对土壤的碳、氮循环产生影响[22-24]。土壤湿度变化是驱动CH4吸收速率改变的重要因素[25],土壤pH 会直接影响土壤CO2、CH4和N2O 通量[26]。孙飞达等[27]研究表明,高原鼠兔洞穴密度会对高寒草甸土壤理化性质产生广泛影响,土壤理化性质的改变直接影响土壤微生物活性,调节土壤有机质转化效率,间接影响土壤温室气体通量变化[28]。然而,不同干扰强度高原鼠兔是否影响高寒草甸土壤温室气体排放速率目前尚不清楚。本研究通过比较不同高原鼠兔密度下土壤温室气体通量差异,探究鼠兔干扰强度对高寒草甸温室气体通量的影响。
1 材料与方法
1.1 研究地区概况
样地位于中国科学院海北高寒草地生态系统国家野外科学观测研究站(海北站)附近。该站地处青藏高原东北隅,祁连山北支,冷龙岭东段南麓的大通河河谷(37°29′~37°45′ N,101°12′~101°23′ E)。此处属于典型的高原大陆性气候,夏季受到东南季风的影响,因祁连山阻隔使当地降水略多,冬季受到西伯利亚高压的影响,气候寒冷干燥,降水较少。无明显的四季之分,年平均气温-1.7 ℃,年均降水量约580 mm,其中80%分布于植物生长季的5月-9 月。试验期为2021 年9 月。试验样地为高寒矮嵩草草甸,主要优势植物有矮生嵩草(Kobresiahumilis)、异针茅(Stipa aliena)、麻花艽(Gentiana straminea)、美丽凤毛菊(Saussurea superba)等。该地区海拔约3 200 m,高原鼠兔是样地内唯一的小型穴居食草动物。
1.2 试验设计
试验采用随机区组设计,样地位于海北站以西约5 km 处。试验样地均设置在冬季牧场,以排除试验期内放牧干扰。野外试验设置3 个处理,4 次重复,共计12 个样区,每个样区面积为625 m2。根据高原鼠兔对高寒草甸植被及土壤理化性质的影响[27,29],高原鼠兔3 个处理水平,高密度组(H)、低密度组(L)和对照组(CK) 的平均有效洞口数分别为1 587、667 和41 个。每个样区中同时设置3 个50 cm ×50 cm 的调查样方,样方间隔约为20 m,12 个样区共计36 个样方。试验期内共进行3 次样品采集。
1.3 取样方法及测定指标
调查每个样方内的植被种类、总盖度、分盖度及高度。在植被样方调查后刈割样方内所有植物地上部分,带回实验室烘干称重记为植物地上生物量(aboveground biomass,AGB)。在收割地上生物量后采集土壤样本,每个样方中采用“V”型取土样3 钻(0-10 cm)并混合,去除肉眼可见的石块及昆虫,将土壤样品过2 mm 筛,土壤部分进行室内自然风干处理,用于理化性质测定。过筛后的根系经过漂洗、烘干后称重记为植物地下生物量(belowground biomass,BGB)。
土 壤 全 磷 (total phosphorus, TP)和 速 效 磷(available phosphorus,AP)含量采用钼锑抗分光度比色法测定,土壤全氮(total nitrogen,TN)含量采用凯氏定氮法测定,土壤硝态氮(NO3--N)含量采用双波段紫外比色法测定;土壤铵态氮(NH4+-N)含量采用氯化钾浸提-靛酚蓝比色法测定,土壤有机碳含量采用重铬酸钾外加热法测定。土壤含水量使用TDR便携式土壤水分测定仪(美国,Spectrum,型号:6440FS)测定,土壤温度使用便携式数字温度计(中国,今明,型号:JM624)测定,土壤pH 采用电位法(水土比2.5 ∶ 1)测定。以上测定方法参见文献[30]。
采用静态箱-气相色谱法测定温室气体通量。箱体为50 cm × 50 cm × 50 cm,箱体外用白色塑料泡沫包裹,箱体顶部装有直流风扇用于混合箱内气体样品。每天上午09:00-11:00、下午16:00-18:00进行气体样品采集,此时的通量能代表1 d 的平均通量[31],分别采集盖箱后0、10、20、30 min 时的气体样品,同时测量箱内温度。高寒草甸生长季主要表现为土壤温室气体CO2、N2O 的源及CH4的汇,9 月份植物生长末期出现温室气体通量的峰值[32-33]。因此,本研究中土壤温室气体通量测定选择在9 月份,每周测定1 次,共测定3 次。气体样品中CO2、CH4和N2O 的浓度采用岛津GC-2014C 气相色谱仪进行测定。CO2、CH4和N2O 的气相色谱分析参考王跃思和王迎红[34]的方法进行。
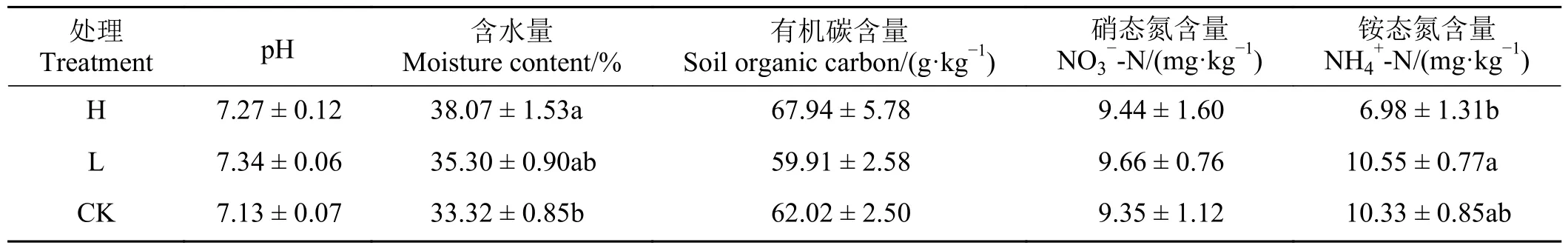
表1 不同处理间土壤理化性质差异Table 1 Differences in soil physicochemical properties between treatments
温室气体排放速率计算公式为:
式中:F为温室气体通量,为气体浓度梯度随时间线性回归的斜率,M为每种气体的分子质量,P为大气压力,T为采样时的温度,V0、T0、P0分别为标准条件下的气体摩尔体积、绝对空气温度和大气压力,H为采样时的密闭箱高度。
1.4 数据处理
经Shapiro-Wilk 检验,数据不符合正态分布,采用Kruskal-Wailis 检验比较处理间差异显著性。使用“nlme”程序包筛选与温室气体通量相关的环境因素,模型选择运用赤池信息量准则(akaike Information criterion,AIC),AIC 值越小,代表模型拟合越好,模型之间AIC 值的差值(ΔAIC) ≤ 2 时,认为模型为最优模型[35]。使用“RandomForest”程序包进行随机森林模型处理,进一步分析不同环境因素对温室气体通量影响的重要程度。所有统计分析均采用R 4.1.3 软件进行。
2 结果
2.1 不同处理土壤温室气体排放速率
高密度组样地CO2排放速率596.66 mg·(m2·h)-1,显著低于对照组的695.45 mg·(m2·h)-1(P< 0.05) (图1A)。高 密 度 组 样 地CH4吸 收 速 率 约-43.46 mg·(m2·h)-1,显 著 低 于 低 密 度 组 的4.92 mg·(m2·h)-1(P< 0.05)(图1B)。高密度组、低密度组样地的N2O 排放速率分别为8.03、-2.39 μg·(m2·h)-1,均显著高于对照组的-16.69 μg·(m2·h)-1(P< 0.05) (图1C)。

图1 不同处理间CO2 排放速率、CH4 吸收速率和N2O 排放速率Figure 1 CO2 emission rate, CH4 uptake rate, and N2O emission rate among different treatments
2.2 影响温室气体通量的因素
植物地上生物量与高寒草甸土壤温室气体排放速率受到土壤理化性质的影响(表1),高密度组样地土壤水含量显著高于对照组(P< 0.05),土壤NH4+-N 含量显著低于低密度组和(P< 0.05)。植物地上生物量受高原鼠兔平均有效洞口数影响,高密度组显著低于低密度组和对照组(P< 0.05) (图2A),植物地下生物量在不同处理间无显著差异(图2B)。由模型选择结果可知,高原鼠兔密度、植物地上生物量和土壤NO3--N、NH4+-N、pH 和含水量均影响温室气体排放速率。在影响温室气体排放速率的诸多因素中,高寒草甸CO2排放速率主要受到高原鼠兔密度、AGB、土壤pH 和含水量的影响(表2)。土壤NO3-N、NH4+-N、pH 和土壤含水量均影响高寒草甸CH4和N2O 排放速率(表3 和表4)。
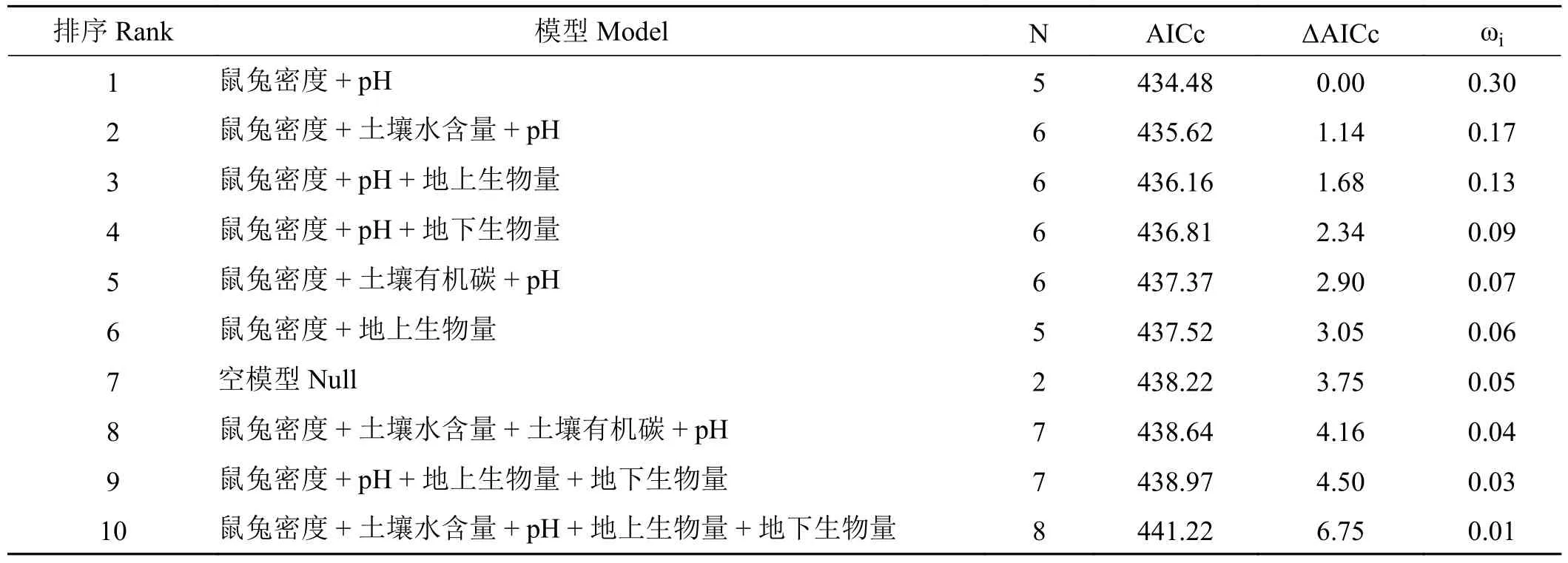
表2 CO2 排放速率与环境因子关系模型选择表Table 2 Model selection table for relationships between CO2 emission rate and environmental factors

表4 N2O 排放速率与环境因子关系模型选择表Table 4 Model selection table for relationships between N2O emission rate and environmental factors

图2 不同处理间植物地上生物量和植物地下生物量差异Figure 2 Differences in plant aboveground biomass and plant belowground biomass between treatments
随机森林模型结果表明,土壤含水量、pH、AGB 和高原鼠兔密度是对温室气体通量影响最大的4 个因素。其中,土壤含水量对高寒草甸CO2排放的影响最大,重要性指标IncMSE 为13.14%(图3A)。pH 对高寒草甸CO2排放的影响程度仅次于土壤含水量,其次为AGB 和高原鼠兔密度,重要性指标IncMSE 介于9.68%~12.97%。土壤NO3--N 是对高寒草甸CH4吸收速率影响最大的环境因素,IncMSE 为19.98%。其次是土壤NH4+-N,再次为土壤pH、高原鼠兔密度和土壤含水量,重要性指标IncMSE 介于13.38%~18.27% (图3B)。高原鼠兔密度是高寒草甸N2O 排放速率的主要影响因素,其重要性指标IncMSE 为18.76%,其次为土壤pH、NO3--N、NH4+-N 和含水量,其重要性指标IncMSE 介于10.96%~14.40% (图3C)。

图3 采用随机森林模型分析环境因素对CO2、CH4 和N2O 排放速率的相对重要性Figure 3 Random forest model to analyze the relative importance of environmental factors to CO2, CH4, and N2O emission rates
3 讨论与结论
草地生态系统作为我国最大的陆地生态系统,其面积约占陆地总面积的43.7%[36]。草地生态系统温室气体排放速率直接影响大气中温室气体含量[37]。已有研究表明,高寒草甸温室气体排放速率受地上植被-土壤微环境的耦合影响[38]。放牧是青藏高原草地生态系统的主要利用方式之一[39],大型食草动物啃食牧草影响植物生产力,对草地的踩踏也会影响土壤的物理性质(如土壤容重、土壤含水量)[40],其排泄物会改变土壤的化学成分[41]。植物的生产力与土壤环境因子关系密切[42]。植物生产力、土壤理化性质变化也会引起温室气体排放速率的改变[43]。除大型食草动物外,青藏高原栖息着多种小型食草动物,其中高原鼠兔作为青藏高原的关键种,因选择性采食、挖掘洞穴对高寒草甸植物和土壤呼吸产生广泛的干扰。高原鼠兔干扰强度的增加意味着选择性采食及挖掘行为的加强[44]。已有研究表明,高原鼠兔采食、掘洞及排泄行为引起土壤温度与湿度、植物生物量的变化,直接或间接影响温室气体排放速率[45]。本研究结果表明,不同干扰强度下,高寒草甸温室气体排放速率存在差异,CO2排放速率受到植物地上生物量、土壤pH 和含水量的影响,CH4吸收速率和N2O 排放速率受到土壤NO3--N、NH4+-N、pH 和含水量的影响。
3.1 不同高原鼠兔干扰强度对CO2 排放速率的影响
草地生态系统CO2排放量由植物呼吸和土壤呼吸两部分组成,其中土壤呼吸包括植物根呼吸、根系微生物呼吸及土壤微生物对土壤中有机质的分解作用[46]。本研究结果表明,高寒草甸CO2排放速率随着高原鼠兔干扰强度增加总体呈降低的趋势,高密度组样地CO2排放速率显著低于对照组(P<0.05),这种差异主要受到土壤含水量和pH、植物地上生物量及高原鼠兔密度的影响。在影响CO2排放速率的这些因素中,植物及微生物受土壤含水量的影响最大。土壤含水量随着高原鼠兔平均有效洞口数的增加发生明显变化[27]。高原鼠兔能够改变土壤理化性质及土壤好氧/厌氧环境,这些环境因素的改变直接影响土壤微生物活动,从而导致温室气体通量变化[47-48]。这与Zhao 等[45]的结论相一致,高原鼠兔挖掘洞穴直接影响土壤温度和微生物量,间接影响土壤含水量。已有研究发现,高原鼠兔扰动会影响植物呼吸和土壤呼吸。鼠兔掘洞将深层土壤带到地表并掩埋洞口附近植被,直接降低植物地上生物量[45,49-50],CO2排放中植物呼吸部分减少。同时,掩埋的植被由微生物分解利用,增加土壤碳输入,挖掘的洞穴使隧道表面土壤与空气接触面增大,土壤呼吸部分增强。高原鼠兔掘洞造成高寒草甸CO2排放减少或无显著变化,造成这种差异的原因可能是高原鼠兔的干扰对植物呼吸和土壤呼吸具有相反的影响[51]。本研究中,随着高原鼠兔干扰强度增加,高寒草甸退化加剧,植物地上生物量减少,植物呼吸减少量高于土壤呼吸增加量,可能是致使CO2排放整体下降的主要原因。
3.2 不同高原鼠兔干扰强度对CH4 排放速率的影响
高寒草甸通常是大气CH4的汇[12]。在厌氧环境中,CH4的排放主要由甲烷菌产生后扩散进入大气,而CH4的吸收主要发生在有氧环境中,大气中CH4被土壤中的甲烷氧化菌氧化吸收,其通量取决于产生量与吸收量的平衡[52]。本研究中,高原鼠兔低干扰强度下CH4吸收速率无明显变化,随着干扰强度的增加,高寒草甸CH4汇的作用增强,高密度组样地CH4吸收速率显著高于低密度组(P< 0.05),但与对照组无显著差异(P> 0.05)。随机森林分析结果表明,CH4吸收速率受到高原鼠兔密度、土壤NO3-N、NH4+-N、pH 和含水量的影响。高原鼠兔干扰强度的增加使得土壤通气性发生变化,有利于CH4的吸收和氧化[18],这与本研究中高密度组CH4吸收速率显著高于低密度组的结果相一致。高寒草甸CH4的吸收与排放过程受到土壤微生物活性的影响。已有研究表明,NH4+对甲烷氧化菌有抑制作用[53],抑制土壤对CH4的吸收能力[54]。高密度组土壤NH4+-N 含量显著低于低密度组(P< 0.01),在NH4+的抑制作用下,低密度组样地CH4吸收速率明显低于高密度组。同时,这可能与反硝化型甲烷厌氧菌的氧化作用有关[55]。Li 等[56]指出土壤pH 直接影响产甲烷菌和甲烷氧化菌的活性,间接改变了CH4吸收速率。Zhou 等[18]指出高原鼠兔会通过挖掘洞穴来改变土壤含水量,影响CH4吸收速率。有研究表明,干旱地区的土壤微生物活性受到抑制,一定程度上CH4的吸收随着土壤含水量的升高而增加[57]。本研究中,虽然高密度组土壤水含量与低密度组无显著差异,但总体上前者明显高于后者且接近显著性水平,导致高密度组样地CH4的吸收速率显著高于低密度组(P< 0.05)。
3.3 不同高原鼠兔干扰强度对N2O 排放速率的影响
草地土壤通常是N2O 的源,其通量变化受到硝化细菌、反硝化细菌活性的影响[12]。本研究中,高密度组样地N2O 源的作用显著强于对照组,同时低密度组样地N2O的排放速率显著高于对照组。由随机森林分析结果可知,高寒草甸N2O 排放速率受到高原鼠兔密度、土壤pH、NO3--N、NH4+-N 和含水量的影响。研究结果表明,随着高原鼠兔干扰强度的增加,高寒草甸土壤N2O 排放速率随之增加,这与Zhou 等[18]的研究结果一致[18],这可能是由于高原鼠兔干扰使得土壤透气性改变,N2O 排放速率也随之呈现出增加的趋势。同时,关于在德国南部山地草地田鼠扰动的一项研究也指出,当田鼠扰动强度大时,该区域土壤氮周转循环受到干扰,使得N2O 排放增加[15]。植物生长过程中吸收土壤中的氮素[56],这可能导致生成N2O 的底物减少,影响N2O 的排放。高原鼠兔的选择性取食和掘洞显著降低了植物地上、地下生物量,因此随着鼠兔干扰强度增加,植物对氮素的吸收减少,使N2O 排放呈增加的趋势。已有研究证明,土壤pH 是土壤中N2O 的吸收与排放的主要因素[58],土壤pH 的改变直接影响参与硝化、反硝化过程的酶活性产生。高原鼠兔干扰强度的增加使得土壤透气性增加[39],与N2O 排放密切相关的NO3--N、NH4+-N 可用性随之增加,从而向大气释放更多N2O。高强度的高原鼠兔干扰会降低土壤含水量[59],后者是影响N2O 排放速率的重要指标,这可能是因为硝化和反硝化细菌对土壤湿度非常敏感[60],间接影响了N2O 的释放速率。本研究中随着高原鼠兔干扰强度的增加,高寒草甸由N2O 汇转变为源。这可能是因为反硝化作用的增强消耗了更多的N2O 生成N2,当土壤中N2O 的还原量超过产生量时就会表现出土壤对N2O 的吸收[61]。
综上所述,高原鼠兔不同干扰强度对高寒草甸CO2、CH4和N2O 的排放速率和吸收速率产生了显著影响。高原鼠兔干扰强度的增加,使高寒草甸的CO2排放速率降低,CH4吸收速率增强,N2O 从汇转变为弱源。在今后探究小型食草动物对草地温室气体通量的影响时应考虑其干扰强度的因素。
