Zn 胁迫下玉蝉花的耐性和富集转运
2024-03-14于雪泽郭王子杰
于雪泽,郭王子杰,宋 红
(东北林业大学园林学院, 黑龙江 哈尔滨 150040)
随着重工业的大力发展,土壤重金属污染也日益严重。我国《全国土壤污染状况调查公报》[1]显示,全国土壤超标率达到16.1%,锌点位超标率为0.9%,耕地土壤环境质量堪忧,工矿业废弃地土壤环境问题突出。锌(Zinc,Zn)作为植物生长发育过程必需的微量元素之一,在生长激素、碳酸酐酶、叶绿素、RNA 聚合酶等物质合成的过程中发挥着重要作用[2],少量存在时可以促进植物生长,一旦大量积累就会产生毒害。研究发现,植物可以通过渗透调节物质以及启动抗氧化酶系统来适应逆境[3]。八仙花[4](Hydrangea macrophylla)在1 200 mg·kg-1七 水硫酸锌胁迫处理下,通过上调超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(catalase,CAT)活性,有效地清除活性氧来缓解过量Zn 对植物体的伤害,以应对Zn 胁迫。植物具有监测环境潜在污染物并富集吸收的能力,目前,植物修复技术是被认为最有效、最安全、最有发展前景的重金属土壤污染的修复治理方法,而观赏植物因美观性较强、居民接受度较高,更具有植物修复的潜力[5]。
玉蝉花(Iris ensata)又名紫花鸢尾、东北鸢尾,是多年生草本植物,以黑龙江、辽宁和吉林东三省为主要分布地区,耐寒性强。花深紫色,色彩典雅,雍容华贵,是极好的园林景观应用花卉植物,具有广阔的应用前景。目前对于玉蝉花的研究大多是种质资源保存利用、切花保鲜、水晶花制作和组织扩繁体系等。在重金属抗性方面,刘欢等[6]、薄伟等[7]丰富了玉蝉在铜镉、铅胁迫下的研究。但玉蝉在Zn 胁迫下的研究鲜有报道。为此,本研究采用基质栽培法,探究玉蝉花在Zn 胁迫下的生理生化变化和富集特征,为玉蝉花在不同含量Zn 污染的土壤上栽培提供科学依据。
1 材料与方法
1.1 试验材料
参试材料为玉蝉花种子,采集于东北林业大学校园内。
试验使用的基质为草炭土和珍珠岩(V ∶ V = 4 ∶ 1),土壤pH 5.2,全氮含量0.664%,有效磷含量56.4 mg·kg-1,速 效 钾 含 量101 mg·kg-1,锌 含 量390.9 mg·kg-1,镍含量11.2 mg·kg-1。供试金属离子以分析纯的ZnSO4·7H2O 添加;设置5 个Zn 处理浓度(0、200、500、1 000、2 000 mg·kg-1,相应编号为CK、Zn200、Zn500、Zn1000、Zn2000),以去离子水溶液为对照,每个处理设5 个重复。容器为塑料花盆(上直径33 cm,下直径28.5 cm,高21 cm),含1 kg 培育基质(CK 为无污染基质),底部套塑料袋防止溶液流出。按照浓度配制重金属溶液,喷入培育基质中,拌匀,平衡50 d后备用。
1.2 指标测定及方法
试验于2022 年3 月-9 月在东北林业大学园林学院试验温室和园林学院实验室内进行。选取籽粒饱满、无病虫害的玉蝉种子在40 ℃温水下浸泡24 h 后,用0.5%的高锰酸钾溶液消毒10 min,去离子水冲洗3 遍,吸干水分,放置在铺有去离子水浸湿的滤纸的培养皿中,置于光照培养箱中。待种子露白后,播种至穴盘培养40 d,选取长势一致、生长健壮的幼苗带土坨移栽至平衡后的土壤中,定期浇水使土壤的田间持水量保持在60%~70%。胁迫40 d后,测定各指标。
形态指标和生物量的测定:采用完全收获法,随机选取各处理的幼苗使用卷尺测量株高(从根茎处至最长的叶片叶尖的距离)、根长(从根茎处至最长的根根尖处的距离)、叶宽(最长叶的宽度),使用LI-3000A 叶面积仪测量叶面积(最长叶的叶面积);将采集的植物分为地上部分和地下部分,置于70 ℃烘箱中烘干至恒重后,用分析天平测量干质量。烘干后的植物粉碎过筛,参考孙延东等[8]的方法,采用HNO3-HClO4法进行消解后使用电感耦合等离子体发射光谱仪(ICP-OES)测定植物体内锌含量。参考黄晓辰[9]、王雨琦[10]、唐敏等[11]的方法,采用差速离心法进行Zn 亚细胞组分测定。
随机选取幼苗新鲜叶片,测定生理生化指标。采用乙醇提取法[12]测定叶绿素含量,参照陈爱葵等[13]方法测定相对电导率,硫代巴比妥酸显色法[12]测定丙二醛(malondialdehyde,MDA)含量,氮蓝四唑法[12]测定SOD 活性。POD、CAT 活性采用苏州梦犀生物医药科技有限公司试剂盒测定。在晴天上午09:00-11:00 采 用LI-6400XT 光 合 仪(LI-COR,美国)测定叶片的净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓 度(intercellular CO2concentration,Ci)、蒸 腾 速 率(transpiration rate,Tr),以光合仪内置照明为可变光源,设 置 光 强1 000 μmol·(m2·s)-1,仪 器 流 速500 μmol·s-1,外接二氧化碳缓冲瓶,二氧化碳浓度与外界保持一致(450~500 μmol·mol-1),温度为28 ℃。
1.3 数据分析
采用SPSS 25.0 软件进行数据处理和分析,对不同浓度胁迫处理进行单因素方差分析,并用Duncan法对数据进行多重比较。采用Origin 2021 绘制图表。
2 结果与分析
2.1 Zn 胁迫对玉蝉花生长的影响
2.1.1 Zn 胁迫对玉蝉花生物量和根冠比的影响
随着胁迫浓度增加,玉蝉花的地下部分、地上部分生物量均呈现逐渐减少的趋势(表1),各处理与CK 间差异显著(P< 0.05),在Zn2000处理下生物量最低,地下、地上生物量分别仅为CK 的7.74%、8.62%;而根冠比整体呈现先升高后降低的趋势,在Zn1000时最大,与CK 和其他3 个处理组之间差异显著(P< 0.05)。
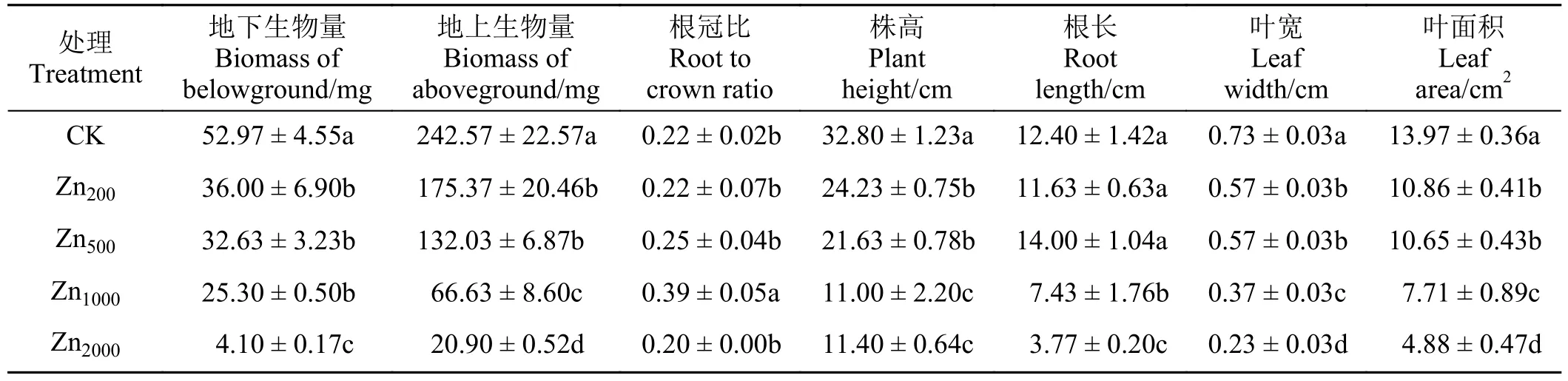
表1 Zn 胁迫对玉蝉花生长的影响Table 1 The effects of Zn stress on the growth of Iris ensata
2.1.2 Zn 胁迫对玉蝉花株高和根长的影响
Zn 浓度越高,玉蝉花生长受到的抑制作用越大,植株越矮小(表1)。与CK 相比,Zn200、Zn500、Zn1000、Zn2000的株高分别减少了26.13%、34.05%、66.46%、65.24%;随着Zn 浓度增加,根长呈先减少后增加再减少的趋势,在Zn200、Zn1000、Zn2000时较CK 分别减少了6.21%、40.08%、69.60%,而在Zn500时增加了12.90%。
2.1.3 Zn 胁迫对玉蝉花叶宽、叶面积的影响
玉蝉花叶片随着胁迫浓度的升高逐渐变窄(表1),在Zn200、Zn500时均比CK 减少了21.92%,两组叶片宽度相同;而在Zn1000、Zn2000叶宽降幅增大,与CK相比分别显著降低了49.32%和68.49% (P< 0.05);叶面积也随着胁迫浓度升高呈逐渐变小的趋势,与CK相比,Zn200、Zn500、Zn1000、Zn2000分别降低了22.26%、23.77%、44.81%、65.07%,各处理与CK 间呈现显著差异(P< 0.05),Zn200与Zn500间差异不显著(P> 0.05) 。
2.2 Zn 胁迫对玉蝉花光合作用的影响
2.2.1 Zn 胁迫对玉蝉花光合气体交换参数的影响
Pn与Tr和Gs随着胁迫浓度的升高均表现出相似的下降趋势,并且在最高浓度处理时数值达到最低(图1)。在Zn2000时,玉蝉花幼苗的Pn、Tr、Gs均显著低于对照(P< 0.05),分别降低了89.85%、78.97%、77.04%;然而,Ci随Zn 浓度的升高呈现逐渐增大的趋势,各处理间均差异显著,分别比CK 增加了1.15、1.25、1.32、1.37 倍。

图1 Zn 胁迫对玉蝉叶片光合气体交换参数的影响Figure 1 The effects of Zn stress on photosynthetic gas exchange parameters in the leaves of Iris ensata
2.2.2 Zn 胁迫对玉蝉花叶绿素含量的影响
各处理组的叶绿素a 含量均低于CK,并随着处理浓度的升高表现为逐渐减少的趋势(表2)。Zn200、Zn500与CK 相比降幅不大,差异不显著(P>0.05),两者叶绿素a 含量分别为CK 的98.95%、90.53%;高浓度时降幅增大,Zn1000、Zn2000处理组含量分别为CK 的65.26%、62.11%,与CK 相比显著下降(P<0.05)。叶绿素b 含量表现为先小幅度增加后降低,在Zn200时含量最高,但并未与CK 组有显著差异;Zn2000时含量最低,较CK 下降了35.29%。随着胁迫增强,总叶绿素含量呈现逐渐降低的趋势,在最高胁迫浓度时有最小值;Zn200与CK 间差异不大(P>0.05),仅降低了0.78%;Zn500、Zn1000、Zn2000与CK相比分别下降了9.30%、29.46%、36.43%。叶绿素a/b 随着胁迫浓度的升高表现出不同程度的降低。Zn1000较CK 下降了20.71%,降低幅度最大,与CK有显著差异(P< 0.05),Zn200、Zn500、Zn2000与CK 相比降幅较小,差异不显著(P> 0.05)。

表2 Zn 胁迫对玉蝉花叶绿素含量的影响Table 2 The effects of Zn stress on the chlorophyll content of Iris ensata
2.3 Zn 胁迫对玉蝉花丙二醛含量和抗氧化酶活性的影响
随着处理浓度的增加,玉蝉体内MDA 含量总体呈递增趋势(图2)。Zn200较CK 显著增加了32.66%(P< 0.05);Zn500、Zn1000、Zn2000与CK 差异显著(P<0.05),分别为CK 的1.69、1.81、2.28 倍。
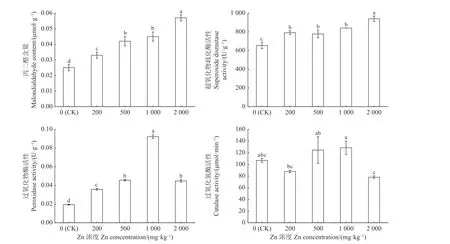
图2 Zn 胁迫对玉蝉花丙二醛含量和抗氧化酶活性的影响Figure 2 The effects of Zn stress on the malondialdehyde content and antioxidant enzyme activities of Iris ensata
随着胁迫浓度的增加,各处理的SOD 活性与CK 相比均有不同程度的升高(图2),差异显著(P<0.05)。在最大浓度Zn2000达到最大值,是CK 的1.44倍。Zn200、Zn500、Zn1000之间差异不显著(P> 0.05),与CK 相比分别增长了21.01%、18.93%、28.59%。
随着Zn 浓度的升高,玉蝉叶的POD 活性呈现先升高后降低的变化趋势(图2),在Zn1000处理下最大,为0.09 U·g-1。Zn500和Zn2000处理间差异不显著(P> 0.05),其余处理组之间差异显著(P< 0.05),所有处理组分别是CK 的1.85、2.35、4.75、2.31 倍。
CAT 的变化趋势与SOD 和POD 明显不同(图2)。在Zn2000时CAT 活性最低,在Zn1000时活性最高,Zn500和Zn1000分别高于CK 16.64%和20.29%,Zn200和Zn2000分别低于CK 17.76%和26.97%;各处理组与CK 差异不显著(P> 0.05)。
3 玉蝉花对Zn 的富集转运研究
3.1 玉蝉花对Zn 的富集转运
随着Zn 胁迫浓度的升高,玉蝉花地上、地下部分富集量均呈逐渐增大的趋势,在最高胁迫浓度时最大(表3)。但玉蝉不同部位对Zn 的富集效果存在差异,地下部分富集量明显高于地上部分富集量,前者的富集量是后者的1.37 倍~8.43 倍。在Zn 处理下,转运系数的范围为0.12~0.73,随着浓度增加呈逐渐上升趋势,在2 000 mg·kg-1时达最大。
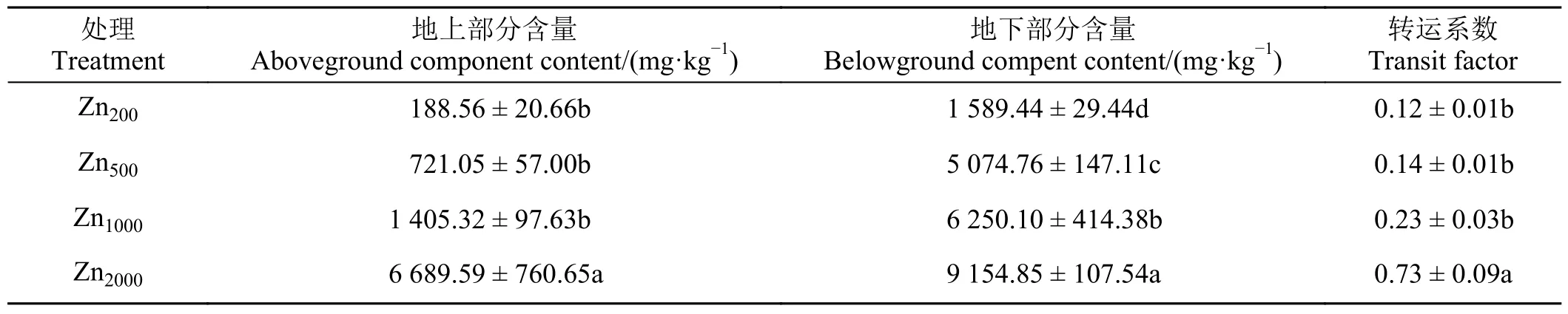
表3 Zn 胁迫下玉蝉花中Zn 的富集转运Table 3 Concentration and translocation of Zn in Iris ensata under Zn stress
3.2 玉蝉花体内Zn 亚细胞分布
不同浓度Zn 胁迫下,玉蝉花的地上部分亚细胞组分中Zn 含量不同。Zn200和Zn2000表现出FCW(细胞壁组分) > FS (可溶性组分) > FCO (细胞器组分),即Zn 在低浓度和高浓度时主要存在于玉蝉花地上部分的细胞壁和可溶性物质中,在2 000 mg·kg-1时两者存在的Zn 含量占比分别达到75.54%和20.12%(表4)。Zn 在细胞器中含量较少,在200 mg·kg-1处理时未在细胞器中检测到,但在500、1 000 mg·kg-1时占比较多,分别达到10.81%、6.25%;而地下部分Zn 的亚细胞分布表现为:在Zn200低浓度处理时,玉蝉花锌亚细胞分布表现与地上部分相同,即FCW >FS > FCO,细 胞 壁 中Zn 含 量 大 于 可 溶 性 物 质 中Zn 含量,占比分别为46.34%和44.51%,还有9.15%Zn 存在于细胞器组分中;随着胁迫的增强,在500 mg·kg-1及以上浓度时则表现为FS > FCW > FCO,即绝大部分的Zn 都被贮存于可溶性组分中,为46.11%~52.21%;其次是细胞壁部分,所占比例33.01%~41.02%。只有极少部分存在于细胞器组分中,仅有6.77%~19.77%。

表4 Zn 胁迫下玉蝉花亚细胞组分中Zn 浓度Table 4 Zinc concentrations in the subcellular components of Iris ensata under zinc stress μg·mL-1
4 讨论
Zn 是植物生长发育的必需微量元素,但其含量超过阈值时会抑制植物光合作用、呼吸作用、细胞分裂等必须的生理活动,导致植物生长受损,受到毒害[14]。在本研究中,大多数生长指标(株高、叶宽、叶面积)和各生物量(地上、地下)显著低于CK(P< 0.05),玉蝉幼苗的生长发育在不同浓度的Zn 胁迫下均受到明显抑制。在Zn2000最高浓度胁迫下,植株高度仅为CK 的35%;叶片卷曲,失绿明显。这说明重金属浓度越高,植物受到的毒害越强。
光合作用是植物体重要的生理生化过程,它的强弱对植物正常生长、产量及抗逆性都具有十分重要的影响,因而光合作用可以作为判断植物生长和抗逆性大小的指标。在本研究中, Tr与Pn和Gs显著降低,而Ci呈现逐渐升高的趋势,说明玉蝉光合速率的降低是非气孔限制的因素[15-16]。这与甘龙等[17]在苘麻(Abutilon theophrasti)的研究结果相似。研究中受高浓度胁迫的玉蝉花叶片萎黄严重,是Zn 过量的明显症状之一。这可能是由于相似的离子半径,Zn2+取代了Fe2+、Mg2+,与叶绿体蛋白质上的巯基结合,破坏叶绿素的结构和功能,导致叶绿素分解加快,含量降低[14]。叶绿素a 含量与总叶绿素含量都随着处理浓度的增加表现出明显下降趋势,这与易心钰等[18]在蓖麻上(Ricinus communis)的研究结果一致。与叶绿素总量相比,叶绿素a/b 值是衡量叶片感受重金属的相对敏感的一个生理指标[19]。本研究中,叶绿素a 含量最先遭到破坏,下降速率最大。尽管叶绿素b 的含量在低浓度时小幅增高,但在浓度大于Zn200时还是与叶绿素a/b 值一样呈持续下降趋势。产生这种现象的原因可能是叶绿素b 起着重要的吸收和传递光能的作用,在逆境中的植物会相应提高叶绿素b 含量以避免光抑制,可能是植物应对Zn 胁迫的一种自身保护机制[20]。受到重金属毒害的植物体积累了大量的活性氧自由基,加剧膜脂质过氧化程度,同时形成MDA。植物体内的MDA 含量在一定程度上体现了细胞的受伤害程度,含量越高,植物受到的伤害越显著[21]。研究中MDA 含量随着Zn 浓度增大而升高,且不同浓度的胁迫均与CK 组有显著差异。表明玉蝉花细胞膜脂质过氧化加重,活性氧自由基积累过量,细胞膜透性增加,植物体受损严重。这与余国源等[22]对伞房决明(Cassia corymbosa)的研究结果一致。植物体内存在抗氧化酶系统,当受到逆境胁迫时植物通过SOD、POD、CAT 在内的抗氧化酶系统协同作用来清除逆境胁迫造成的活性氧(reactive oxygen species,ROS),从而降低对植物体的伤害[7]。SOD 可以抑制羟基自由基等有毒物质的形成,将超氧阴离子自由基歧化为H2O2和O2;POD、CAT 又能进一步将SOD 的歧化产物H2O2,转化为对植物无害的H2O 和O2[23]。本研究中,随着胁迫浓度的增加,各处理组的SOD 活性均显著高于CK,在Zn2000时达到最大。这与Pb 胁迫下金丝草(Pogonatherum crinitum)[24]根系抗氧化酶活性“先升后降”的结果有所不同,这是因为发挥作用的酶类型可能是Cu, Zn-SOD 酶,Zn 作为辅助因子促使SOD 合成,使得SOD 酶活性持续升高来缓解活性氧自由基对质膜系统的过氧化作用,这与Wang 和Jin[25]对玉米(Zea mays)的研究结果相似。POD 活性呈现先增后减的趋势,在Zn200、Zn500、Zn1000时含量持续升高,在Zn2000时大幅度下降,说明Zn 在一定浓度范围时,被激活后的POD 活性上升,可以清除组织中存在的少量H2O2。当Zn 浓度增大,细胞膜受伤程度加重,抗氧化酶系统受损,不能被及时清除的H2O2等有害物质大量积累,导致POD 活性急剧下降。当胁迫发生时,植物会提高自身抗性来抵御不利的环境,但当逆境压力超过植物的耐受极限时,机体防御机制也会遭到破坏,这与谢勇和王友绍[26]的研究结果相似。CAT 与POD 有着类似的功能,共同承担着清除活性氧、保护细胞膜结构的作用,使植物体维持正常的膜渗透[27]。但在本研究中CAT 的变化趋势与POD 不同。当玉蝉遭受低浓度胁迫时,CAT 并未第一时间被激活,此时植物体内CAT 含量低于CK。但随着浓度增加,开始呈先上升后下降的趋势,Zn1000时活性最强,最高浓度胁迫CAT 活性低于最低浓度胁迫时的活性。说明当胁迫超出植物体的耐受限度时,抗氧化酶系统不足以抵御外界环境的压力,迫使酶活性降低。此研究结果与王琳等[23]对菖蒲(Acorus calamus)的研究结果类似。此外在本研究中,POD 与CAT 在参与H2O2的转化过程中有一定的差别,CAT 与POD相比,激活较慢。
在本研究中,玉蝉花对重金属Zn 的富集量随着胁迫浓度的增加而增大,并在最高浓度处理时达到吸收顶峰。根作为最先接触到重金属离子的器官,也是贮存重金属的重要场所,在不同浓度的Zn 胁迫下玉蝉地下部分的富集量始终高于地上部分。这是由于根系细胞壁由果胶、纤维素、半纤维素、细胞壁蛋白等多种组分组成,其中果胶和半纤维素被认为是细胞壁结合重金属的主要组分。去甲酯后的果胶带有大量的羧基负电荷,对二价、三价的金属离子亲和力大大增强,可以吸附过量的Zn2+从而避免进入细胞内部,减轻对玉蝉的伤害[28]。半纤维素的成分和结构决定了它不仅可以发挥加固细胞壁的功能,同时也是植物细胞壁固定金属离子的重要结合位点[29]。陈世宝等[30]发现,去除半纤维素后,不同植物的细胞壁对锌的吸附能力大大降低,吸附量显著下降。植物根系通过果胶和半纤维素对重金属的吸附,将绝大多数金属离子积累在根中,有效阻缓了Zn2+向地上部分和环境迁移,弱化了锌对植物的毒害。Zn 是必需的微量元素,植物体内正常的Zn 含量为20~150 mg·kg-1[31]。本研究中玉蝉花富集的Zn 的含量远高于正常条件下的Zn 含量,说明除了根系细胞壁的固持作用减少了Zn 向上转运之外,植物体内应有着相应的解毒机制。结合亚细胞分布来看,细胞壁和可溶性组分是玉蝉花贮存重金属的重要场所。绝大部分的Zn 都贮存于可溶性组分中,这可能是因为植物为了缓解重金属毒害,将重金属离子在液泡内进行区隔化来降低细胞中重金属离子的水平,加强对Zn 的耐性。目前研究发现,液泡是积累包括锌、镉在内的许多重金属的场所[32]。除液泡的区隔化作用之外,植物络合素(phytochelatin synthase, PCs)和金属硫蛋白(metallothioneins, MTs)也可以缓解重金属的毒害[33],这可能是玉蝉花主要的耐性机制。本研究中,玉蝉转运系数随着重金属浓度的增加而逐渐增大,最大值为0.733。说明玉蝉花对Zn 的转运能力不强,大多数还是限制在根部,但其运输机制未遭到破坏,并没有限制对Zn 的向上运输。Baker 等[34]认为,能富集超过10 000 mg·kg-1的Zn 含量且地上部分重金属含量 > 地下部分(转运系数 > 1)的植物就称为Zn 超富集植物。在Zn 浓度为2 000 mg·kg-1的土壤中,玉蝉总富集含量高达15 844.44 mg·kg-1,但地下部分富集量大于地上部分,分别为9 154.85 和6 689.59 mg·kg-1。所以玉蝉花不是Zn 超富集植物,但具有一定的富集能力。
5 结论
随着土壤中Zn 浓度的升高,玉蝉花受到的伤害逐渐加重:在形态上,植株表现为株高变矮、根长缩短、叶片变窄且失绿卷曲,生物量也随之减小;玉蝉花能通过上调超氧化物歧化酶、过氧化物酶、过氧化氢酶活性来应对Zn 胁迫,但过量重金属进入植物体内细胞膜造成伤害,丙二醛含量升高,植株体内一系列生理生化反应发生变化,总叶绿素含量降低、光合速率减慢,导致植物生长物质能量减少,抑制了玉蝉花生长;在富集和转运上,玉蝉花体内Zn 含量呈上升趋势,但地下部分的重金属含量始终高于地上部分,可见玉蝉花对Zn 的转运能力不强,不属于超富集植物。从亚细胞分布来看,地上部分细胞壁结合了大部分Zn,地下部分的Zn 主要积累在细胞壁和可溶性组分中。综上所述,可为进一步提高玉蝉花耐Zn 能力研究奠定基础,从而扩大玉蝉花在不同污染区的园林应用范围。
