血清LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平与老年急性脑梗死的相关性研究
2024-03-13刘海颖
张 萌,刘海颖,齐 畅
急性脑梗死(acute cerebral infarction, ACI)主要发生机制为动脉粥样硬化,约占脑血管疾病70%,病死率为5%~15%,致残率达50%以上[1]。有研究显示,高龄是诱发该病的高危因素[2]。ACI神经轻度缺血缺氧可引起头晕、头痛等症状,随着缺血缺氧持续加重,可造成神经组织病变或坏死,严重损伤患者神经功能[3]。动脉粥样硬化是诱发ACI的关键环节,而血脂代谢异常是引起动脉粥样硬化的主要原因之一,主要表现为低密度脂蛋白胆固醇(LDL-C)升高,LDL-C持续升高可促进动脉粥样硬化进程[4]。传统血脂指标无法满足动脉粥样硬化诊断和预测,临床研究显示,LDL-C/高密度脂蛋白胆固醇(HDL-C)、非高密度脂蛋白胆固醇(non-HDL-C)、残粒脂蛋白胆固醇(RLP-C)、可溶性凝集素样氧化低密度脂蛋白受体-1(sLOX-1)等指标与动脉粥样硬化密切相关,进而介导ACI进展[5-7]。但目前有关LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1与老年ACI相关性的临床研究鲜见。故本研究分析老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平与神经功能缺损、颈动脉粥样硬化斑块的相关性。
1 资料与方法
1.1 一般资料
选取2022年1月—2023年8月廊坊市第四人民医院收治的230例老年ACI作为研究组。纳入标准:均符合《中国急性缺血性脑卒中诊治指南2018》[8]中ACI诊断标准;均经影像学检查确诊;年龄≥60岁;均为首次发病,发病时间≤72 h;入院72 h完成颈动脉彩超检查;近6个月内无糖皮质激素药物治疗史。排除标准:甲状腺功能减退或亢进;近期有手术、感染和出血史;恶性肿瘤;血液疾病或结缔组织疾病;非血管性因素所致的认知障碍;因烟雾病、动脉炎所致的脑梗死;心源性脑栓塞;合并严重器官功能不全;发病前3个月服用他汀类药物;有头部外伤史;隐匿性脑血管畸形。按照2∶1配比原则选择同期、同年龄段115例健康体检者作为对照组。本研究经廊坊市第四人民医院伦理委员会批准(20220703),受试者均签署知情同意书。
1.2 LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1检测
采集对照组体检当日、研究组入院24 h内静脉血5 mL,以3 000 r/min离心5 min,取上清液。使用AU5800全自动生化分析仪(美国贝克曼库尔特公司)检测总胆固醇(TC)、三酰甘油(TG)、LDL-C、HDL-C,并计算LDL-C/HDL-C、non-HDL-C、RLP-C水平。采用酶联免疫吸附试验检测sLOX-1水平,试剂盒购于武汉艾美捷科技有限公司。
1.3 颈动脉超声检查
使用Voluson E8型彩色多普勒超声检查仪(美国GE公司)行颈动脉超声检查,均由2名经验丰富(工作时间>3年)医师操作,探头频率7~12 MHz,ACI患者取仰卧位,偏头暴露颈部,扫描颈总动脉、颈内外动脉及分叉部位,在颈动脉分叉近端后壁约1.5 cm处测量颈动脉内中膜厚度(IMT),测量3次取平均值,其中IMT<1.0 mm为正常,IMT 1.0~1.5 mm为IMT增厚,IMT>1.5 mm为斑块形成[9]。
观察斑块回声、形态特征,将斑块回声均匀的扁平斑、斑块钙化或纤维化、部分回声增强、后方回声减弱,内膜光滑、硬斑,无斑块内出血判为稳定斑块;若出现软斑、混合斑及溃疡斑,斑块呈低、中回声,有斑块内出血判为不稳定斑块[10]。根据有无斑块及斑块特点分为无斑块、稳定斑块及不稳定斑块。
1.4 美国国立卫生研究院卒中量表(NIHSS)评分
研究组入院48 h内采用NIHSS评分评估神经功能缺损程度[11],该量表总分42分,涉及11个项目,<7分为轻度神经功能缺损,7~15分为中度神经功能缺损,>15分为重度神经功能缺损。
1.5 观察指标
1)比较2组临床资料,包括年龄、性别、饮酒史、吸烟史、既往史、空腹血糖(FBG)、TG、TC、C反应蛋白(CRP)、同型半胱氨酸(HCY)。2)比较2组LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平。3)比较不同斑块稳定性、神经功能缺损及IMT老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平。4)分析LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平与老年ACI的关系。5)分析LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平与斑块稳定性、IMT、NIHSS评分的相关性。
1.6 统计学方法

2 结果
2.1 临床资料比较
2组年龄、性别、饮酒史、吸烟史、既往史、FBG、TC比较差异无统计学意义(P>0.05);研究组TG、HCY、CRP高于对照组(P<0.01)。见表1。

表1 2组研究对象临床资料比较
2.2 2组LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平比较
研究组LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平高于对照组(P<0.01)。见表2。

表2 2组研究对象LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平比较
2.3 不同病情老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平比较
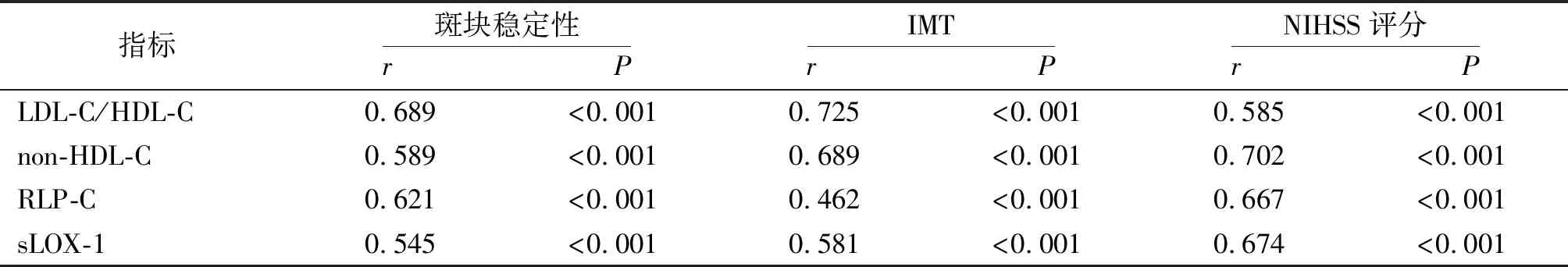
不同斑块稳定性、神经功能缺损程度及IMT老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平比较差异有统计学意义(P<0.01)。老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平比较发现,无斑块患者<稳定斑块患者<不稳定斑块患者,轻度神经功能缺损患者<中度神经功能缺损患者<重度神经功能缺损患者,IMT正常患者 表3 不同斑块稳定性老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平比较 表4 不同神经功能缺损程度老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平比较 表5 不同IMT老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平比较 控制表1中差异有意义的自变量后偏回归分析结果显示,LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平与老年ACI密切相关(P<0.01)。见表6。 表6 偏回归分析LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平与老年ACI的关系 研究组LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平分别与斑块稳定性、IMT、NIHSS评分呈正相关(P<0.01)。见表7。 表7 老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C及sLOX-1水平与斑块稳定性、IMT、NIHSS评分相关性 有学者认为,ACI由脑血管狭窄和闭塞引发,可造成不同程度神经功能损伤,严重时患者可出现意识障碍,危及生命[12]。而动脉粥样硬化是诱发ACI最常见的原因,其发生公认有3种学说:1)脂质渗入学说,是早期病变表现,脂纹最早可出现在儿童期,是一种可逆性病理改变;2)血栓镶嵌学说,是脂纹脂质沉积表现,动脉血管壁中膜平滑肌细胞转移至内膜,形成部分增生纤维帽,最终演变为纤维斑块;3)损伤应答学说,即动脉粥样硬化经典表现,纤维斑块和粥样硬化斑块可造成动脉管腔狭窄[13-14]。可见,明确颈动脉粥样硬化程度对ACI早期预防有重要作用。 有研究证实,血脂代谢异常与动脉粥样硬化密切相关,而LDL-C、HDL-C异常表达是诱发冠心病和ACI的独立危险因素[15]。LDL-C是胆固醇主要运输形式,可促进动脉壁中胆固醇沉积和内流,长时间停留血管内可被氧化修饰为氧化型低密度脂蛋白(ox-LDL),进而导致动脉粥样硬化的发生,并加速动脉粥样硬化的进展;HDL-C主要介导胆固醇的反向转运,从而发挥抗动脉粥样硬化作用[16]。LDL-C/HDL-C是评估动脉粥样硬化进程的主要指标,LDL-C/HDL-C比值越高,脑梗死神经缺损程度就越严重,动脉粥样硬化斑块就越不稳定[17]。non-HDL-C主要是指除HDL-C外所有脂蛋白的总和,有指南指出non-HDL-C可作为代谢综合征、糖尿病患者降脂疗效的评估标准,与传统血脂指标相比,non-HDL-C评估心脑血管疾病动脉粥样硬化的敏感度较高[18]。RLP-C是所有残粒脂蛋白颗粒所含的胆固醇,在空腹状态下可水解为极低密度脂蛋白、中间密度脂蛋白,但RLP-C直接检查程序复杂、敏感度较低[19]。VARBO等[20]根据脂质曲线提出了RLP-C的计算公式。已有研究证实通过公式计算的RLP-C预测疾病价值高于测量获得RLP-C[21]。RLP-C通过促进内皮黏附分子-1、血管细胞黏附分子-1表达,促进单核细胞在动脉壁聚集,是直接导致动脉粥样硬化形成的主要原因。此外,RLP-C残留物经多种酶修饰后可促进内皮细胞局部活化,形成多种损伤因子,进而激活巨噬细胞释放白细胞介素和肿瘤坏死因子,促进血管局部炎症形成[22]。本研究发现,研究组LDL-C/HDL-C、non-HDL-C、RLP-C水平高于对照组。提示LDL-C/HDL-C、non-HDL-C、RLP-C水平变化可介导ACI的发生发展。进一步比较不同病变程度老年ACI患者LDL-C/HDL-C、non-HDL-C、RLP-C水平发现,无斑块患者<稳定斑块患者<不稳定斑块患者,轻度神经功能缺损患者<中度神经功能缺损患者<重度神经功能缺损患者,IMT正常患者 凝集素样氧化低密度脂蛋白受体-1(LOX-1)是ox-LDL受体,在内皮细胞、活化血管平滑肌细胞和巨噬细胞中广泛表达。LOX-1还可在血小板表面暴露,通过抑制二磷酸腺苷诱导血小板聚集,从而参与动脉粥样硬化全过程[23]。在病理状态下LOX-1经蛋白酶水解成sLOX-1。近年有研究证实,251例急性冠脉综合征患者血浆sLOX-1水平高于对照组,还证实sLOX-1是患者预后不良的危险因素,高水平sLOX-1与患者动脉粥样硬化斑块稳定性、狭窄程度密切相关[24]。本研究发现,老年ACI患者sLOX-1变化趋势与LDL-C/HDL-C、non-HDL-C、RLP-C一致。表明sLOX-1水平升高可参与老年ACI患者颈动脉粥样硬化斑块产生和形成,加重患者神经功能缺损程度,与相关研究结果相似[24]。本研究进一步分析发现,LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平与老年ACI密切相关,且与斑块稳定性、IMT、NIHSS评分呈正相关。表明上述指标水平升高,可促进患者IMT增加,利于软斑、混合斑等形成,其水平越高患者神经功能缺损程度也就越严重,不利于疾病控制。 综上所述,LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平在老年ACI患者中明显升高,是诱导ACI发生的危险因素,且与患者神经功能缺损程度、IMT呈正相关。可见积极监测LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1表达,对老年ACI患者的临床诊疗具有一定指导意义。


2.4 LDL-C/HDL-C、non-HDL-C、RLP-C、sLOX-1水平与老年ACI的关系

2.5 相关性分析
3 讨论
