SLC35A2、前叶黄素亚基2在乳腺癌中的表达及其与临床观察指标和预后的关系
2024-03-13宋子旭朱光正郭晨旭武佳琪张立功钱军
宋子旭 朱光正 郭晨旭 武佳琪 张立功 钱军
1蚌埠医科大学第一附属医院肿瘤外科 (安徽蚌埠 233000);2阜阳市第二人民医院肿瘤内科 (安徽阜阳 236029)
乳腺癌现在是世界上最常见的癌症[1],也是所有女性癌症患者的主要死因[2],2020年估计全球新增病例230万例,占所有癌症病例的11.7%[3]。乳腺癌最常见的病理类型是浸润性导管癌(IDC),占所有浸润性乳腺癌的70%~80%[4-5]。根据乳腺肿瘤不同的临床特征和分子分型,患者接受不同的化疗及激素治疗[6],以及新兴的免疫治疗和靶向治疗[7],这些不同的治疗方案显著改善了患者的预后[8]。乳腺癌治疗的最新进展开创了精准医疗的新时代,了解用于评估预测性和预后性生物标志物对于高质量的肿瘤治疗至关重要[8-10]。
SLC35A2编码尿苷二磷酸-半乳糖转运蛋白,即一种多通道膜蛋白,参与糖基化过程,其基因突变与先天性糖基化障碍有关[11],而糖基化异常是多种癌症发展的关键病理步骤[12]。临床试验表明,SLC35A2高表达与乳腺癌和肝细胞癌患者预后不良有关[13]。
PFDN家族系预折叠素亚基家族由6个成员组成(PFDN1-6),PFDN2在膀胱癌和胃癌中异常表达,可以作为膀胱癌和胃癌的生物标志物[14]。然而,PFDN2在乳腺癌中表达差异及在影响其预后中的作用仍然未知。
在本研究中,我们利用生物信息学前期分析、免疫组化、qRT-PCR和真实临床信息及患者随访以探究SLC35A2、PFDN2在乳腺癌中的表达情况、其与乳腺癌临床指标的相关性,以及对乳腺癌预后的影响,以期为乳腺癌提供潜在治疗靶点及预测其预后。
1 资料与方法
1.1 资料选取蚌埠医学院第一附属医院2018年1月1日至12月31日在肿瘤外科收治的80例女性乳腺癌患者纳入此研究。纳入标准为:(1)行乳腺癌改良根治术且术后病理明确为浸润性导管癌;(2)术前胸片、彩超、CT未见明确的肿瘤侵犯周围的实质脏器;(3)术前未经放疗、化疗。收集患者一般临床资料包括患癌年龄、肿瘤直径、淋巴结转移情况、组织学分级、ER、PR、HER-2、Ki-67及患者随访预后情况。通过电话随访方式,随访情况中总生存期(OS)为确诊日至死亡日或最后随访日,随访至2023年10月,总时间跨度最长为105个月。本研究经过蚌埠医学院第一附属医院医学伦理委员会批准[批准号:蚌医一附伦(2023)01号]。
1.2 荧光定量PCR共收集5例乳腺癌患者样本,取适量乳腺癌组织和相应癌旁组织,采用Trizol-氯仿-异丙醇三步法提取组织匀浆中的总RNA并逆转录为cDNA。以GAPDH为内参。引物序列如下,见表1。反应体系配置完成后于荧光定量PCR仪上完成扩增,实验重复3次。采用染料法(SYBR Green I)进行相对定量分析,按照ΔΔCt法来进行统计分析。
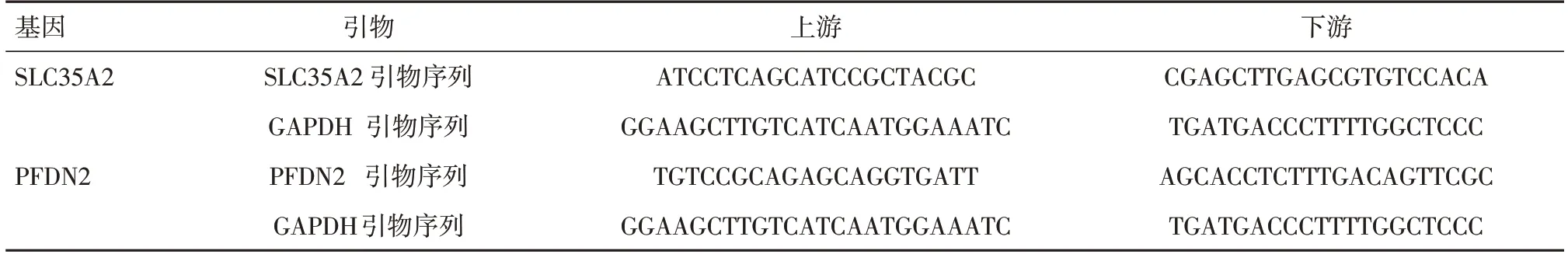
表1 引物序列Tab.1 Sequence of primers
1.3 免疫组化80例乳腺癌患者标本在10%甲醛溶液中固定后用石蜡包埋,切成5 μm厚的切片,用二甲苯脱蜡后加血清封闭液并进行抗原修复,添加一抗(1)SLC35A2一抗:proteintech公司,货号:13053-1-AP。(2)PFDN2一抗:abclonal公司,货号:A7233)于4 ℃冰箱中保存过夜。次日清晨,添加二抗(厂商:中杉金桥,货号:PV-6001)孵育半小时。加上SABC,然后置于37 ℃温箱中30 min。加显色剂后复染、脱水及封片,光镜下观察。
SLC35A2及PFDN2均主要在细胞质中表达。两基因表达评分标准:按染色强度打分,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。高倍镜下计数阳性细胞所占比例,共计数5个高倍镜视野,全为阴性细胞则为0分,阳性细胞≤ 10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。上述两者得分的乘积分>3分则判定为高表达,≤ 3分则为低表达。
1.5 统计学方法使用SPSS 24.0分析处理数据,采用Kaplan-Meier法绘制生存曲线,采用GraphPad 8.0.2绘制森林图。采用χ2检验研究SLC35A2、PFDN2在乳腺癌组织及其癌旁正常组织的表达差异以及两基因表达与临床指标的关系;采用COX回归进行预后的单因素及多因素分析;将SLC35A2及PFDN2按照表达差异分为四组,使用Kaplan-Meier生存分析其四组预后差异,使用对数秩(Log-rank)检验进行比较,并绘制生存曲线。所有结果均以P<0.05为差异有统计学意义,所有P值都是双侧的。
2 结果
2.1 生物信息学结果肿瘤浸润免疫数据库TIMER 2.0提示SLC35A2、PFDN2在各型乳腺癌癌组织及其他多种癌组织中呈高表达,见图1。UALCAN中的TCGA数据库提示与正常乳腺组织相比SLC35A2、PFDN2在各型乳腺癌组织中呈高表达,见图2。Kaplan-Meier Plotter绘制乳腺癌患者SLC35A2和PFDN2高、低表达组的总生存率存在明显差异(P<0.05),见图3。

图1 肿瘤浸润免疫数据库TIMER 2.0内SLC35A2、PFDN2在各型乳腺癌癌组织及其他多种癌组织中的表达情况Fig.1 Expression of SLC35A2 and PFDN2 in various types of breast cancer cancer tissues and a variety of other cancer tissues within the tumor infiltration immunodatabase TIMER 2.0

图2 TCGA数据库内SLC35A2、PFDN2在正常乳腺组织和各型乳腺癌组织中的表达情况Fig.2 Expression of SLC35A2 and PFDN2 in normal breast tissue and various types of breast cancer tissues within the TCGA database
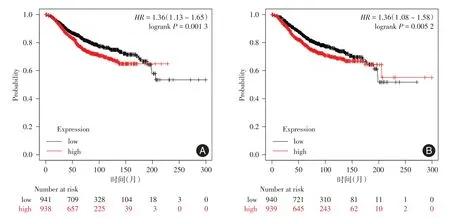
图3 Kaplan-Meier Plotter数据库中乳腺癌患者SLC35A2和 PFDN2高、低表达组的生存曲线Fig.3 Survival curves of breast cancer patients in the high and low expression groups of SLC35A2 and PFDN2 in the Kaplan-Meier Plotter database
2.2 SLC35A2、PFDN2在乳腺癌组织中呈高表达2.2.1 荧光定量PCR结果如图4所示,SLC35A2、PFDN2在乳腺癌组织中的表达显著高于两者在癌旁正常组织中的表达(P<0.05)。

图4 SLC35A2和PFDN2在乳腺癌组织和癌旁正常组织中的表达Fig.4 Expression of SLC35A2 and PFDN2 in breast cancer tissues and paracancerous normal tissues
2.2.2 免疫组化结果如图5及表2,相较于癌旁正常组织,乳腺癌组织中的SLC35A2、PFDN2高表达率升高,两者在癌组织和癌旁组织的表达差异有统计学意义(P<0.05)
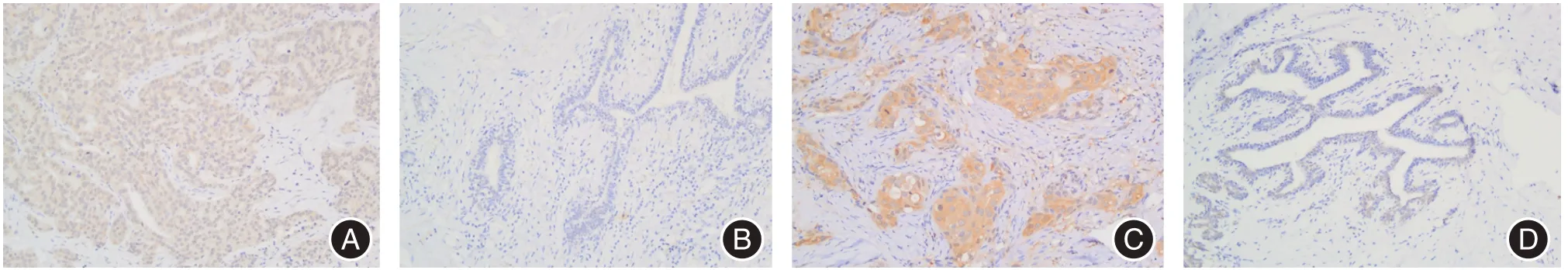
图5 SLC35A2、PFDN2免疫组化图(SP,× 200)Fig.5 Immunohistochemistry of SLC35A2,PFDN2(SP,× 200)

表2 SLC35A2、PFDN2在乳腺癌组织和癌旁组织中的表达Tab.2 Expression of SLC35A2 and PFDN2 in breast cancer tissues and paracancerous tissues 例(%)
2.3 SLC35A2、PFDN2的表达与各项临床指标的关系80例乳腺癌患者中,SLC35A2高表达50例,低表达30例;PFDN2高表达45例,低表达35例。如表3所示,SLC35A2高表达与淋巴结转移显著正相关;PFDN2高表达与肿瘤直径≥ 2 cm、淋巴结转移显著正相关(P<0.05)。

表3 SLC35A2、PFDN2表达情况与临床观察指标的关系Tab.3 Relationship between SLC35A2 and PFDN2 expression and clinical observables 例(%)
2.4 SLC35A2、PFDN2的表达与乳腺癌患者预后的关系共随访80例乳腺癌患者,排除随访失败3例,余77例纳入研究,随访3~56个月(中位48个月),其中死亡21例(27.3%)。如表4所示,相对于SLC35A2和PFDN2阴性患者而言,二者阳性患者OS显著降低(P<0.05)。即SLC35A2和PFDN2的表达是乳腺癌的独立预后因素(P<0.05)
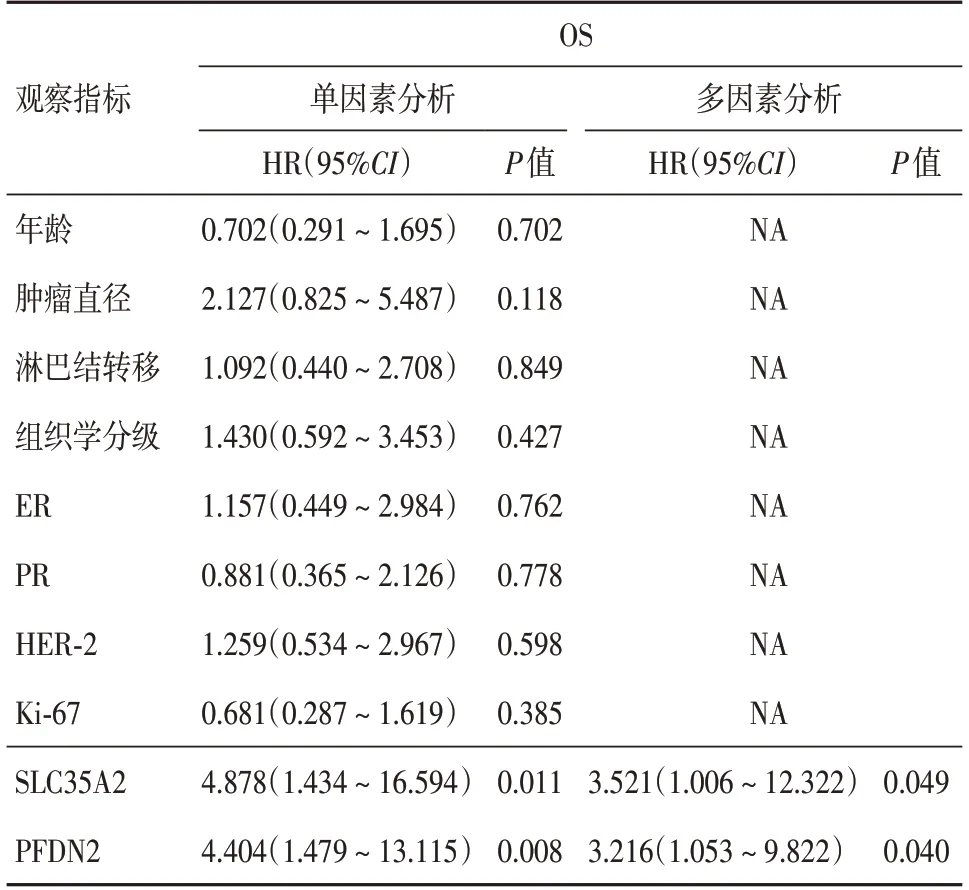
表4 乳腺癌预后单因素及多因素分析Tab.4 Univariate and Multivariate analysis of breast cancer prognosis
2.5 Kaplan⁃Meier生存分析将患者按SLC35A2和PFDN2的表达情况分为4组,A组32例(SLC35A2及PFDN2均为高表达);B组15例(SLC35A2高表达、PFDN2低表达);C组10例(SLC35A2低表达、PFDN2高表达);D组20例(SLC35A2及PFDN2均为低表达)。Kaplan-Meier生存分析及图6绘制的生存曲线提示4组存在明显预后差异,并且A组即SLC35A2和PFDN2均为高表达组预后最差,D组两者均为低表达组预后最好(P<0.05)。

图6 4组Kaplan-Meier生存曲线Fig.6 Four groups of Kaplan-Meier survival curves
3 讨论
存在于Xp11.23染色体上的溶质运载家族35成员A2(SLC35A2)基因编码一种多通道膜蛋白,可将尿苷二磷酸(UDP)-半乳糖(合成聚糖链的糖基供体)从细胞质转运到高尔基体的管腔,然后再转运到内质网。高尔基体中糖蛋白上的N-和O-糖基化需要UDP-半乳糖转运体(UGT;SLC35A2)[15]。内质网中也需要它来合成半乳糖基甘油酰胺和半乳糖基二甘油酯。最近的研究发现,糖基化异常是癌症发展的关键病理步骤[12],对特定的细胞功能有明确的影响,并可作为多种肿瘤类型的生物标志物[16]。如大名鼎鼎的CA125和CA19-9,两者异常糖基化分别导致癌症进展和肿瘤复发[17-18]。更有研究指出糖基化异常是治疗癌症的免疫治疗靶点[19]。核苷酸糖是糖基转移酶的供体,正常细胞和肿瘤细胞中的糖基转移酶表达量不同,它们的变化可用于识别相关的乳腺癌生物标记物[20]。因此,评估癌症中的异常糖基化可为预测预后和开发个性化癌症治疗提供潜在靶点,而SLC35A2基因突变会诱发先天性糖基化障碍[21]。所以研究SLC35A2在乳腺癌中的表达及其表达对预后的影响可能对于寻找乳腺癌新的治疗靶点和预测其预后提供一种新思路。
PFDN是由2个α亚基(PFDN3、PFDN5)和4个β亚基(PFDN1、PFDN2、PFDN4和PFDN6)组成的分子伴侣复合体,主要功能是促进微管蛋白和肌动蛋白等蛋白质的正确折叠[22]。最近,PFDN家族因其在癌症中的异常表达及其在肿瘤生物学中的潜在意义而受到越来越多的关注[23]。PFDN2属于预折叠素亚基家族,可结合并稳定新合成的多肽[24]。有研究[14]表明PFDN2在胃癌中高表达,并且PFDN2的上调与胃癌的进展相关,并可能为胃癌提供一种新的肿瘤标志物和潜在靶点。YES⁃SEYEVA等[25]的研究显示在胃癌中高mRNA表达的PFDN2显示出不良的OS。然而目前尚无对于PFDN2在乳腺癌中表达差异及预后的相关研究。
我们通过生信、qRT-PCR、免疫组化的方法研究SLC35A2及PFDN2在乳腺癌中的表达情况并找寻两者高表达与临床观察指标及其预后的关系。本研究结果显示:相较其癌旁组织而言,SLC35A2、PFDN2在乳腺癌癌组织中高表达率显著升高,且SLC35A2的表达与淋巴结转移情况显著相关,PFDN2的表达与肿瘤直径及淋巴结转移情况显著相关。SLC35A2和PFDN2的表达是乳腺癌的预后生存的主要风险因素,且SLC35A2与PFDN2均为高表达的患者预后最差。这些结果可以对乳腺癌临床治疗提供重要参考。当然,本研究仍具有一定局限性:(1)本研究病例数较少,需要纳入更多的病例进行研究,以更大程度减少因样本量小而造成的误差。(2)本研究未从细胞水平上检测两者的表达,待后期继续完善细胞实验。
