EP300对口腔鳞癌细胞增殖和迁移的影响
2024-03-13王亚培罗玉春唐婉容
王亚培,罗玉春,刘 为,刘 畅,唐婉容
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是世界上八大恶性肿瘤之一,也是最常见的头颈部鳞状细胞癌[1],目前全球口腔鳞癌的发病率约占头颈部鳞癌的60%[2]。流行病学研究揭示OSCC的发病机制主要与基因、烟草[3]、酒精、炎症、槟榔和人类乳头瘤病毒感染相关[4],发病机制并不明确。现阶段对OSCC的治疗通常是根据癌症的类型、位置、疾病的阶段采取以外科手术治疗作为首选并辅助放化疗的综合性治疗方法。术后咀嚼、吞咽以及言语等口腔功能的缺陷不同程度地影响了患者的身心健康,且头颈部鳞癌患者5年生存率徘徊在50%~60%[5-6]。EP300是一种组蛋白乙酰转移酶(histone acetyltransferase,HAT)[7],作为转录复合体的一部分,在细胞增殖、细胞周期调控、细胞凋亡、DNA损伤修复等多方面具有重要的生物学功能[8]。EP300基因突变与人类多种疾病(如肿瘤[9]、炎症[10]、鲁宾斯坦-泰比综合征[11]等)的发病机制密不可分。越来越多的研究表明,EP300的表达和突变与肿瘤的发生发展密切相关。但其与肿瘤的关系复杂,存在双重作用,即在不同的肿瘤类型或者肿瘤的不同阶段存在抑癌或者促癌作用,且其背后的作用机制与网络尚不明确。本实验旨在探讨EP300在口腔鳞癌细胞的表达水平及其生物学行为的影响。
1 材料与方法
1.1 实验细胞株及细胞培养
口腔鳞状细胞癌细胞株HSC3和UM1以及口腔黏膜上皮细胞株NOK,细胞已通过 STR 检测,细胞接种于DMEM高糖培养基,内含10%的胎牛血清和1%的青、链霉素,培养于 37 ℃、5%CO2的饱和湿度孵箱。
1.2 主要试剂
LipofectamineTM3000 转染试剂(Oriscience,中国);BCA蛋白浓度测定试剂盒(Solarbio,中国);ECL发光试剂盒(雅酶,中国);抗体:EP300(1∶1 000),β-tubulin(1∶2 000),羊抗兔/鼠二抗(1∶2 000)(Affinity,美国);CCK-8试剂盒(APExBio,美国);4%多聚甲醛(Biosharp,中国);结晶紫(碧云天,中国)。
1.3 生物信息学分析
通过UCSC(https://xenabrowser.net/)在线下载了泛癌数据集,从中提取EP300基因的表达数据,每个肿瘤中癌旁样本和肿瘤样本的表达差异是通过R软件(version 3.6.4)计算的,使用非配对的秩和检验进行差异显著性分析。又通过UALCA(http://ualcan.path.uab.edu/analysis.html)在线数据库分析了EP300在人头颈鳞癌细胞(HNSCC)不同临床分期、肿瘤分级及淋巴结转移状态和正常组织中差异表达。
1.4 qRT-PCR
检测EP300的mRNA表达使用RNA提取试剂盒提取细胞总RNA,使用Nanodrop仪器(Thermo,美国)检测RNA纯度和浓度。RNA经逆转录为cDNA,引物序列如下表所示(表1),PCR扩增EP300,以GAPDH作为内参。采用2-ΔΔCt法进行数据分析。
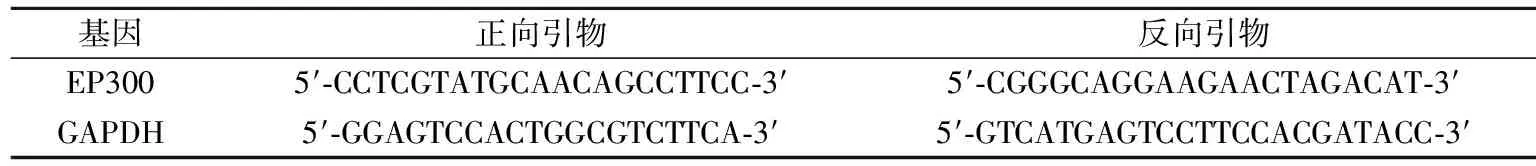
表1 引物序列Tab.1 Primer sequences
1.5 Western blot检测EP300的蛋白表达
接种细胞至10 cm培养皿并培养,用含蛋白酶抑制剂的RIPA裂解液裂解细胞并提取总蛋白,BCA法测定蛋白浓度,制作蛋白样本。SDS-PAGE凝胶电泳分离并电转蛋白至PVDF膜。快速封闭液常温封闭30 min。分别加入一抗EP300(1∶1 000),β-tubulin(1∶2 000),4 ℃孵育过夜,TBST冲洗3次,加入羊抗兔/鼠常温孵育1 h,ECL化学发光法曝光显色,使用Image J软件对蛋白条带灰度值进行分析。
1.6 细胞转染
EP300基因沉默及空载质粒合成自北京擎科生物科技有限公司,质粒中均具有嘌呤霉素抗性序列。当HSC3、UM1细胞株生长密度为70%~80%时进行细胞转染。采用LipofectamineTM3000 转染试剂将低表达EP300的质粒转染至HSC3、UM1细胞内,分别加入转染试剂。细胞筛选:每孔加入含适量浓度的嘌呤霉素培养基筛选7 d,获得稳转细胞株,后续使细胞一直处于含有嘌呤霉素的培养基中增殖。用嘌呤霉素筛选目标细胞,提取细胞株的总RNA,qRT-PCR和Western blot法分别检测细胞EP300基因和蛋白表达情况,以验证shRNA转染是否成功。
1.7 CCK-8法测定细胞增殖
按1 000个/孔的细胞量重复接种至96孔板中,分别在12、24、48、72、96 h更换10 μL CCK-8+100 μL新鲜培养基的混合液,酶标仪检测450 nm处的光密度值(optical density,OD),并绘制细胞生长曲线。
1.8 细胞平板克隆实验
将处于对数生长期的转染成功的细胞和对照组细胞以500个/孔接种于6孔板中,培养14 d左右(直至显微镜下观察绝大多数单个克隆细胞数≥50个),用4%多聚甲醛固定15 min,用0.1%结晶紫染色30 min,即可算每孔细胞克隆数,计算克隆形成率=克隆形成数/接种细胞×100%。
1.9 细胞划痕实验
将处于对数生长期的转染成功的细胞和对照组细胞以5×106个/孔接种至6孔板中,待汇合度达80%~90%时,用灭菌的1 mL枪尖在细胞生长中心区域进行划线,之后用PBS洗涤细胞两次,加入2 mL DMEM基础培养基,于倒置显微镜观察并拍照。
1.10 统计学分析
使用GraphPad Prism 9.4.1、Image J以及Adobe PhotoShop 23.0.0对本实验数据进行统计分析和绘图。两组数据之间的统计学差异采用t检验或非参数检验分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 EP300基因在泛癌组织及OSCC细胞株中的表达
通过在线数据库UCSC(https://xenabrowser.net/)下载并分析,最终获得了33个癌种的表达数据,结果显示在全身多系统恶性肿瘤组织及其正常组织中EP300基因均有表达,体内不同肿瘤组织中EP300的表达水平有显著差异,说明其在不同肿瘤中所发挥的作用也不尽相同。其中EP300在头颈部鳞癌HNSCC中的表达水平明显高于正常组织,(P<0.05)(图1A)。进一步应用在线数据库UALCAN分析肿瘤组织(n=520)及癌旁(正常)组织(n=44)中EP300的转录本数据发现,EP300在HNSCC组织中表达水平确实显著高于癌旁组织(P<0.05)(图1B),且EP300在临床分期Ⅰ~Ⅳ期,肿瘤分级GⅡ~Ⅳ级,无淋巴结转移及有淋巴结转移分期N1~N2期的HNSCC组织中表达水平明显高于癌旁组织(P<0.05)(图1C~E),表明在HNSCC中EP300可能发挥促癌基因的作用。
A:人体泛癌及正常组织中EP300的转录水平图;B:EP300在HNSCC中的表达;C:EP300在不同临床分期的HNSCC中的表达;D:EP300在不同病理分级的HNSCC中的表达;E:EP300在有无淋巴结转移的HNSCC中的表达。
2.2 口腔鳞癌细胞和正常口腔黏膜上皮细胞EP300表达水平分析比较
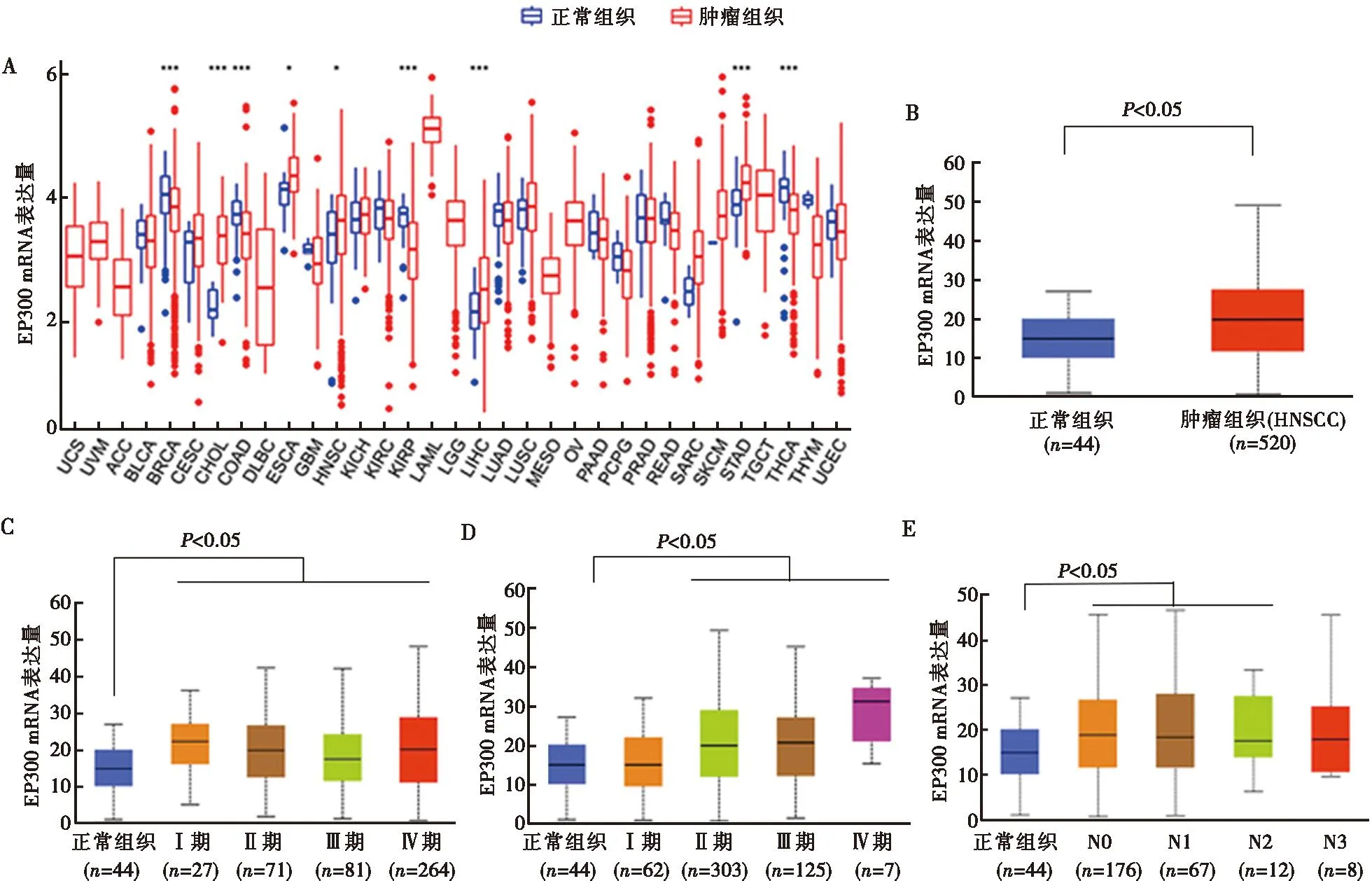
qRT-PCR检测正常口腔黏膜上皮细胞株NOK及两种OSCC细胞株HSC3和UM1细胞株中EP300基因的表达,发现OSCC细胞株EP300的表达均高于NOK细胞(P<0.05)(图2A)。进一步通过Western blot检测EP300蛋白表达,发现EP300在蛋白水平的表达情况和基因水平的表达情况一致,均为OSCC细胞表达高于正常细胞(P<0.05)(图2B)。
A:NOK、HSC3和UM1细胞株中EP300转录水平统计图;B:NOK、HSC3和UM1细胞株中EP300、β-tubulin蛋白的灰度值统计分析图(柱状图)及Western blot条带;*:P<0.05;***:P<0.001。
2.3 低表达EP300细胞系的构建与验证
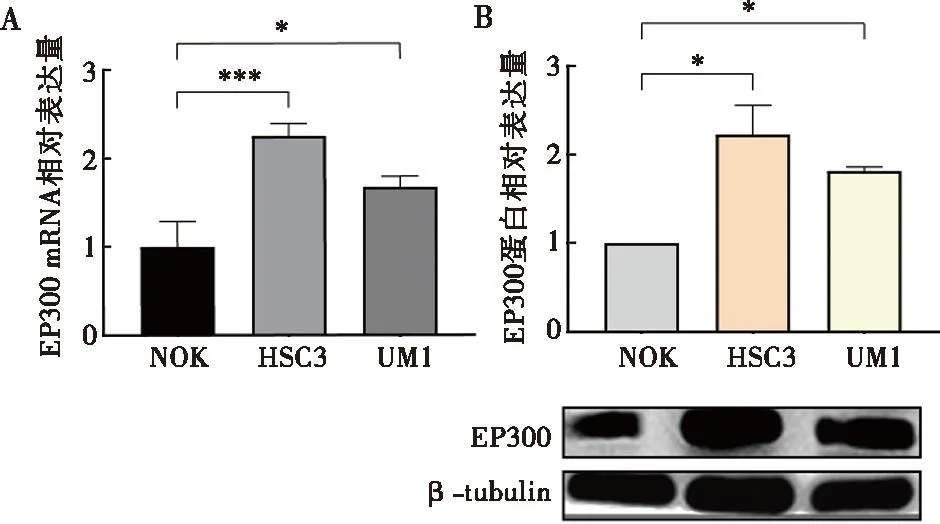
通过shRNA转染以及嘌呤霉素筛选目的细胞的方法,构建低表达EP300的HSC3和UM1细胞株,用于后续研究。用Western blot、qRT-PCR法检测各组细胞中EP300的表达水平,如结果所示,HSC3和UM1细胞株的EP300低表达组和对照组相比,EP300 mRNA和蛋白表达水平显著下降,差异具有统计学意义(P<0.05)(图3)。表明EP300基因已被沉默,成功构建低表达EP300的HSC3和UM1细胞株。
A:qPCR验证沉默HSC3和UM1细胞中EP300模型的构建;B:蛋白免疫印迹验证沉默HSC3和UM1细胞中EP300模型的构建;**:P<0.01;***:P<0.001;****:P<0.000 1。
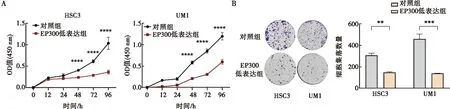
A:HSC3、UM1细胞对照组和EP300低表达组在0、12、24、48、72、96 h的细胞活力;B:HSC3、UM1细胞对照组file:///C:/Users/Administrator/Desktop/%E6%95%B0%E6%8D%AE%E5%8A%A0%E5%B7%A5/2024.03/KQYX202402/KQYX202402/KQYX202402.ebook/images/0c29daeed3dee8e8cf7894a74903cb7e.jpg和EP300低表达组在培养14 d后平板克隆图(左)和克隆数量统计分析图(右);**:P<0.01;***:P<0.001;****:P<0.000 1。
2.4 EP300表达水平对口腔鳞癌细胞增殖能力的影响
CCK-8法检测细胞12、24、48、72、96 h的细胞活力发现,与对照组相比,低表达EP300的HSC3和UM1组细胞增殖能力显著下降,差异具有统计学意义(P<0.05)(图 4A)。进一步通过平板克隆实验证明,低表达EP300的HSC3和UM1组细胞的集落形成能力显著下降(P<0.05)(图 4B),说明沉默EP300能明显抑制HSC3、UM1细胞的增殖能力。
2.5 EP300表达水平对口腔鳞癌细胞迁移能力的影响
划痕实验表明,HSC3、UM1细胞株的实验组和对照组相比,低表达EP300的HSC3和UM1组细胞的迁移能力显著下降(P<0.05)(图5)。
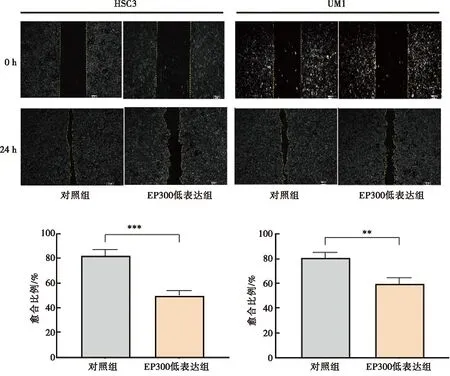
HSC3、UM1细胞对照组和EP300低表达组迁移0 h和24 h图片(上)以及迁移率的统计学分析图(下);**:P<0.01;***:P<0.001。
3 讨 论
口腔鳞状细胞癌显著相关的危险因素包括烟草、酒精、病毒感染(如EBV、HPV和单纯疱疹)等[12],其发病机制尚未明确。由于其存在转移性和侵袭性,即使在医学不断进步的背景下,患者5年生存率仍然较低[13]。目前口腔鳞癌的治疗重点已经转移到靶向治疗,尤其是在基因水平上靶向肿瘤细胞的增殖和凋亡作用。
EP300属于KAT3家族的组蛋白乙酰转移酶,分子量约为300 ku,是一种多功能多效大分子蛋白。EP300功能失调与人类多种疾病有关[14]。例如在人胶质母细胞瘤中的组蛋白H2B的高度乙酰化就主要是由BRD、CREBBP和EP300所驱动[15]。EP300还能增强β-catenin激活TCF的转录能力,并且对于β-catenin介导的肿瘤转化至关重要[16]。在不同类型的肿瘤中,EP300可作为促癌因子发挥作用,也能作为抑癌因子发挥作用[17-18]。其背后的作用机制主要包括:①乙酰化组蛋白促进转录[19];②乙酰化非组蛋白,从而增强其活性[20];③作为转录辅助因子[21],将转录因子募集到目标基因的启动子区域促转录。
EP300在口腔鳞癌中的具体作用还尚不清楚。研究前期生物信息学分析EP300基因在泛癌组织以及癌旁组织的表达水平发现,EP300基因在头颈部鳞癌的表达水平显著上调,因此,本课题组推测EP300基因可能作为一个促癌基因参与调控OSCC的进展。Cho等[22]已经用免疫组织化学染色证明证实了EP300在OSCC组织中过表达。我们进一步在细胞水平上进行验证,通过培养NOK、HSC3、UM1三种细胞系,分别检测了EP300在正常口腔黏膜上皮细胞以及口腔鳞癌细胞中的表达水平,结果发现OSCC细胞株中EP300蛋白和mRNA表达水平均显著高于NOK。为了进一步研究EP300对OSCC细胞多种生物学行为的影响,构建了沉默EP300基因的HSC3、UM1细胞株,通过相关实验证明EP300敲低后使OSCC细胞的增殖能力、迁移能力以及集落形成能力得到了显著抑制,表明EP300对口腔鳞癌的生长可能存在促进作用。
综上所述,口腔鳞癌中高表达的EP300作为促癌因子显著促进了肿瘤细胞的增殖和迁移。但其对肿瘤影响的具体作用机制尚不明确。有学者通过芯片模型分析发现EP300能使肿瘤对机体产生免疫抑制功能,且对肿瘤糖代谢也会产生影响[23]。因此本课题下一步将初步探索EP300基因对OSCC细胞糖代谢的影响,以挖掘EP300基因敲低后其胞内环境以及生物学行为改变的发生机制。
